9
ФУНКЦИИ КРОВООБРАЩЕНИЯ
ВЕХИ ИСТОРИИ
VII в. до
н. э — II в. н. э. — Гиппократ, Эразистрат, Аристотель (Древняя Греция), К. Гален
(С. Galenus Древний
Рим) создали учение о кровообращении, согласно которому кровь зарождалась в
печени, двигалась по сосудам от сердца к тканям и там исчезала. Различие между
артериями и венами не было известно. Предполагалось наличие сообщения между
правой и левой половинами сердца. Эти представления оставались догмой в течение
последующих 1500 лет.
XIII в. —
Ибн Нафис (Ibnul—Nafiess, Арабский Восток) описал легочный
кровоток и правильно понял его назначение Отверг представление о сообщении
между правой и левой половинами сердца.
XV в. —
Леонардо да Винчи (Leonardo
da Vinci, Италия) описал четыре камеры сердца,
атриовентрикулярные клапаны, их сухожильные хорды и сосочковые мышцы.
XVI в. — М.
Сервет (М. Servet, Испания)
повторно открыл существование малого круга кровообращения.
1620 — Г.
Асселиус (G. Asellius, Италия) впервые описал
лимфатические сосуды.
1628 – У.
Гарвей (W. Harvey, Англия) в трактате «Анатомические исследования о
движении сердца и крови у животных» описал большой и малый круги кровообращения
и объяснил их функции.
1661 — М.
Мальпиги (М. Malpighi, Италия)
открыл существование капилляров. 1816 — Р. Лаэннек (R. Laennec, Франция)
изобрел стетоскоп и разработал метод аускультации сердца.
1832 — Ж.
Марей (J. Маrеу, Франция) создал сфигмограф — прибор для регистрации
пульсовых колебаний стенок артерий.
1842 — А.
П. Вальтер (Россия) открыл влияние симпатических нервов на просвет кровеносных
сосудов.
1845 — Я.
Пуркинье (Пуркине) (J. Purkinje, Чехия) описал специфические
мышечные волокна, проводящие возбуждение по сердцу (волокна Пуркинье), положил
начало изучению проводящей системы сердца.
1845 —
Братья Эд. и Эр. Г. Веберы (Ed. Weber, Er. H. Weber, Германия)
обнаружили торможение сердца вплоть до полной его остановки в диастоле при
раздражении блуждающих нервов.
1843—1860 —
К. Людвиг (К. Ludwig, Германия)
установил наличие в продолговатом мозгу сосудодвигательного центра. Разработал
метод графической регистрации кровяного давления на кимографе изобрел прибор
для измерения скорости движения крови по сосудам (часы Людвига) Первым
предложил метод перфузии для поддержания функций изолированных органов
животных. В 1866 г. обнаружил центростремительный нерв—депрессор
(чувствительные волокна, идущие от барорецепторов сосудов в составе блуждающего
нерва).
1852 — К.
Бернар (К. Bernard, Франция)
описал роль симпатической нервной системы в регуляции просвета сосудов.
1867 — И.
Ф. Цион (Россия) описал учащение сердечной деятельности при раздражении
симпатических нервов сердца (положительный хронотропный эффект).
1870 — А.
Фик (A. Fick, Германия) разработал принцип определения минутного объема
кровотока, основанный на определении количества кислорода, поглощаемого
организмом за единицу времени, и сравнении содержания кислорода в артериальной
и венозной крови.
1871 — Ф.
В. Овсянников (Россия) открыл сосудодвигательный центр и описал его локализацию
в продолговатом мозгу.
1871 — Г.
Боудич (Н. Bowditch, США)
обнаружил постепенное достижение максимальной амплитуды сокращений сердца при
последовательных раздражениях одинаковой силы («лестница Боудича»).
1880 — Г.
Станниус (Н. Stannius, Германия)
показал убывание степени автоматии проводящей системы сердца лягушки по ходу
движения крови по органу — градиент автоматии.
1887 — У.
Шарпи и А. Уоллер (W. Sharpey, A. Waller,
Великобритания) впервые записали электрокардиограмму человека капиллярным
электрометром конструкции Липпмана. Уоллер предложил схему электрического поля
сердца, выдвинул представление о дипольной структуре сердца и электрической
оси.
1893 — В.
Гис (W. His, Германия) обнаружил предсердно—желудочковый пучок (пучок
Гиса).
1895 — О.
Франк (О. Frank,
Германия), Э. Старлинг (Е. Starling,
Великобритания) открыли физиологический закон, согласно которому сила
сокращения волокон миокарда пропорциональна первоначальной длине перед
началом сокращения («закон сердца», или
закон Франка—Старлинга).
1896 — С.
Рива—Роччи (S. Riva—Rocci, Италия)
разработал метод бескровного измерения артериального давления с помощью
ртутного сфигмоманометра. Момент измерения определялся путем пальпации места
проекции артерии.
1903 — В.
Эйнтховен (W. Einthoven, Нидерланды) создал первый
электрокардиограф на базе струнного гальванометра Швейггера. Предложил три стандартных
отведения, описал нормальную ЭКГ. Разработал основы векторного анализа ЭКГ,
предложил метод определения электрической оси сердца. Сформулировал правило
треугольника.
1905 — Н.
С. Коротков (Россия) предложил аускультативный способ определения артериального
давления (тоны Короткова).
1906 — Л.
Ашофф (L. Ashoff, Германия) и С. Тавара (S. Tawara, Япония)
описали предсердно—желудочковый узел (узел Ашоффа—Тавары).
1907 — А.
Ф. Самойлов (Россия) описал зависимость ЭКГ от фаз дыхания. Экспериментально обосновал
возможность кольцевого движения волны возбуждения по миокарду предсердий при
мерцательной аритмии.
1907 — А.
Кис и М. Флек (A. Keith, M. Flack, Великобритания) обнаружили синусно—предсердный узел
(узел Киса—Флека) — водитель ритма сердца.
1911 — В.
В. Воронин и А. А. Богомолец (Россия) разработали метод измерения кровяного
давления в мельчайших кровеносных сосудах.
1916—Дж.
Бахман (J. Bachman, США) открыл пучок волокон,
соединяющий миокард обоих . предсердий (пучок Бахмана).
1920 — А.
Крог (A. Krogh, Дания) — Нобелевская премия за открытие механизма
капиллярного кровообращения.
1921—1936 —
О. Леви (О. Loewi, Австрия)
установил, что при раздражении симпатического или блуждающего нервов
изолированного сердца лягушки в перфузате появляются вещества, оказывающие
соответственно симпатический или парасимпатический эффекты. В 1936 г. вместе с
Г. Дейлом (Н. Dale,
Великобритания) удостоен Нобелевской премии «за открытия, связанные с
химической передачей нервных импульсов».
1923 — Г.
Геринг (Н. Hering, Германия)
описал рефлексогенную зону в области разветвления общей сонной артерии.
1924 — В.
Эйнтховен — Нобелевская премия за создание метода электрокардиографии.
1926 — К. и
Ж. Хейманс (С. Heymans, J. Heymans, Бельгия)
открыли хеморецепторы каротидного синуса и дуги аорты.
1941 — А.
А. Кедров (СССР) разработал аппаратуру для реографии.
1950 — Н.
Н. Савицкий (СССР) создал механокардиограф.
1956 — А.
Курнан (A. Cournand, США), В. Форсман (W. Forssmann, ФРГ) и Д.
Ричарде (D. Richards, США) — Нобелевская премия за создание
методики катетеризации сердца.
1957 — Д.
Бове (D. Bovet, Италия) — Нобелевская премия за создание аналогов кураре
(нарушающих проведение возбуждения от нерва к мышце) и антигистаминовых
препаратов.
1967 — К.
Барнард (Ch. Barnard, ЮАР) впервые пересадил больному
сердце погибшего человека.
1998 — Р.
Фуршготт, Л. Игнарро и Ф. Мюрад (R. Furchgott, L. Ignarro, F. Murad, США) —
Нобелевская премия за открытие роли NO как
сигнальной молекулы в сердечнососудистой системе.
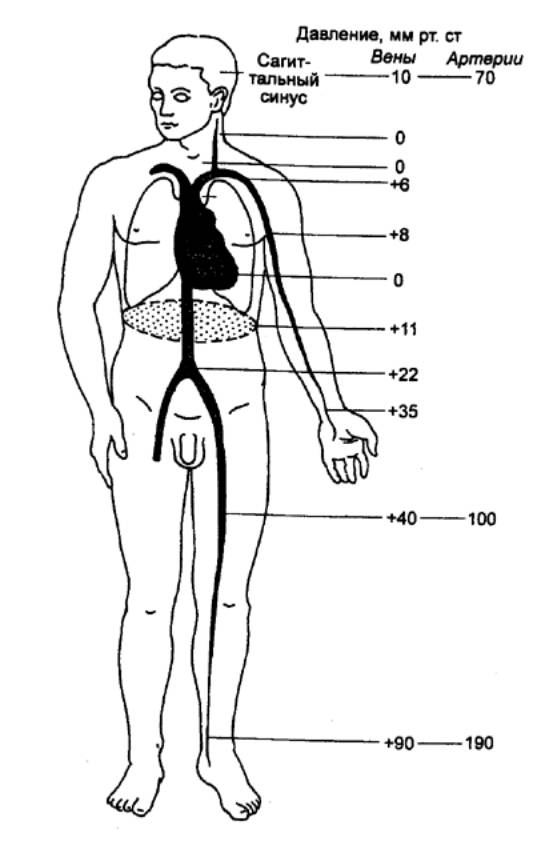
Непрерывное
движение крови в организме обеспечивается системой органов кровообращения —
сердцем и сосудами. Посредством кровообращения достигается интеграция различных
функций организма и его участие в реакциях на изменение окружающей среды.
Совершенствование
организации сердечнососудистой системы представляет собой результат длительного
филогенетического развития. Система транспорта у простейших — диффузия —
дополняется интенсивным движением протоплазмы. Это свойство сохранилось почти у
всех клеток многоклеточных. Губки и кишечнополостные используют для транспорта
веществ среду своего обитания. Жгутиками или сокращением мышц они проталкивают
воду по межклеточным каналам. У нематод, иглокожих, некоторых полихет и
голотурий движение жидкости поддерживается соматическими мышцами.
У членистоногих, низших
моллюсков и низших хордовых появляется незамкнутая циркуляторная система,
в которой сердце перекачивает гемолимфу. По системе трубок она достигает
различных частей тела, где сосуды прерываются специальными лакунами, у которых
отсутствуют собственные стенки. Гемолимфа смешивается с тканевой жидкостью,
проникает в межклеточное пространство и затем вновь возвращается в сердце.
Характерной чертой эволюции
является постепенное обособление аппарата кровообращения и превращение его в замкнутую
систему (рис. 9.1). У олигохет, многих полихет, головоногих моллюсков
появляется замкнутая система кровообращения с одним или несколькими
нагнетающими устройствами. На этом этапе эволюции кровь соприкасается с тканями
при помощи капилляров. У некоторых животных образуются специальные синусы.
Таким образом, возникает два
вида внутренней среды: кровь, циркулирующая по сосудам, и тканевая
жидкость, или лимфа, находящаяся в межклеточных пространствах.
|
|
|
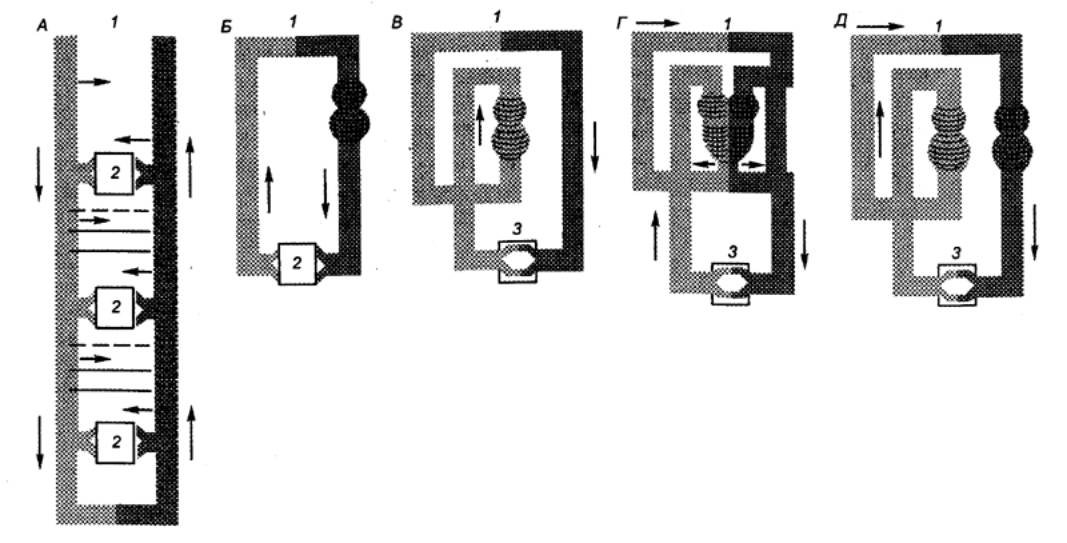
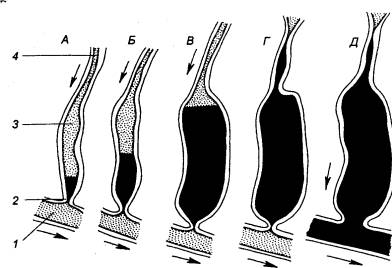
Рис.
9.1 Эволюция системы
кровообращения А — черви; Б
— низшие моллюски; В — рыбы; Г — амфибии; Д — высшие позвоночные. Сократительное образование, сообщающее
крови движение, заштриховано, артериальная система обозначена темным цветом, 1 — местоположение органа дыхания
(на рисунке не обозначен), 2 —
лакунарная часть системы, 3 — капилляры. |
|
|
|
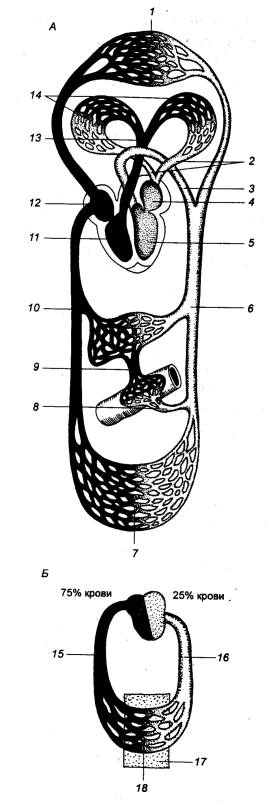
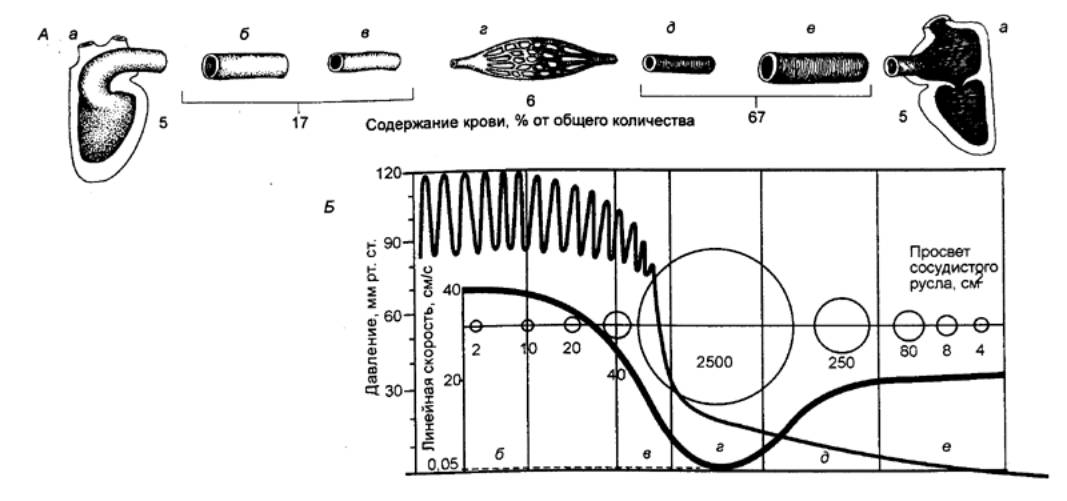
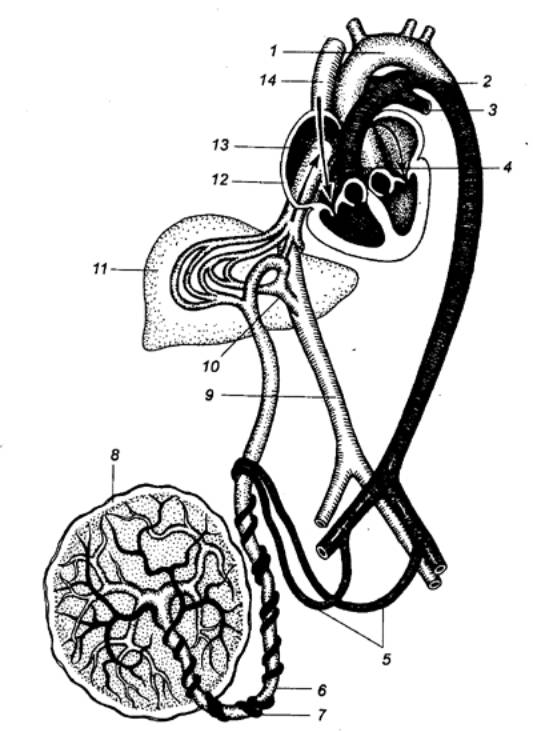
Рис.
9.2 Кровообращение млекопитающих (А)
и распределение крови в сосудах различного типа (Б) 1 — капилляры головы, 2 — легочная вена, 3 — дуга аорты, 4 — левое предсердие, 5 —левый желудочек, 6 — брюшная аорта, 7 — капилляры большого круга, 8 — кишечная артерия, 9 — воротная вена, 10 — печеночная вена, 11 — правый желудочек, 12 — правое предсердие, 13 — легочная артерия, 14 — капилляры, 15 — русло емкостных сосудов, 16 — русло резистивных сосудов, 17 — ткани, 18 — русло обменных сосудов. |
Одновременно с усложнением периферической части кровеносной
системы происходит постепенное структурное и функциональное обособление
специализированного центрального органа — сердца. У низших хордовых
животных, таких как ланцетник, роль насоса выполняет пульсирующий брюшной
сосуд, у червей— спинной. У пиявок существует два боковых пульсирующих сосуда,
сокращающихся поочередно.
У
членистоногих, моллюсков произошло обособление сердца, что значительно
увеличило эффективность системы кровообращения. Сердце большинства
членистоногих представляет собой сокращающуюся трубку, у некоторых видов оно
свободно лежит в перикардиальной полости. У многих насекомых сердце «подвешено»
при помощи мышц. Сокращаясь, мышцы растягивают сердце, создавая в нем
отрицательное давление.
Следующим
этапом эволюции явилось возникновение камерных сердец, а также выделение
большого и малого (легочного) кругов кровообращения. У рыб существует
только один круг, сердце разделено на две камеры. Из желудочков вся кровь
направляется в жабры; обогащенная кислородом, она разносится затем по всему
телу и после этого возвращается в предсердия. Сердца моллюсков уже состоят из
одного—двух предсердий и желудочка. У головоногих моллюсков вблизи основания
жабр находятся еще дополнительные, проталкивающие венозную кровь сердца. Такая
система оказывается эффективнее системы кровообращения рыб, в которой сердцу
приходится преодолевать двойное сопротивление: жаберных сосудов и сосудов
остальных частей тела. У рыб происходит выделение лимфатической системы в
самостоятельную. Она представлена у них лимфатическими мешками и
сложноразветвленными трубками. Периферические концы трубок замкнуты,
центральные — открываются в вены.
Выход из водной
среды на сушу, повышенная гравитация предъявили новые требования к системе
кровообращения: возросла масса сердца, изменились сосудистые стенки. Низкое
давление в малом (легочном) круге кровообращения и, соответственно, более
высокое давление в большом круге позволяют рептилиям и гомойотермным животным
выдерживать дополнительную нагрузку, связанную с переходом к наземному образу
жизни. У амфибий разделение двух кругов кровообращения неполное. У них нет
межжелудочковой перегородки, хотя имеются межжелудочковые складки. Венозная
кровь из органов поступает по венам в правое предсердие, а оттуда в желудочек.
Желудочек нагнетает кровь в малый круг кровообращения. Прошедшая через легкие и
обогащенная кислородом аэрированная кровь возвращается в левое предсердие и
затем поступает в тот же общий желудочек. Считают, что из—за наличия
межжелудочковых складок в сердце не происходит полного смешивания крови.
Аэрированная кровь направляется сердцем в аорту и далее в сосуды головы. В
остальные органы поступает смешанная венозная и аэрированная кровь.
Сердце рептилий характеризуется наличием двух
желудочков, разделенных перегородкой. У ящериц и змей она неполная, но потоки
аэрированной и неаэрированной крови в какой—то степени разделены. У высших
рептилий (крокодил), птиц и млекопитающих межжелудочковая перегородка
сформирована полностью. В связи с разделением кровообращения на большой и малый
круги в правой половине сердца циркулирует только венозная кровь, в левой —
артериальная (рис. 9.2). В сердце плода млекопитающих между предсердиями
имеется овальное отверстие, которое зарастает после рождения.
Совершенствование функций сердца и сосудов в процессе
филогенеза происходило одновременно с совершенствованием нервных связей
системы кровообращения. Иннервация сердца появляется только у миног,
миксин. Она осуществляется блуждающим нервом, симпатической иннервации еще нет.
Эти особенности определяют низкие адаптационные возможности системы
кровообращения животных, обитающих в относительно более постоянных условиях
среды, чем наземные.
Источником энергии, необходимой для продвижения крови
по сосудам, является работа сердца. Его строение изменялось и
совершенствовалось в процессе филогенеза. Различают следующие типы сердец:
пульсирующие
сосуды, трубкообразные сердца, камерные сердца, ампулярные добавочные сердца.
Пульсирующие сосуды наиболее распространены на низших стадиях эволюции и
особенно отчетливо выражены у кольчатых червей. Они могут сокращаться
перистальтически или локально. Жидкость циркулирует в них медленно.
Пульсирующие сосуды у насекомых трудно отличить от трубкообразных сердец.
Типичные трубкообразные
сердца имеются у большинства членистоногих. В этих сердцах для некоторых
видов характерно наличие приемной камеры, представляющей прообраз предсердия,
для других — появление клапанов. Сокращение может охватывать все трубкообразное
сердце целиком или распространяться волнообразно. Кровь в такое сердце обычно
поступает через парные отверстия, оттекает по одной или нескольким артериям.
Следующим этапом филогенеза
являются камерные сердца моллюсков и позвоночных. Это уже более
совершенный тип насоса, состоящий из предсердий, желудочков и клапанного
аппарата. У моллюсков и рыб сердце двухкамерное, состоящее из предсердия с
предшествующим ему венозным синусом и желудочка, от которого отходит
артериальный сосуд — брюшная аорта. Сердце рыб перекачивает только
венозную кровь, поступающую от органов. От сердца кровь гонится к жабрам, где
она обогащается кислородом.
Эволюция двухкамерного
сердца начинается с двоякодышащих рыб. Появление легких у земноводных
сопровождается образованием двух предсердий, и сердце становится трехкамерным.
У этих животных возникают краниальные и каудальные полые вены, отводящие кровь
от тела в правое предсердие.У высших позвоночных и человека появились
четырехкамерные сердца с полным разделением потоков артериальной и венозной
крови (см. рис. 9.2). Они будут рассмотрены ниже.
Ампулярные
сердца существуют как добавочные к
основным. Они располагаются преимущественно в местах повышенного сопротивления
сосудов, где для прокачивания крови требуется создание повышенного давления. У
моллюсков, например, они находятся в жабрах, у насекомых — в местах
прикрепления крыльев и конечностей.
9.2.1. Общие принципы строения
У высших позвоночных сердце состоит из двух половин: левой
(системной) и правой (легочной). Их функциональное разделение происходит только
после рождения. В каждой половине находятся предсердие и желудочек.
Предсердие и желудочек соответствующей половины соединены между собой предсердно—желудочковым
(атриовентрикулярным) отверстием, снабженным в левой половине
двустворчатым, в правой — трехстворчатым клапанами (рис. 9.3—9.6).
Со
стороны желудочков к клапанам прикрепляются сухожильные хорды (нити),
что позволяет клапанам открываться только в сторону желудочков. Помимо клапанов
отверстия имеют кольцевые сосочковые мышцы, участвующие в замыкании
отверстий. От левого желудочка отходит аорта, которой начинается большой круг
кровообращения, а от правого желудочка — легочная артерия, являющаяся началом
малого, или легочного, круга кровообращения. Отверстия, которыми начинаются эти
сосуды, закрыты полулунными клапанами, открывающимися только во время
сокращения желудочков.
Стенка
сердца состоит из трех слоев:
эндокарда, миокарда (рис. 9.4) и эпикарда. Основную массу составляет миокард,
имеющий наиболее сложное строение. Его образуют отдельные мышечные волокна,
каждое из которых является функциональной единицей. Миокард представляет
собой цепочку соединенных последовательно (конец в конец) клеток, имеющих общую
мембрану. Ткань миокарда, сохраняя сходство с поперечнополосатой скелетной
мышечной тканью, существенно отличается от нее рядом признаков, в том числе
особой насыщенностью кардиомиоцитов митохондриями, что отражает высокий уровень
метаболизма ткани, обладающей непрерывной активностью.
Поперечный
срез, сделанный через середину обоих желудочков, указывает на значительно
большую толщину левого. Различия касаются также и внутреннего строения. Стенки
левого желудочка представляют собой мощный цилиндр из циркулярной мускулатуры,
покрытый снаружи и изнутри спиральными волокнами. B правом желудочке циркулярный слой развит
относительно слабо, а основную массу составляют спиральные волокна. Такие
различия в строении отражают функциональные особенности, т. е. те усилия,
которые развиваются каждым из желудочков.
В
миокарде кроме сократительных, или рабочих, волокон имеется особая система
мышечных единиц, обладающих способностью к генерации спонтанной ритмической
активности, распространению возбуждения ко всем мышечным слоям и координации
последовательности сокращения камер сердца. Эти специализированные мышечные
волокна составляют проводящую систему сердца.
Волокна
рабочего миокарда соединяются друг с другом с помощью вставочных дисков — нексусов
(рис. 9.7), обладающих незначительным электрическим сопротивлением. Они служат
местом перехода возбуждения между клетками, обеспечивая функциональное единство
миокарда.
|
|
|
|
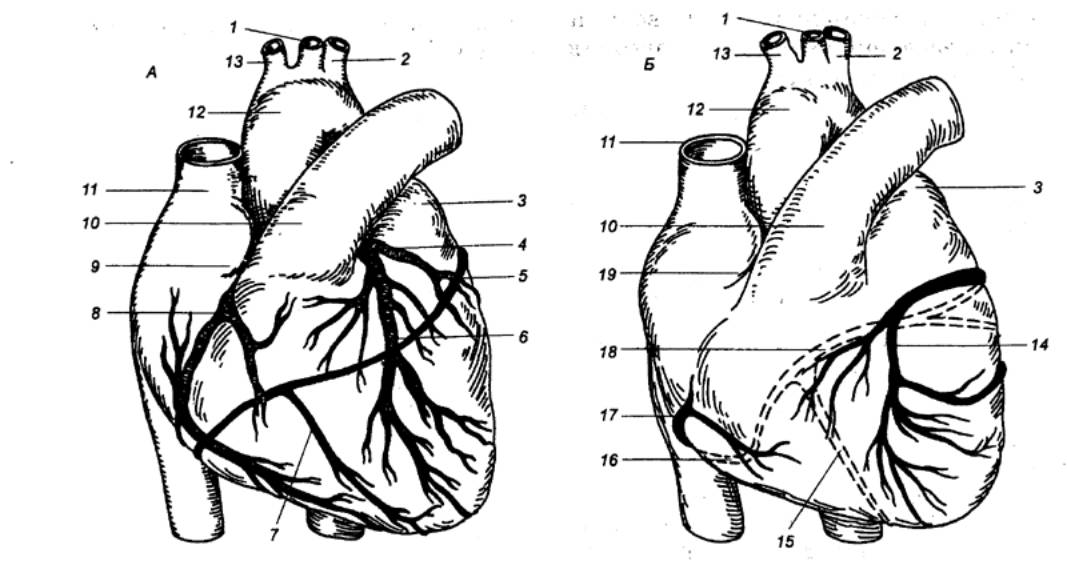
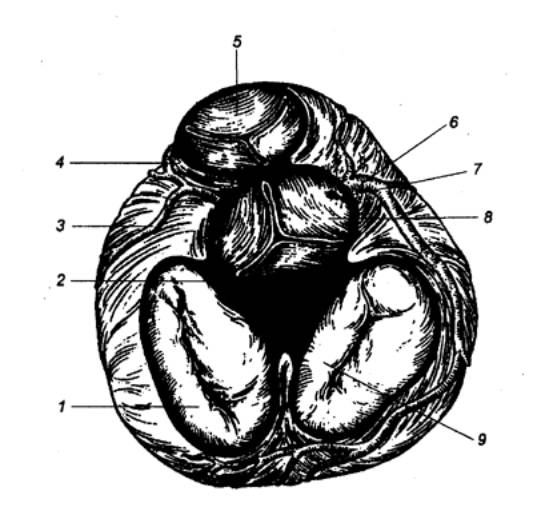
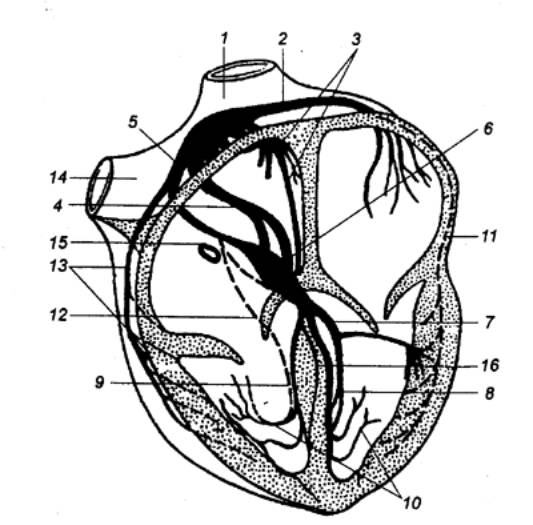
Рис. 9.3 Внешний вид
сердца, его главных артерий (А) и вен (Б) 1 —
левая общая сонная артерия, 2 — левая подключичная артерия, 3 — левое
предсердие, 4 — левая венечная артерия, 5 — огибающая ветвь левой венечной
артерии, 6 — передняя нисходящая ветвь венечной артерии, 7 — задняя
нисходящая ветвь левой венечной артерии. 8 — правая венечная артерия, 9 —
ушко правого предсердия, 10 — легочный ствол, 11 — верхняя полая вена, 12 —
аорта, 13 — плечеголовной ствол, 14 — большая вена сердца, 15 — средняя вена
сердца, 16 — малая вена сердца, 17 — передняя вена сердца, 18 — венечный
синус (впадает в правое предсердие), 19 — правое предсердие (оттянуто). |
|
|
|
|
|
Рис. 9.4 Поперечный разрез сердца 1 — правое предсердие, 2 — левое предсердие, 3 — ветви
левой легочной вены, 4 — париетальный листок перикарда, 5 — полость
перикарда, 6 — митральный клапан, 7 — висцеральный листок перикарда, 8 —
миокард, 9 — эндокард, 10 — левый желудочек, 11 — верхушка сердца, 12 —
межжелудочковая перегородка, 13— правый желудочек, 14 — трехстворчатый
клапан. |
|
|
|
|
|
Рис. 9.5 Клапанный аппарат сердца 1 — левый предсердно—желудочковый (митральный,
двухстворчатый) клапан, 2 — предсердно—желудочковая перегородка, 3 — нисходящая
ветвь левой коронарной артерии, 4 — огибающая ветвь левой венечной
(коронарной) артерии, 5 — клапан легочного ствола (артерии), в — правая
коронарная артерия, 7 — устье правой коронарной артерии, 8 — клапан аорты; 9
— правый предсердно—желудочковый (трехстворчатый) клапан. |
|
|
|
|
|
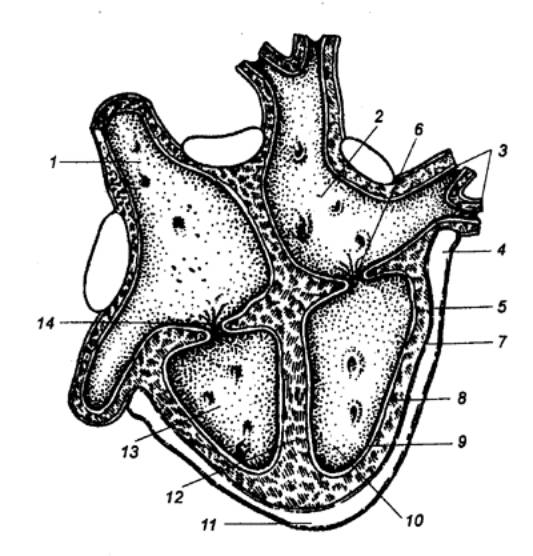
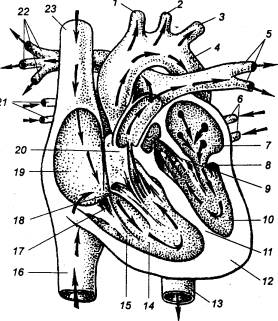
Рис. 9.6 Внутреннее строение
сердца Видны клапаны и места впадения и выхода основных
артерий и вен. 1 —
плечеголовной ствол, 2 —
левая общая сонная артерия, 3 — левая подключичная артерия, 4 — аорта, 5 — ветви
левой легочной артерии, 6 — левые
легочные вены, 7 — левое предсердие, 8
— двустворчатый (левый атриовентрикулярный) клапан, 9 — аортальный полулунный клапан, 10— левый желудочек, 11 — межжелудочковая перегородка, 12 — верхушка сердца, 13 — нисходящая аорта, 14 — правый желудочек, 15 — сосочковая мышца, 16 — нижняя полая вена, 17 — сухожильные нити, 18 — трехстворчатый (правый
атриовентрикулярный) клапан, 19—
правое предсердие, 20 —
полулунный клапан легочной артерии, 21
— правые легочные вены, 22—
ветви правой легочной артерии, 23 —
верхняя полая вена. |
|
|
|
|
|
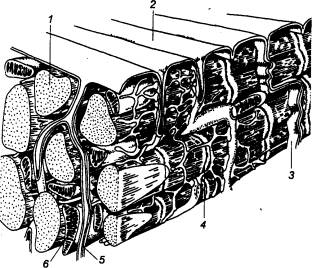
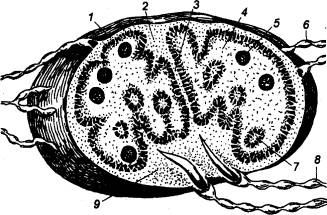
Рис.
9.7 Строение, сердечной (желудочек) мышцы.
млекопитающих Отчетливо виден вставочный диск, состоящий из двух мембран
клеток, соединенных между собой конец в конец с помощью множества щелевых
контактов и десмосом. 1 —
миофибрилла, 2 —
поверхностная мембрана, 3 — вставочный диск, 4 — саркоплазматический ретикулум,
5 — поперечная трубочка, 6 —
митохондрия. |
|
Таким образом, сердечная мышечная ткань ведет себя
как функциональный синцитий. Эта особенность организации является основой для
проявления закона «все или ничего». Суть этого закона состоит в том, что при действии
раздражителя сердце либо отвечает сокращением всех рабочих мышечных волокон,
либо (если раздражитель подпороговый) не отвечает совсем (рис. 9.8).
Этим свойством сердечная мышца отличается от.
скелетных мышц и нервов, где каждая клетка возбуждается изолированно.
9.2.2. Свойства
сердечной мышцы
К
основным свойствам сердечной мышцы относятся автоматия, возбудимость,
проводимость, сократимость.
Автоматия
сердца. Способность к ритмическому
сокращению без всяких видимых раздражении под влиянием импульсов, возникающих в
самом органе, является характерной особенностью сердца. Это свойство называется
автоматизмом. В том случае, когда импульсы появляются в мышечных
волокнах, сердечная деятельность считается миогенной, если же импульсы
возникают в клетках нервных ганглиев сердца — нейрогенной.
В
миогенном сердце перерезка всех идущих к нему внешних нервов не прекращает
автоматизма, поэтому извлеченное из тела сердце теплокровных и особенно
холоднокровных животных при создании необходимых условий способно сокращаться в
течение нескольких часов и даже суток. Ритмическое сокращение сердца
проявляется уже на ранних стадиях эмбрионального развития (у человеческого
эмбриона — на 18—20—е сут). Так же ритмически сокращаются сердечные клетки
эмбриона в культуре ткани.
Рассматривая
вопрос о координации сердечного цикла с эволюционной точки зрения, У. Гаскелл
установил, что для червей, имеющих сердце трубчатого типа, характерно
кольцеобразное расположение мышечных волокон со способностью
их к
ритмическим сокращениям. Дальнейшее филогенетическое развитие сердца шло за
счет образования мощной мышечной массы, при этом утрачивалась способность всей
массы к автоматической ритмике. И только в определенных участках сердца
оставались, еще более совершенствуясь, группы мышечных волокон, сохранившие
первичное свойство автоматизма. Они имеют особое гистологическое строение,
отличное от волокон рабочей мускулатуры. За этими волокнами установилось
название атипическая мышечная ткань.
У холоднокровных эти волокна
идут правильными рядами и кольцеобразно охватывают венозный синус. Они
сконцентрированы также в атриовентрикулярном мостике и луковице аорты. На
границе предсердий и желудочка волокна образуют спираль и далее спускаются по
желудочку к верхушке сердца. Способностью к спонтанной генерации ритма обладают
более примитивные клетки, но не высокоспециализированные рабочие кардиомиоциты.
На ранних стадиях онтогенеза ритмической активностью обладают все клетки
закладки сердца.
Природа автоматии до сих пор
до конца не выяснена. У высших позвоночных и птиц возникновение импульсов
связано с функцией атипических мышечных клеток — пейсмекеров, заложенных
в узлах сердца. Нервные структуры способны оказывать влияние на силу и частоту
их разрядов, однако сам процесс генерации импульсов является специфической
особенностью этих клеток.
Атипическая ткань в сердце
птиц и млекопитающих локализуется в областях, гомологичных венозному синусу и
атриовентрикулярной области холоднокровных. Первый узел проводящей
системы расположен в месте впадения полых вен в правое предсердие — синусно—предсердный
(синусный, синоатриальный, синусно—аурикулярный, Киса—Флека) узел (рис. 9.9).
Он является главным центром автоматии сердца — пейсмекером первого порядка.
|
|
|
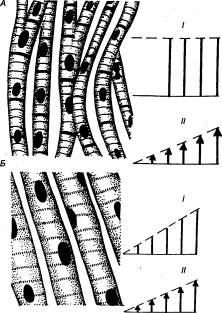
Рис. 9.8 Сократительные свойства сердечной мышцы (закон
«все или ничего» — А) и скелетной мышцы (градуальностъ —Б) I
— амплитуда
сокращений, II — сила
раздражения. |
|
|
|
Рис. 9.9 Проводящая система
сердца 1 — верхняя полая вена, 2 — синусно—предсердный узел, 3 — передний межузловой и
межпредсердный пучки Бахмана, 4 — средний межузловой пучок Венкенбаха, 5 —
задний межузловой пучок Торела, 6 —
предсердно—желудочковый узел, 7 — предсердно—желудочковый пучок (Гиса), 8, 9 — левая и правая ножки пучка
Гиса, 10 — субэндокардиальная
сеть волокон Пуркинье, 11 — пучок
Кента, 12 — пучок Махайма, 13 — пучок Паладино, 14 — нижняя полая вена, 15 — венечный синус, 16 — передняя ветвь ножки пучка
Гиса. |
От
узла возбуждение распространяется к рабочим клеткам миокарда предсердий — и
диффузно, и по специальным внутрисердечным проводящим пучкам. Оба потока
достигают второго узла — не менее важного места, обладающего
способностью генерировать импульсы, — предсердно—желудочкового (атриовентрикулярного,
Ашоффа—Тавара) узла. Он расположен в толще сердечной перегородки на границе
предсердий и желудочков. Узел состоит из трех обладающих собственной частотой
возбуждения частей: верхней предсердной, средней и нижней желудочковой. Этот
узел является пейсмекером второго порядка. Возбуждение через предсердно—желудочковый
узел в нормальных условиях может проходить только в одном направлении.
Ретроградное проведение импульсов невозможно.
Так
достигается направленность движения возбудительного процесса и, как следствие,
координированность работы предсердий и желудочков.
При
прохождении возбуждения через предсердно—желудочковый узел импульсы
задерживаются на 0,02—0,04 с. Это явление получило название атрио—вентрикулярной
задержки. Ее значение состоит в том, что за время задержки успевает
завершиться систола желудочков и их волокна будут находиться в фазе
рефрактерности.
Третий
уровень, обеспечивающий ритмическую
активность сердца, расположен в пучке Гиса и волокнах Пуркинье
(сердечных проводящих миоцитах). Пучок Гиса берет начало от предсердно—желудочкового
узла и образует две ножки, одна из которых идет к левому, другая — к правому
желудочку. Эти ножки ветвятся на более тонкие проводящие пути, заканчивающиеся
волокнами Пуркинье, которые непосредственно контактируют с рабочими клетками
миокарда.
Центры
автоматии, расположенные в проводящей системе желудочков, носят название пейсмекеров
третьего порядка. Таким образом, возбуждение по ножкам пучка Гиса
направляется к верхушке сердца и оттуда по разветвлениям ножек и волокнам
Пуркинье возвращается к основанию сердца. В результате этого сокращение сердца
в целом осуществляется в определенной последовательности: сначала сокращаются
предсердия, затем верхушки желудочков и, наконец, их основания. Пучок Гиса и
волокна Пуркинье отсутствуют у пойкилотермных животных. Возбуждение у них
распространяется по волокнам миокарда.
Перечисленные
водители ритма сердца находятся в соподчиненном положении. В сердце существует
так называемый убывающий градиент автоматии. Он выражается в убывающей
способности к автоматии различных структур проводящей системы по мере их
удаления от синусно—предсердного узла. В синусно—предсердном узле число
разрядов составляет в среднем 60—80 имп/мин, в предсердно—желудочковом — 40—50,
в клетках пучка Гиса — 30—40, в волокнах Пуркинье — около 20 имп/мин.
Таким
образом, в сердце существует определенная иерархия центров автоматии, что
позволило У. Гаскеллу сформулировать правило, согласно которому степень
автоматии отдела тем выше, чем ближе он расположен к синусно—предсердному узлу.
Это правило получило название закона градиента сердца.
В
обычных условиях частоту активности миокарда всего сердца в целом определяет синусно—предсердный
узел. Он подчиняет себе все нижележащие образования проводящей системы,
навязывая им свой ритм. Поэтому все отдельные части проводящей системы, хотя и
имеют собственный ритм, начинают работать в едином ритме. Явление, при котором
структуры с замедленным ритмом генерации потенциалов усваивают более частый
ритм других участков проводящей системы, называют усвоением ритма.
Следует заметить, что в областях узлов синусно—предсердном,
предсердно—желудочковом — находятся нервные клетки. Их скопления и
многочисленные волокна образуют густую нервную сеть, пронизывающую структуру
узла. Эти нервные клетки относятся к кардиальной части метасимпатической
нервной системы (см. разд. 5.4.3).
В мышечных волокнах предсердий и желудочков скорость
проведения возбуждения колеблется в узких пределах, составляя 0,9—1,0 м/с, в волокнах
предсердно—желудочкого узла — 0,05, в пучке Гиса — 1,0—1,5, в волокнах Пуркинье
— 3,0 мс. Быстрое проведение в волокнах Пуркинье определяет почти одновременное
возбуждение всех участков желудочков. Время полного охвата составляет около 10—15
мс. В связи с этим возрастают мощность сокращения и эффективность работы,
связанная с проталкиванием желудочком крови.
Для обеспечения работы сердца необходимым условием
является анатомическая целостность его проводящей системы. В том случае,
если в пейсмекере первого порядка в силу каких—то причин не возникает
возбуждения или блокируется его передача, роль водителя ритма берет на себя
пейсмекер второго порядка. В случае же невозможности передачи возбуждения к
желудочкам они начинают сокращаться в ритме пейсмекеров третьего порядка. При
поперечной блокаде предсердия и желудочки сокращаются каждый в своем ритме.
Повреждение водителей ритма ведет к полной остановке сердца.
На ранних стадиях эволюции встречается сугубо нейрогенный
механизм регуляции сердечного ритма, так называемое нейрогенное сердце.
Например, у большинства ракообразных на дорсальной поверхности сердца
расположено несколько ганглиозных нервных клеток. Это генераторы ритма, т. е.
пейсмекерные клетки сердца. Возникающее в них возбуждение широкой волной
разливается на мышечные клетки, вызывая их сокращение. Частота генерации
находится в прямой зависимости от наполнения сердца, т. е. состояния
растянутости его стенок. Подобные ганглионарные нервные клетки—пейсмекеры есть
и в сердце некоторых насекомых: у взрослых пчел, тараканов. Обнаружены они у
ряда кольчатых червей. Удаление ганглиев приводит к немедленной остановке
сердца. Нейрогенные сердца чрезвычайно чувствительны к эфиру. Даже малые его
концентрации вызывают остановку сокращения сердца.
Клетки атипической мышечной ткани, составляющие
проводящую систему сердца, функционально неоднородны. Из всей массы синусно—предсердного
узла только несколько клеток, называемых истинными пейсмекерами,
обладают способностью к спонтанной генерации потенциала действия. Остальные
клетки относятся к потенциальным (латентным) водителям ритма. Они, как и
рабочие кардиомиоциты, разряжаются в результате пришедшего к ним возбуждения. Потенциальные
пейсмекеры отличаются от истинных особенностями медленной диастолической
деполяризации и более низкой частотой разрядов. В свою очередь, от рабочих
миокардиоцитов они отличаются тем, что последние вообще не способны к
спонтанной деполяризации. В случае прекращения функции истинного пейсмекера
потенциальный пейсмекер может взять на себя его ведущую роль, в то время как
рабочие кардиомиоциты такой
способностью не обладают.
Особенностью механизма возникновения ритмов истинных
и потенциальных пейсмекеров является то, что в отличие от волокон
сократительного миокарда мембрана этих клеток во время диастолы приобретает
большую ионную проницаемость что ведет к развитию медленной диастолической
деполяризации — пейсмекерного потенциала. В этот момент возникает местное
нераспространяющееся возбуждение. У потенциальных пейсмекеров эта фаза достигает
порогового уровня позже, чем у истинных. С достижением диастолического
порогового уровня происходит возникновение, распространяющегося ПД.
Ионный механизм
пейсмекерного потенциала состоит в
том, что во время фазы реполяризации клеточная мембрана становится более
проницаемой для внутриклеточного К+ и мембранный потенциал
приближается к равновесному калиевому потенциалу Еk. В
результате проникновения внутрь клетки Na+ и Са2+ и
уменьшения скорости выхода из клетки К+ возникает медленная диастолическая
деполяризация. Когда уровень потенциала уменьшится по сравнению с исходным
приблизительно на 2 мВ, наступает резкое увеличение проницаемости мембраны
вначале для Na+, а позже для Са2+. Этот ионный ток
приводит к возникновению пика ПД. Общая амплитуда ПД составляет около 100 мВ. С
закрытием ионных каналов положительный заряд наружной поверхности мембраны
восстанавливается. Появление ПД в пейсмекерной клетке сопровождается
возникновением деполяризации в прилежащих к ней ведомых рабочих кардиомиоцитах,
не обладающих автоматизмом, и распространением возбуждения. Рабочие клетки
миокарда в отличие от водителей ритма в состоянии покоя характеризуются
чрезвычайно низкой ионной проницаемостью для Na+ и Са2+,
так что движение через их каналы К+ не вызывает сдвигов мембранного
потенциала.
Ритм работы сердца зависит
от массы животного и уровня метаболизма. Как правило, частота сердечных
сокращений у животных с низкой общей подвижностью меньше, чем у подвижных. У
улиток она колеблется от 0,2 до 20 в 1 мин, у кальмара и осьминога — от 40 до
80. У мелких животных частота сердечных сокращений, как правило, выше, чем у
крупных. Например, частота сокращений у мелких птиц достигает несколько сотен в
1 мин, у домашних — 150—300, у мыши — 600—700, кролика — 120—140, кошки — 100—120,
собаки — 60—120, лошади, слона — 25—60.
Зависимость между величиной
животного и частотой сердечных сокращений объясняется более высоким уровнем
метаболизма мелких животных. Высокий уровень может обеспечиваться только
интенсивным кровоснабжением органов и тканей, а следовательно, более быстрым
режимом работы сердца. Частота сердечных сокращений резко усиливается при
мышечной работе. У ныряющих млекопитающих, птиц и черепах во время ныряния
наблюдается урежение сердечной деятельности.
Возбудимость сердечной
мышцы. Под действием электрических,
химических, термических и других раздражителей сердце способно приходить в состояние
возбуждения. В основе процесса возбуждения лежит появление отрицательного
электрического потенциала в первоначально возбужденном участке.
Как и у любой возбудимой
ткани, мембрана рабочих клеток сердца поляризована. Снаружи она заряжена
положительно, изнутри — отрицательно. Это состояние возникает в результате
разной концентрации Na+ и К+ по обе стороны мембраны, а
также разной проницаемости мембраны для этих ионов. В покое мембрана
кардиомиоцитов почти непроницаема для Na+ и частично для К+.
В результате процесса диффузии ионы К+, выходя из клетки,
увеличивают положительный заряд на ее поверхности. Внутренняя сторона мембраны
при этом становится отрицательной. В миокарде теплокровных животных разность
потенциалов в покое (потенциал покоя) составляет 60—80 мВ. При действии
раздражителя любой природы, прихода возбуждения от соседней клетки или
пейсмекера происходит поступление Na+ в клетку. В этот момент на
поверхности мембраны возникает отрицательный электрический заряд и развивается
реверсия потенциала. Амплитуда ПД составляет 100 мВ и более. Возникший
потенциал деполяризует мембраны соседних клеток, у них возникают собственные
ПД.
|
|
|
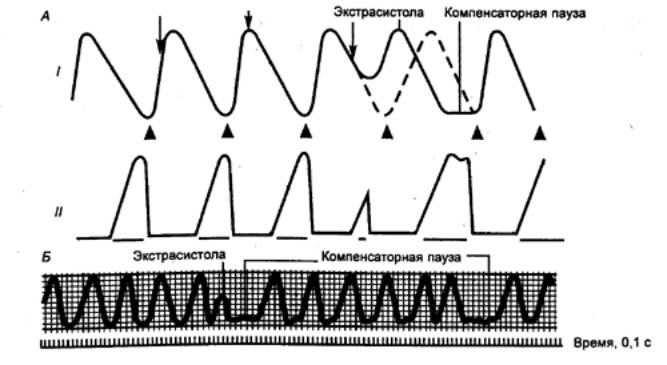
Рис. 9.10
Экстрасистола А —
схематическое изображение; Б —
кривая сокращения. I —
сокращение, II —
возбудимость; стрелками показаны раздражения, наносимые в разные фазы
сердечного цикла, треугольниками — импульсы, исходящие из синусного узла. |
Таким образом происходит
распространение возбуждения в целом органе. Этот процесс одинаков в рабочем
миокарде и в водителях ритма.
Возможность вызвать
возбуждение сердца электрическим током нашла практическое применение в
медицине. Под действием электрических импульсов, источником которых являются
электронные стимуляторы, сердце начинает возбуждаться и работать в заданном
ритме.
При нанесении электрических
раздражении на работающее сердце в разные фазы его цикла оказывается, что
независимо от величины и силы раздражения сердце не ответит, если это
раздражение будет нанесено в период систолы, т. е. во время периода
абсолютной рефрактерности (от фр. refractaire — невосприимчивый). Период
рефрактерности длится столько же времени, сколько продолжается систола.
С началом расслабления
возбудимости сердца начинает восстанавливаться и наступает период относительной
рефрактерности. Нанесение в этот момент интенсивного стимула способно
вызвать внеочередное сокращение — экстрасистолу. При этом пауза,
следующая за экстрасистолой, длится больше времени, чем обычно, это так
называемая компенсаторная пауза (рис. 9.10). После фазы относительной
рефрактерности наступает период повышенной возбудимости. По времени он
совпадает с диастолическим расслаблением и характеризуется тем, что импульсы
небольшой силы могут вызвать сокращение сердца. Период этот непродолжителен, и
вскоре наступает восстановление уровня возбудимости.
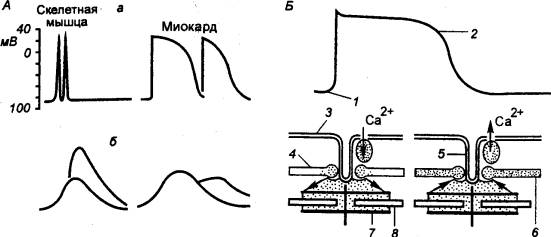
Потенциал действия клетки
рабочего миокарда длится 0,3 с, что примерно в 150 раз продолжительнее, чем в
клетке скелетной мышцы. Во время развития ПД клетка невозбудима к последующим
стимулам. Ее рефракторный период почти в 100 раз больше такого же периода
скелетной мышцы. Эта особенность исключительно важна для функции сердца как
органа, так как в ответ на частые повторные раздражения миокард может отвечать
только одним потенциалом действия и одним сокращением. Все это создает условия
к ритмическому сокращению органа.
Длительный абсолютный
рефракторный период, т. е. полная невозбудимость сердечной мышцы, предохраняет
ее от быстрого повторного возбуждения до тех пор, пока не закончилась
предыдущая волна деполяризации. Тем самым предотвращается нарушение
нагнетательной функции сердца. Наличие фазы рефрактерности также препятствует
возникновению кругового движения возбуждения по миокарду. В противном случае
нарушилось бы ритмическое чередование систолы и диастолы. Абсолютная
рефрактерность исключает и возможность тетанического сокращения сердца,
заставляя его работать в ритме одиночного сокращения.
Сократимость сердечной
мышцы. Несмотря на то что миокард
состоит из большого числа мышечных элементов, он всегда функционально реагирует
как единое целое. В отличие от скелетной мышцы миокард не обнаруживает
зависимости между силой раздражения и величиной реакции. На подпороговые
раздражения сердце вообще не отвечает, но как только сила раздражения достигает
порогового уровня, возникает полное сокращение миокарда. Дальнейшее нарастание
силы раздражающего тока не изменяет величины сокращения. Таким образом,
пороговое раздражение является одновременно и максимальным. Эта особенность
сокращения сердечной мышцы получила название закона «все или ничего».
Подчинение сердечной мышцы
закону «все или ничего» объясняется ее структурной организацией. В сердечной
мышце отдельные мышечные волокна соединены друг с другом вставочными дисками —
протоплазматическими мостиками с очень малым электрическим сопротивлением.
Поэтому при достижении раздражающим импульсом пороговой величины возбуждение
распространяется, как по синцитию, и обязательно синхронно охватывает всю мышцу
в целом.
Вместе с тем закон «все или
ничего» не абсолютен. Если раздражать мышцу импульсами возрастающей частоты, не
меняя их силы, .то величина сократительного ответа миокарда будет возрастать на
каждый последующий стимул. Это явление получило название лестницы Боудича.
Считают, что механизм возникновения явления лестницы состоит в том, что каждый
последующий стимул попадает в фазу повышенной возбудимости мышцы, вызывая тем
самым повышенную ответную сократительную реакцию.
Сократимость сердечной мышцы
определяется особенностями строения ее волокон и соотношением между длиной и
напряжением саркомера. Изменения сократительной силы миокарда, возникающие
периодически, осуществляются посредством двух механизмов саморегуляции:
гетерометрического и гомеометрического.
В основе гетерометрического
механизма лежит изменение исходных размеров длины волокон миокарда, которое
возникает при изменении величины притока венозной крови. Иными словами, чем
сильнее сердце растянуто во время диастолы, тем оно сильнее сокращается во
время систолы. Эта особенность сердечной мышцы установлена О. Франком и Э.
Старлингом на сердечно—легочном препарате и получила название закона сердца
(Франка—Старлинга). Объяснить его можно следующим образом. Сердечное
волокно состоит из двух частей: сократительной и последовательно с ней
соединенной эластичной. Во время возбуждения первая часть сокращается, вторая —
растягивается, как пассивная пружина, в зависимости от нагрузки. В целостном
организме действие закона сердца ограничено рядом других условий.
Гомеометрический механизм не связан с изменением длины саркомера и основан на
непосредственном действии биологически активных веществ (таких как
катехоламины) на метаболизм мышечных волокон, выработку в них энергии.
Адреналин и норадреналин увеличивают вход Са2+ в клетку в момент
развития потенциала действия, вызывая тем самым усиление сердечных сокращений.
Серию последовательных
явлений в клетке миокарда, начинающуюся с пускового механизма сокращения —
потенциала действия мембраны, включающую далее последовательность
внутриклеточных процессов и
|
|
|
Рис. 9.11 Потенциалы, действия и сокращение
скелетной и сердечной мыщц (А) и соответствующие им. изменения
сократительного аппарата (Б) а — потенциалы действия, б — изометрическое сокращение, 1 — начало сокращения, 2
— расслабление, 3 — сарколемма, 4
— миоплазма, 5 — поперечная трубочка, 6 — продольная трубочка, 7 —
актив, 8 — миозин, стрелками
обозначено движение ионов Са2+. |
завершающуюся
укорочением миофибрилл, называют сопряжением возбуждения и сокращения
(электромеханическое сопряжение).
Укорочение мышечного волокна
при сокращении мышцы происходит за счет вдвигания активных нитей между миозиновыми
(рис. 9.11). Этот процесс осуществляется посредством веслообразных движений
выступающих участков миозиновой нити — поперечных мостиков. Во время расслабления
волокна актиновые нити отодвигаются назад, занимая прежнее положение. На их
поверхности располагаются тонкие нити из белка тропомиозина. Они
блокируют взаимодействие актина с миозином. Тропомиозин, в свою очередь,
образует комплекс с белком тропонином. Тропонин обладает высоким
сродством к Са2+ Миозиновые нити состоят из двух белков: легкого и
тяжелого меромиозина. Тяжелый меромиозин образует поперечные мостики. Он
обладает АТФазной активностью.
Сокращение кардиомиоцита запускается ионами Са2+. В результате
потенциала действия Са2+ выходит из цистерн саркоплазматического
ретикулума и поступает к сократительным белкам, где связывается тропонином.
Возникновение связи сопровождается изменением пространственного расположения на
актиновой нити тропонин—тропомиозинового комплекса. Этим снимается тормозное
действие актина на активные центры. В результате образуется сокращающийся актомиозин,
а также происходит расщепление АТФ, энергия которого идет на скольжение
актиновых нитей.
В результате реполяризации
мембраны наступает расслабление кардиомиоцита. Оно основано на том, что под
действием реполяризации происходит удаление Са2+ от тропонина и
последующее его связывание саркоплазматическим ретикулумом. В этот момент
включаются насосы клеточных мембран, которые перекачивают Са2+ в
межклеточную жидкость (рис. 9.11).
К структурам, отвечающим за
сопряжение возбуждения и сокращения миокарда, относятся система поперечных
трубочек, особенно сильно развитая в желудочках, а также система
продольных трубочек, являющаяся внутриклеточным резервуаром Са2+
Ключевым событием в
сокращении служит вход в клетку ионов Са2+ во время потенциала
действия. Кальций увеличивает длительность потенциала действия и, как
следствие, продолжительность рефракторного периода. Перемещение Са2+
из тканей жидкости является основой для регуляции «силы сокращения».
Следовательно, ПД играет
роль не только пускового механизма сокращения, оказывая триггерное воздействие
путем высвобождения внутриклеточного Са2+, он также пополняет запасы
иона для последующих сокращений. Удаление Са2+ из межклеточных
пространств приводит к полному разобщению возбуждения и сокращения миокарда.
При этом ПД остается в неизменном виде, сокращения же кардиомиоцитов не
происходит.
9.2.3. Механическая работа сердца
Сердце
нагнетает кровь благодаря ритмическому последовательному сокращению мышечных
волокон предсердий и желудочков. Его механической деятельностью управляют
процессы возбуждения. Наличие проводящей системы сердца, общих слоев миокарда у
обоих предсердий, одновременного прихода возбуждения по ножкам пучка Гиса и
волокнам Пуркинье к клеткам миокарда желудочков делают сокращение предсердий и
позже сокращение желудочков практически одновременным.
Несмотря
на большую сложность процессов, лежащих в основе сердечной деятельности, сердце
построено по принципу насоса ритмического действия. Как и всякий насос
для перекачивания жидкости, оно снабжено двумя видами клапанов, расположенных
на входе и выходе желудочков.
На
эволюционном пути сформированный клапанный аппарат появился у низших
позвоночных. В области внутренней поверхности артериального конуса сердца
ганоидных рыб вдается три призматических соединительнотканных выроста. При
расслабленном состоянии конуса во время диастолы кровь
|
|
|
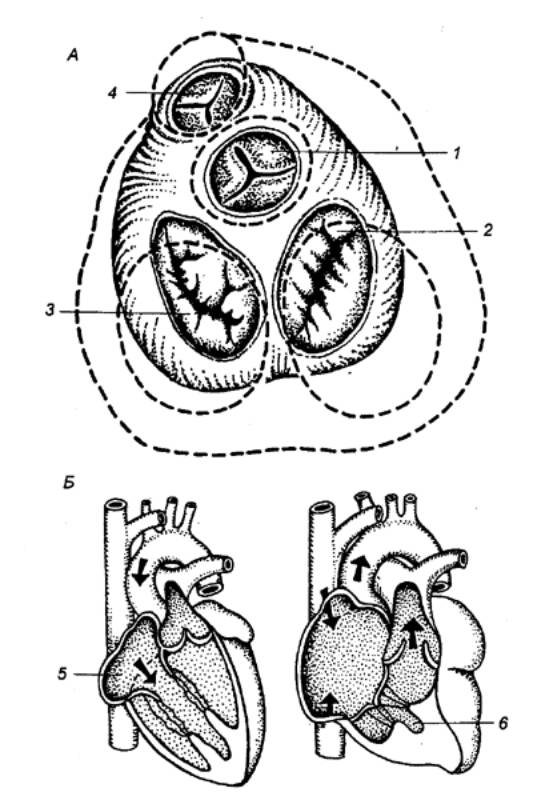
Рис. 9.12 Изменение формы,
сердца при сокращении его отделов А — вид сверху, Б
— изменение объема сердца в разные фазы его деятельности; пунктиром
показаны контуры желудочков и отдельных отверстий при диастоле, предсердия
удалены; 1 — полулунные
клапаны аорты, 2 — трехстворчатый
клапан, 3 — двустворчатый клапан, 4
— полулунные клапаны легочной артерии, 5 — систола предсердия, 6 — систола желудочков. |
|
|
|
Рис. 9.13 Давление в полостях сердца в разные фазы
сердечного цикла А — правая половина сердца, Б — левая половина: верхние цифры означают давление в
предсердиях, нижние — в желудочках (мм рт. ст.). |
|
|
|
Рис. 9.14 Фазы
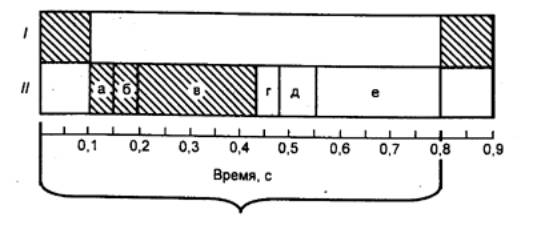
сердечного цикла I — предсердия; // —
желудочки; фаза систолы заштрихована, фаза диастолы — светлая; а — асинхронное сокращение; б — изометрическое сокращение (а +
б — фаза напряжения); в — фаза изгнания; г — протодиастолический период; д — изометрическое расслабление; е
— фаза
наполнения желудочков. |
свободно
протекает через щель, образованную выростами. В момент систолы конуса и
уменьшения диаметра трубки выросты плотно смыкаются и отделяют полость
желудочка от аорты.
У костистых рыб клапанный механизм
напоминает уже механизм высших позвоночных. В процессе эволюции масса клапанов
уменьшается и заменяется легкой соединительнотканной мембраной. Мембрана одним
своим краем закреплена неподвижно на сердечной стенке.
Предсердия и желудочки (рис.
9.12, см. рис. 9.5) разделяют левый и правый предсердно—желудочковые створчатые
клапаны (в левой половине — двустворчатый, или митральный, в правой —
трехстворчатый). Во время систолы желудочков эти клапаны препятствуют обратному
забросу крови в предсердия.
По иному типу построены
клапаны аорты и легочного ствола. Они образуют обращенные в полость сосуда
карманоподобные углубления, полулунные заслонки, окружающие в виде полумесяцев
устье сосудов, из—за чего получили название полулунных клапанов. Во
время систолы желудочков клапаны открыты и прижаты к внутренним стенкам
сосудов. В момент наступления диастолы устремляющаяся обратно из аорты и
легочной артерии кровь захлопывает клапаны. Закрытие клапанов не требует
специальной энергии сокращения, этот акт возникает в результате изменения
давления в полостях сердца.
Безостановочное движение
крови по сосудам обусловливается ритмическими сокращениями сердца, которые
чередуются с его расслаблениями. Сокращение сердечной мышцы называется систолой,
ее расслабление — диастолой. При каждой систоле желудочков происходит
выталкивание крови из левого желудочка в аорту, из правого желудочка — в
легочную артерию, во время диастолы они заполняются кровью, поступающей из
предсердий (рис. 9.13). В предсердия кровь попадает из вен. В обычных условиях
систола и диастола четко согласованы во времени. Период, включающий одно
сокращение и последующее расслабление сердца, составляет сердечный цикл.
Его общая продолжительность у человека и млекопитающих равна примерно 0,8 с.
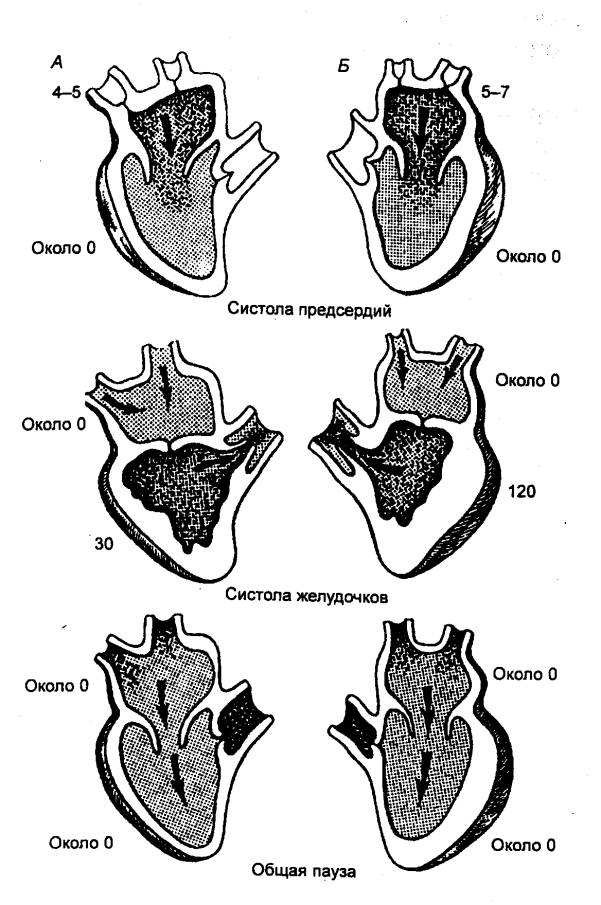
Сердечный цикл имеет три фазы: систолы предсердий, систолы желудочков, общая
пауза.
Началом каждого цикла
считается систола предсердий, длящаяся 0,1 с (рис. 9.14). Во время
систолы повышается давление в полостях предсердий, что ведет к выталкиванию
крови в желудочки. Желудочки в этот момент расслаблены, створки предсердно—желудочковых
клапанов свисают и кровь свободно поступает из предсердий в желудочки. При
сокращении предсердий кровь не может поступать в вены. В самом начале систолы
их отверстия суживаются. Невозможно также затекание крови из аорты и легочной
артерии в желудочки. Полулунные клапаны этих сосудов вследствие заполнения их
кармашков кровью закрыты.
По окончании систолы
предсердий начинается систола желудочков, длительность которой 0,3 с. В
момент систолы желудочков предсердия оказываются уже расслабленными. Как и
предсердия, оба желудочка — левый и правый —
сокращаются
одновременно. Систола желудочков начинается с асинхронного сокращения их
волокон, возникающего в результате распространения возбуждения по миокарду.
Этот период непродолжителен (0,047—0,075 с). В этот момент еще не происходит
повышения давления в полостях желудочков. Оно начинает резко расти, когда
возбуждение охватывает все волокна, достигая 70—88 мм рт. ст. в левом и 15—20
мм рт. ст. в правом предсердиях.
Вследствие повышения
внутрижелудочкового давления предсердно—желудочковые клапаны быстро
захлопываются. В этот момент полулунные клапаны еще тоже закрыты, поэтому
полость желудочка оказывается замкнутой и объем крови в полости остается постоянным.
В результате возбуждения увеличивается напряжение мышечных волокон без
изменения их длины (изометрическое напряжение), что ведет к еще большему
возрастанию давления крови. Стенка левого желудочка растягивается и ударяет о
внутреннюю поверхность грудной клетки. Таким образом возникает сердечный
толчок.
Когда
давление крови в желудочках превзойдет давление в аорте и легочной артерии,
полулунные клапаны откроются, их лепестки прижмутся к внутренним стенкам и
наступит период изгнания, длящийся примерно 0,25 с.
В
начале периода изгнания давление крови в полости желудочков продолжает
нарастать, достигая примерно 130 мм рт. ст. в левом и 25 мм рт. ст. в правом. В
результате кровь быстро изливается в аорту и легочную артерию объем желудочков
резко уменьшается. Это фаза быстрого изгнания.
После
открытия полулунных клапанов выброс крови из сердца начинает замедляться,
сокращение миокарда желудочков слабеет, наступает фаза медленного изгнания.
С падением давления полулунные клапаны захлопываются препятствуя тем самым
обратному току крови из аорты и легочной артерии, миокард желудочков начинает
расслабляться. Теперь снова наступает короткий период, во время которого
закрыты клапаны аорты и еще не открылись предсердно—желудочковые. Когда же
давление в желудочках окажется чуть меньше, чем в предсердиях, раскрываются
предсердно—желудочковые клапаны происходит наполнение желудочков кровью,
которая будет выброшена в следующем цикле, и наступает диастола всего
сердца. Она продолжается до следующей систолы предсердий. Эта фаза, или общая
пауза, имеет большое значение так как в этот период происходит изъятие Са2+
из миофибрилл канальцами саркоплазматического ретикулума.
Изменение давления в камерах
сердца и отходящих сосудах вызывает движение клапанов сердца и перемещение
крови. Вместе с сокращением сердечной мышцы эти действия сопровождаются
звуковыми явлениями, называемыми тонами сердца (рис. 9.15.). При
сокращении сердца сначала слышен более протяженный звук низкого тона — первый
тон (тон I) сердца. После короткой паузы за ним более высокий, но короткий
звук — второй тон (тон II) После этого наступает пауза. Она более
длительна, чем пауза между тонами. Такая последовательность повторяется в
каждом сердечном цикле.
Первый тон появляется в момент начала систолы
желудочка (систолический тон). В основе его лежат колебания створок
предсердно—желудочковых клапанов, прикрепленных к ним сухожильных хорд, а также
колебания производимые массой мышечных волокон при их сокращении. Эти колебания
желудочков и клапанов передаются на грудную клетку. Второй тон возникает в
результате захлопывания полулунных клапанов и ударов друг о друга их створок в
момент начинающейся диастолы желудочков (диастолический тон). Колебания
передаются на столбы крови крупных сосудов. Этот тон тем выше, чем выше
давление в аорте и, соответственно, в легочной артерии.
Использование
метода фонокардиографии позволяет выделить обычно не слышные ухом третий
и четвертый тоны. Третий тон (желудочковый) возникает в начале
наполнения желудочков при быстром притоке крови. Он отражает вибрацию стенки
желудочков. Происхождение четвертого тона (предсердного) связывают с
сокращением миокарда предсердий и началом расслабления.
9.2.5. Основные показатели деятельности сердца
Левый и правый желудочки при каждом сокращении сердца
человека изгоняют соответственно в аорту и легочный ствол примерно по 65—70 мл
крови. Объем одинаков для левого и правого желудочков, если организм находится
в состоянии покоя. Этот объем называется систолическим, или ударным.
Умножив систолический объем на число сокращений в 1 мин, можно вычислить минутный
объем. Он составляет в среднем 4,5—5,0 л.
Систолический
и минутный объем сердца не постоянны. Они резко меняются при напряженной
физической работе. Минутный объем может достигать у человека 20—30 л. У
нетренированных это увеличение объема происходит в основном за счет частоты
сердечных сокращений, у тренированных — главным образом в результате увеличения
систолического объема сердца.
Еще
одним показателем является сердечный индекс — отношение минутного объема
к площади поверхности тела. Из данных минутного объема крови и среднего
давления крови в аорте определяют внешнюю работу сердца. В условиях физического
покоя она составляет у человека примерно 70—110 Дж, при физической работе
возрастает до 800 Дж.
Наиболее
удобным объектом для исследования систолического объема сердца и влияния на
него различных условий является сердечно—легочный препарат
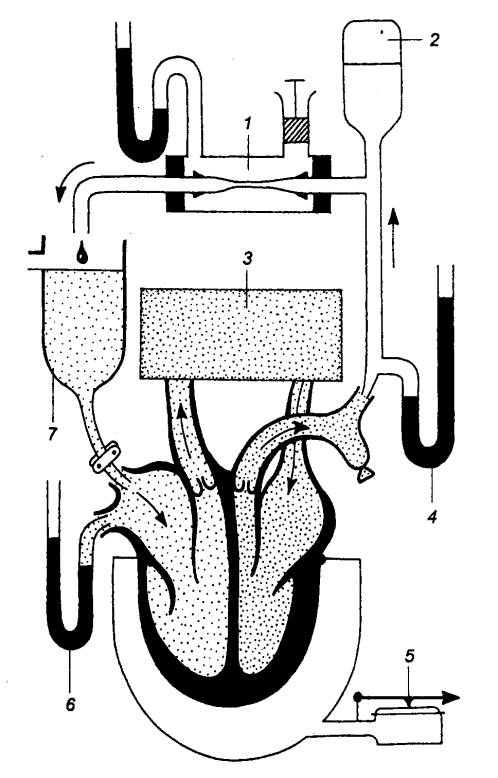
млекопитающих, предложенный Э. Старлингом (рис. 9.16).
|
|
|
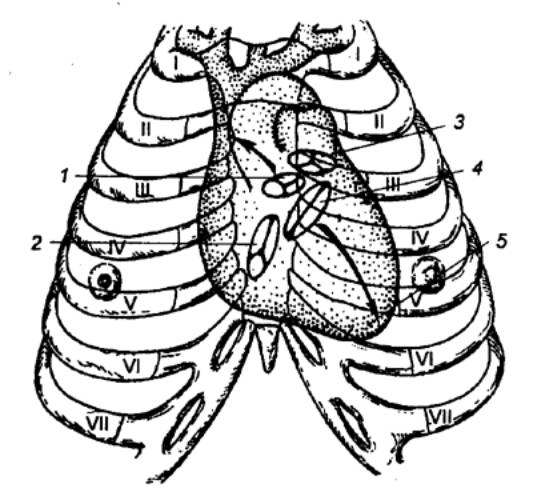
Рис. 9.15 Положение сердца в грудной полости и места
выслушивания тонов сердца 1 — место проекции клапана аорты; 2 —место проекции и выслушивания
трехстворчатого клапана; 3 — место проекции и выслушивания клапанов легочной
артерии; 4 — место проекции
митрального клапана; 5 — верхушка сердца. Верхняя стрелка — место
выслушивания клапана аорты, нижняя — двухстворчатого (митрального) клапана. |
|
|
|
Рис.
9.16 Сердечно—легочный препарат (по Старлингу) 1 — регулируемое сопротивление, 2 — компрессионная камера, 3 —
легкое (вентилируемое), 4 —
давление в аорте, 5 — объем желудочка, 6
— давление наполнения, 7 — венозный резервуар. |
В
этом препарате сердце сохраняет естественные связи с вентилируемым искусственно
легким и с венечным кровотоком, т. е. малым кругом кровообращения. Вместо
большого круга кровообращения подключают заполненную кровью систему трубок.
Благодаря устройству для изменения гидродинамического сопротивления в этом
препарате существует возможность регулировать приток крови к правому
предсердию, менять сопротивление в искусственном большом круге, изменяя таким
образом нагрузку на сердце.
Распространение возбуждения от водителя ритма по
проводящей системе сердца и самой сердечной мышце сопровождается возникновением
на поверхности клеток отрицательного потенциала. В связи с этим происходит
синхронный разряд огромного числа возбужденных единиц, их суммарный потенциал
оказывается настолько велик, что может регистрироваться далеко за пределами
сердца на поверхности тела. В силу высокой проводимости прилежащие к сердцу
ткани становятся электроотрицательными.
В
связи с многокамерной геометрией миогенного сердца позвоночных регистрируемая
электрическая волна имеет сложный характер и отражает возникновение в миокарде
деполяризации и реполяризации, а не его сокращение. Кривую, отражающую динамику
разности потенциалов в двух точках электрического поля сердца в течение
сердечного цикла, называют электрокардиограммой (ЭКГ), а метод исследования
— электрокардиографией (рис. 9.17).
Электрокардиограмма
была впервые зарегистрирована в 1887 г. А. Уоллером, но широкое распространение
получила после использования В. Эйнтховеном (1903) струнного гальванометра для исследования
электрических потенциалов сердца.
|
|
|
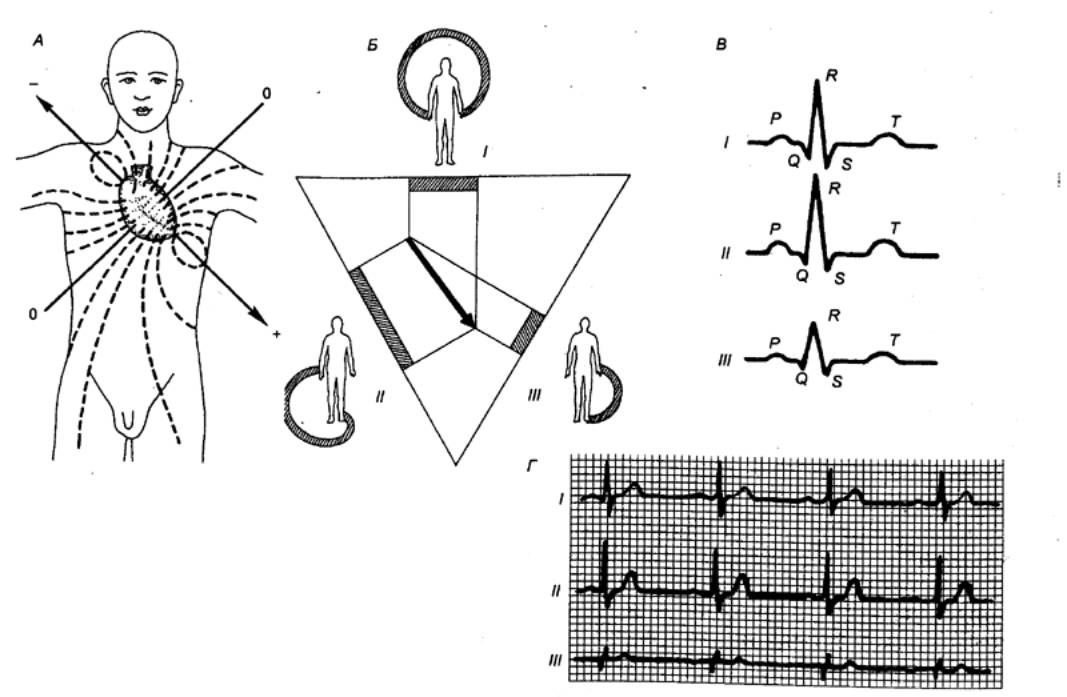
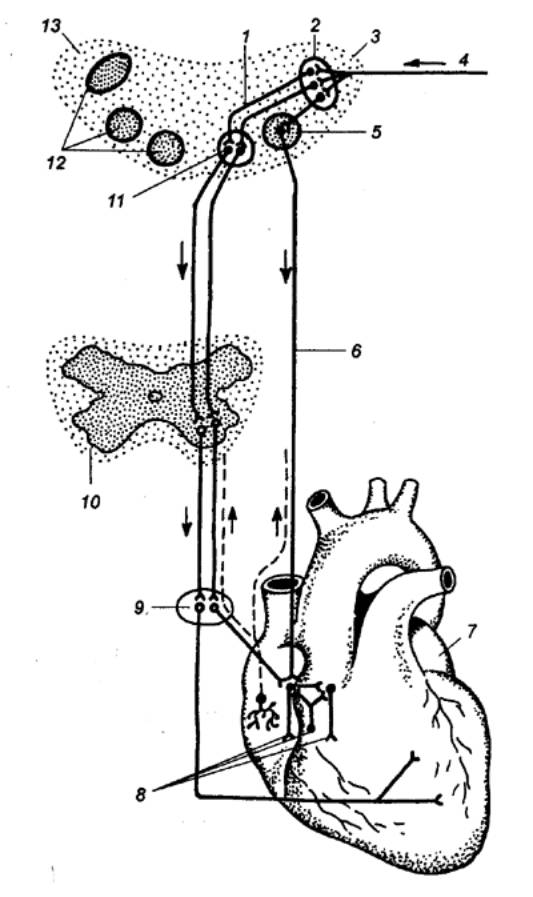
Рис. 9.17 Электрокардиография
(классические биполярные отведения) А
— распространение по телу силовых
линий биотоков сердца; Б —
схема, поясняющая различную амплитуду зубца Д в ЭКГ (треугольник Эйнтховена)
в трех стандартных отведениях (J, //, III), В — изменение ЭКГ в
зависимости от расположения оси сердца; Г — ЭКГ. |
Для регистрации ЭКГ у
человека применяют три стандартных отведения — расположение электродов на
поверхности тела. Первое отведение — на правой и левой руках, второе — на
правой руке и левой ноге, третье — на левой руке и левой ноге. Помимо
стандартных отведении применяют отведения от разных точек грудной клетки в
области расположения сердца, а также однополюсные, или униполярные, отведения.
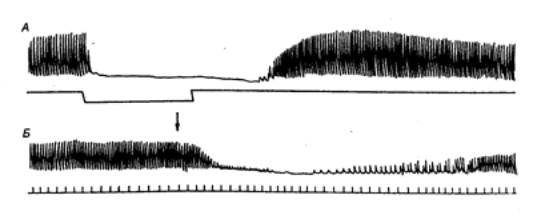
Типичная ЭКГ позвоночных животных и человека состоит из пяти
положительных и отрицательных колебаний — зубцов, соответствующих циклу
сердечной деятельности (рис. 9.18). Их обозначают латинскими буквами от Р до
Г. Промежутки между зубцами называют сегментами, совокупность зубца и
сегмента — интервалом. Три крупных зубца вершиной вверх, два мелких Р,
R, Т — обращены Q, S — направлены вниз.
|
|
|
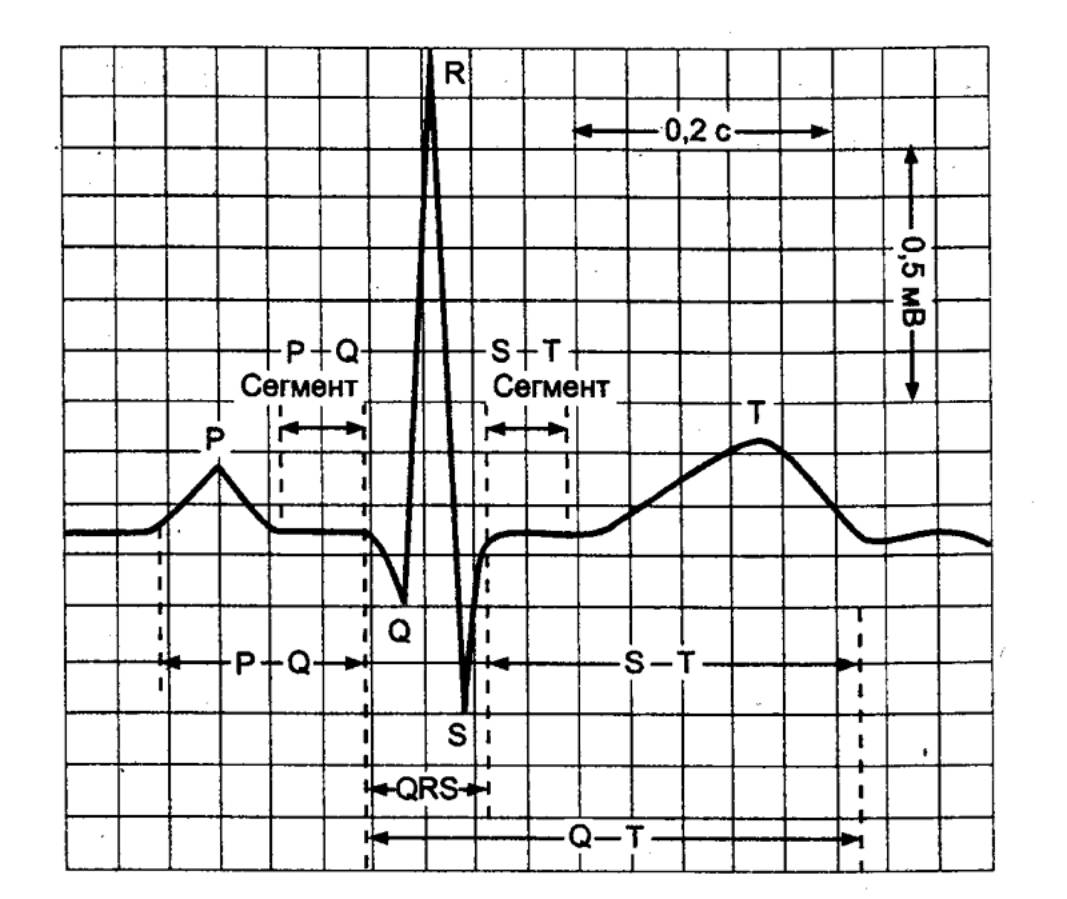
Рис. 9.18 Типичная
ЭКГ человека во втором отведении (фронтальная плоскость) Обозначены зубцы Р, Q, R, S, Т; промежутки между линиями
на бумаге составляют 1 мм (здесь увеличено). |
Зубец
Р отражает период возбуждения предсердий,
являясь алгебраической суммой потенциалов, возникающих в правом и левом
предсердии. Его длительность равна в среднем 0,1 с. Интервал PQ соответствует проведению возбуждения через предсердно—желудочковый
узел. Он продолжается от 0,12 до 0,18 с.
Комплекс
QRST обусловлен возникновением и распространением
возбуждения в миокарде желудочков, поэтому его называют желудочковым
комплексом. Возбуждение желудочков начинается с деполяризации
межжелудочковой перегородки, что ведет к появлению на ЭКГ интегрального вектора
— направленного вниз зубца Q.
Зубец
R является самым высоким в ЭКГ. Он
представляет собой период распространения возбуждения по основаниям
желудочков, в то время как зубец S отражает полный охват
возбуждением желудочков, когда вся поверхность сердца стала
электроотрицательной и исчезла, таким образом, разность потенциалов между
отдельными участками сердца. Комплекс QRS совпадает с реполяризацией предсердий. Его
длительность составляет 0,06—0,09 с.
Зубец
Т отражает восстановление
нормального потенциала мембраны клеток миокарда, т. е. реполяризации
миокарда. Этот зубец является самой изменчивой частью ЭКГ, так как
реполяризация происходит не одновременно в разных волокнах миокарда. Сегмент
ТР совпадает с периодом покоя сердца — общей паузой и диастолой. Общая
длительность комплекса QRST равна примерно 0,36 с. Электрокардиограмма и
основные показатели деятельности сердца в различные фазы сердечного цикла
приведены на рис. 9.19.
Относительная
продолжительность отдельных фаз ЭКГ млекопитающих имеет сходный характер,
несмотря на то что ритм сердца варьирует у них в очень широких пределах.
Например, у мыши при частоте сердечных сокращений 635 в 1 мин интервал PR составляет 57%, QT— 42%, у
крокодила при частоте сердечных сокращений 36 в 1 мин соответственно PR — 30%, QT — 70%. Во
время зимней спячки, например, у ежа сердце сокращается в редком ритме, поэтому
интервал PR будет несравненно длиннее
других компонентов ЭКГ.
В разных областях сердца во
время сердечного цикла процессы деполяризации и реполяризации возникают не
одновременно (рис. 9.19, 9.20). В связи с этим колеблется и разность
потенциалов между ними. Условную линию соединяющую две точки ЭКГ с наибольшей
разностью потенциалов, называют электрической осью сердца. В отдельные
периоды она характеризуется разной величиной и направленностью, т. е. обладает
свойством векторной величины едновременная регистрация величины разности
потенциалов и характера электрической оси сердца называется векторкардиограммой.
Для оценки сердечной деятельности стал широко
использоваться принцип эхолокации, характерный для многих позвоночных животных,
таких как дельфины, летучие мыши и т. д. В этом случае датчик работает по
принципу испускания и улавливания быстрых сигналов. При эхокардиографии
регистрируют ультразвуковые колебания, которые отражаются от различных cтpуктур
сердца — наружных и внутренних поверхностей стенок предсердий и желудочков,
перегородок, клапанов и др. (рис. 9.21). В результате образуются кривые
характеризующие изменения взаимного расположения и движения различных
отражающих поверхностей во времени. Метод позволяет получить объективные
показатели расстояний между Различными структурами органа, находящимися в
радиусе ультразвукового луча. Помимо того, метод также дает
|
|
|
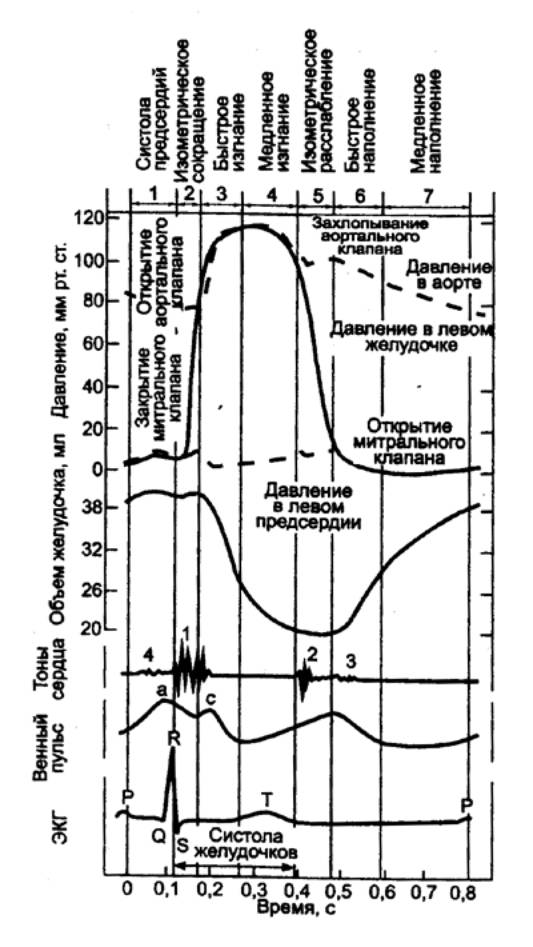
Рис. 9.19 Кривые
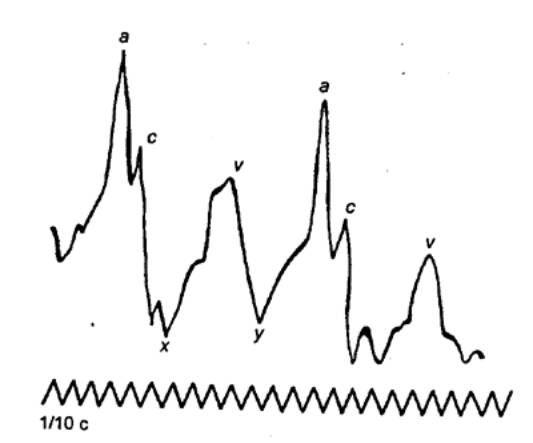
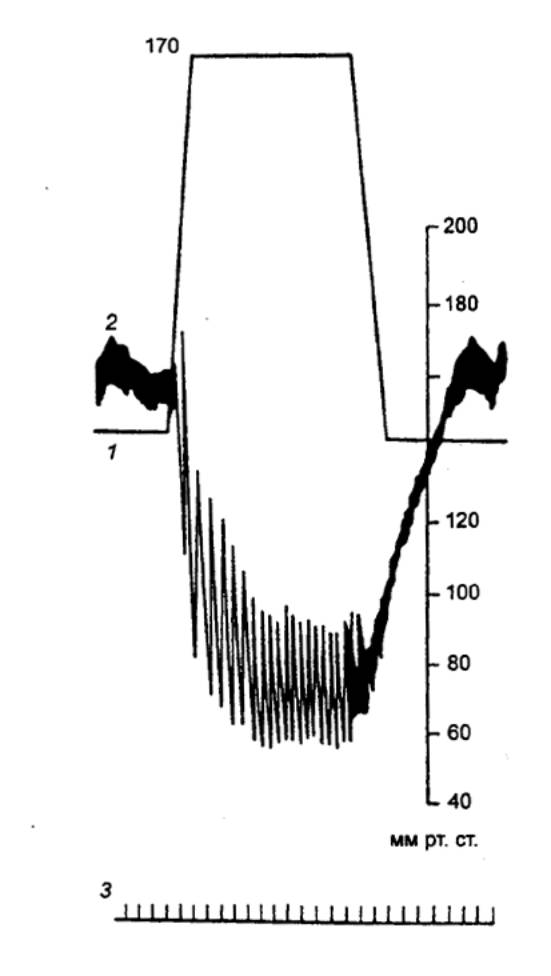
внутрижелудочкового давления, объема желудочка, венозного пульса,
фонокардиограмма и электрокардиограмма за один сердечный цикл |
|
|
|
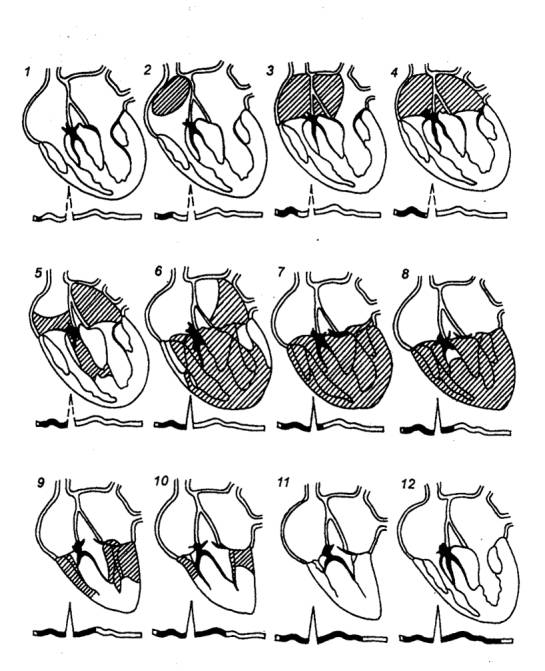
Рис. 9.20 Формирование
ЭКГ в ходе возбуждения сердца Возбужденные
участки заштрихованы. 1—12 — последовательные этапы возбуждения
сердца. Вверху – диафрагмы сердца;
внизу— ЭКГ. Темные участки на ЭКГ соответствуют заштрихованным на диаграгмме,
и отражающим состояние возбуждения. |
|
|
|
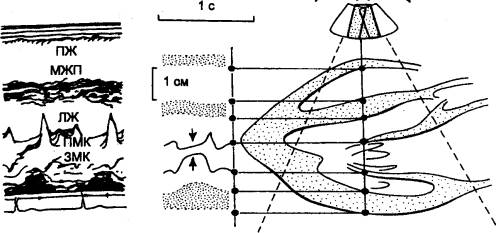
Рис. 9.21 Метод эхокардиографии. основанный на
принципе испускания и улавливания быстрых сигналов Видно захлопывание митрального клапана в начале
систолы (указано стрелками). На приведенной слева эхокардиограмме: ПЖ — правый
желудочек; МЖП — межжелудочковая перегородка; ЛЖ — левый желудочек; ПМК и ЗМК
— передняя и задняя створки митрального клапана. |
информацию
о динамике этих расстояний, например, об изменении размеров самого сердца в
процессе сердечного цикла, движениях клапанов.
У
беспозвоночных электрограмма нейрогенного сердца состоит из быстрых осцилляции
и медленных колебаний. Эти разряды соответствуют потенциалам пейсмекерных
ганглиозных клеток. Их удается зарегистрировать от одиночных нейронов. У
членистоногих форма и продолжительность аналогичных разрядов зависят от многих
факторов, таких, например, как температура.
У
ракообразных в сердечных ганглиях небольшое число нервных клеток образует
единую систему, обладающую ритмической активностью. Клетки эти мелкие и
крупные. Мелкие являются пейсмекерами, крупные — моторными нейронами,
воспроизводящими ритм пейсмекеров. От пейсмекерных нейронов регистрируются
медленные потенциалы. Моторные клетки разряжаются частыми импульсами в виде
залпов. Они не влияют на пейсмекерные клетки своими разрядами, но могут
оказывать электротоническое действие. Характер взаимоотношений между ними
предполагает наличие реверберирующих контуров.
Относительное постоянство параметров внутренней среды
организма, быстрое и точное приспособление гемодинамики к широкому разнообразию
условий, в которых находится организм, достигаются благодаря в высшей степени
совершенным механизмам регуляции сердечной деятельности. У млекопитающих, птиц,
рептилий и амфибий эта регуляция осуществляется принципиально одинаково и
складывается из присущих самому сердцу собственных механизмов, а также
внесердечных воздействий. К внутрисердечным регуляторным механизмам относят внутриклеточные,
регуляцию межклеточных взаимодействий и собственно внутрисердечные
нервные механизмы.. Внесердечные воздействия представлены нервной и
гуморальной регуляцией.
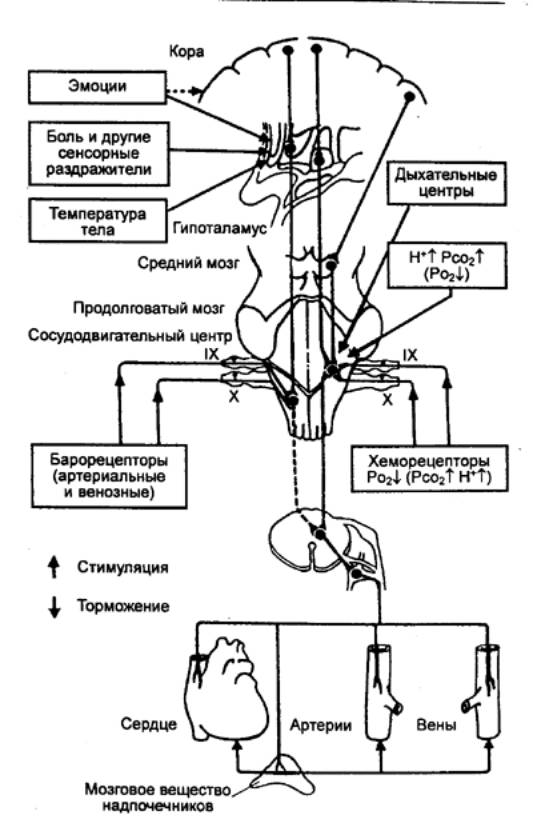
9.4.1.
Внутриклеточная регуляция
Внутриклеточный
уровень регуляции заключается в способности кардиомиоцитов при выполнении ими
специфической сократительной функции синтезировать различные белки в
соответствии с уровнем их разрушения. Синтез белков происходит
дифференцированно благодаря существованию специальных ауторегуляторных
механизмов. Процесс этот осуществляется кардиомиоцитами во взаимодействии с
соединительнотканными клетками.
|
|
|
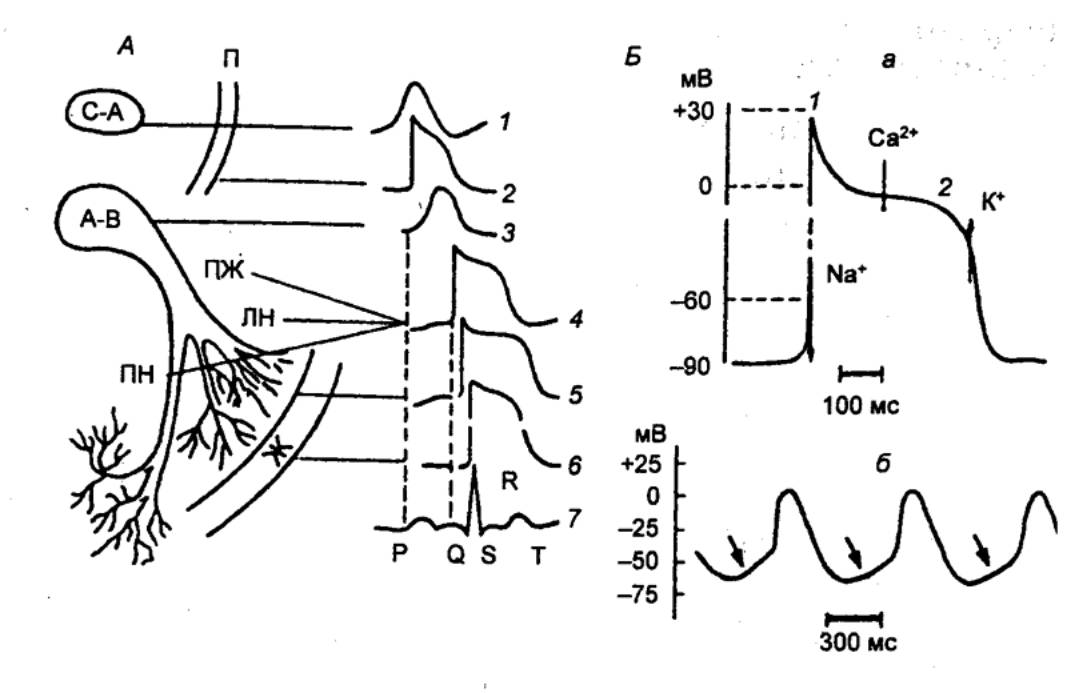
Рис. 9.22 Различные типы потенциалов действия
сердечных клеток, коррелированные с временным ходом ЭКГ А —
конфигурация потенциалов действия кардиомиоцитов различных отделов сердца; С—А — синусно—предсердный (синоатриальный узел); П
— предсердие; А—В — предсердно—жедудочковый (атриовентрикулярный) узел; ПЖ —
предсердно—желудочковый пучок (пучок Гиса); ПН и ЛН — правая и левая ножки
пучка; Ж — желудочки. 1—6 — потенциалы
действия клеток миокарда; 7 — ЭКГ; В
— потенциал действия одиночной клетки миокарда; а — ПД желудочка.
Стрелками показаны преобладающие потоки ионов Na+, Ca2+, K+,
ответственные за различные фазы (1—4}
ПД; б — авторитмическая активность синусно—предсердного (синоатриального)
узла. Стрелками показана медленная диастолическая деполяризация. |
Особенность
кардиомиоцитов заключается в цикличности их обменных процессов, связанных с
ритмом сердечной деятельности (рис. 9.22). Наиболее быстрый распад богатых энергией
соединений — АТФ и гликогена — происходит в момент систолы и соответствует
комплексу QRS электрокардиограммы.
Ресинтез и восстановление уровня этих веществ успевает полностью осуществиться
за время диастолы. Поэтому в чрезвычайных условиях при усиленной работе сердца
одним из компенсаторных механизмов, адаптирующих деятельность сердца к
воздействиям, является удлинение фазы диастолы.
Кардиомиоциты
способны избирательно адсорбировать из циркулирующей крови и накапливать в
цитоплазме вещества, поддерживающие и регулирующие их биоэнергетику, а также
соединения, повышающие потребность клеток в кислороде. Последнее имеет большое
приспособительное значение, так как эти влияния посредством гомеометрического
механизма регуляции сократительной силы сердца вызывают увеличение силы его
сокращений. Так возникающая благодаря внутриклеточным механизмам адсорбция из
крови катехоламинов (адреналина, норадреналина) обеспечивает усиление
сердечного кровотока что сопровождается более сильным растяжением клеток миокарда
во время диастолы. (Известно, что чем больше растянуты миофибриллы, тем сильнее
они сокращаются.) Следовательно, чем больше крови притекло к сердцу, тем
сильнее оно растянуто во время диастолы и тем интенсивнее его сокращение. Этот
механизм лежит в основе закона Франка—Старлинга (см. разд. 9.2.2).
В сердечной мышце межклеточная регуляция связана с
наличием вставочных дисков — нексусов, обеспечивающих транспорт
необходимых веществ, соединение миофибрилл, переход возбуждения с клетки на
клетку. Такая организация позволяет миокарду реагировать на возбуждение как
синцитий. В случае выпадения функции нексусов нарушается одновременность
прихода возбуждения к отдельным клеткам, синхронность сокращения мышечных
волокон появляется нарушение сердечного ритма. Межклеточная регуляция включает
также взаимодействие кардиомиоцитов с соединительнотканными клетками
составляющими строму сердечной мышцы. Наряду с механической опорной Функцией
соединительнотканные клетки являются источником пополнения кардиомиоцитов
высокомолекулярными органическими соединениями, постоянно необходимыми для
функции и для поддержания структуры клетки.
9.4.3. Внутрисердечная нервная регуляция
Внутрисердечный уровень регуляции является
автономным, хотя он включен и в сложную иерархию центральной нервной регуляции.
Собственная нервная регуляция сердца осуществляется метасимпатической нервной
системой, нейроны которой располагаются в интрамуральных ганглиях сердца (см.
разд. 5.4.3). Метасимпатическая нервная система обладает полным набором
функциональных элементов, необходимых для самостоятельной рефлекторной
деятельности: сенсорными клетками, интегрирующим интернейронным аппаратом,
двигательными нейронами.
Сенсорные нейроны обслуживают не только
внутрисердечные механизмы регуляции. По их аксонам, проходящим в составе
блуждающих и симпатических нервов, чувствительная импульсация может достигать
высших отделов нервной системы. В свою очередь, на вставочных и моторных
метасимпатических нейронах синаптически оканчиваются преганглионарные волокна
блуждающего нерва и сердечных симпатических ветвей, т. е. метасимпатические
нейроны — общий конечный путь для импульсов внутрисердечного и центрального
происхождения.
В
деятельности метасимпатической нервной системы участвует более 20 известных
сейчас медиаторов и модуляторов межнейронной передачи возбуждения. Долгое время
считали, что внутрисердечный нервный аппарат является лишь местом переключения
центробежных импульсов с преганглионарных волокон блуждающего нерва.
Интракардиальный метасимпатический нервный аппарат
регулирует ритм сердечных сокращений, скорость предсердно—желудочкового
проведения, реполяризацию кардиомиоцитов, скорость диастолического
расслабления.
Функции сердечной части метасимпатической нервной
системы особенно отчетливо выступают при трансплантациях сердца у теплокровных
животных. После дегенерации всех нервных волокон внесердечного происхождения
(симпатических и парасимпатических) она остается неповрежденной в структурном и
функциональном отношении. При разных нагрузках на организм с
гомотрансплантированным сердцем кровообращение в большом круге меняется так же,
как в нормальных условиях, и целиком обеспечивает потребности организма.
В специальных опытах при гемодинамическом разобщении
правой и левой половин сердца Т. И. Косицким установлено, что растяжение
механорецепторов одной из камер изолированного сердца сопровождается усилением
сокращения не только этой камеры, но и других камер, диастолическая длина
мышечных волокон которых не изменилась. Эти реакции других камер, в отличие от
растягиваемой и реагирующей согласно закону Франка—Старлинга, исчезают при
действии ганглиоблокаторов.
Местные сердечные рефлексы, осуществляемые метасимпатической нервной системой, регулируют
уровень сердечной деятельности в соответствии с потребностями общей
гемодинамики организма. Например, раздражение рецепторов растяжения при
усилении притока крови и переполнении коронарных сосудов сопровождается
ослаблением силы сердечных сокращений, уменьшением притока крови. В результате
в артериальную систему перекачивается меньший объем крови. Она задерживается в
венах, обладающих большей емкостью, предотвращая, таким образом, внезапный
выброс излишней крови в артерии, который мог бы привести к тяжелым последствиям
для организма.
Опасно для организма и уменьшение сердечного выброса.
Оно может вызвать критическое для жизни падение артериального давления. При
недостаточном растяжении
механорецепторов сердца из—за слабого заполнения его камер кровью возникает
процесс рефлекторного возрастания силы сердечных сокращений, что в результате
приводит к более интенсивному перекачиванию крови в аорту, усилению
притока из вен и более полному заполнению камер во время диастолы!
Следовательно,
осуществляемые метасимпатической нервной системой внутрисердечные
периферические рефлексы выполняют в организме защитную роль, поддерживая
стабильность наполнения кровью артериальной системы.
9.4.4.
Экстракардиальная нервная регуляция
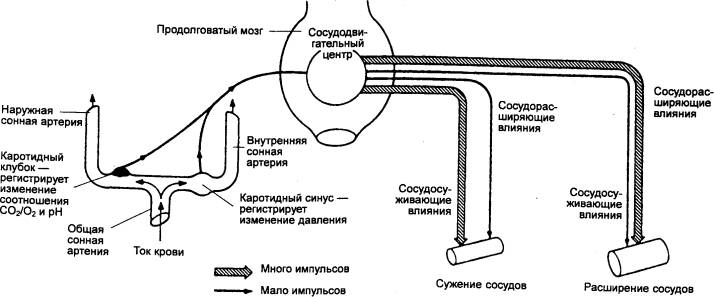
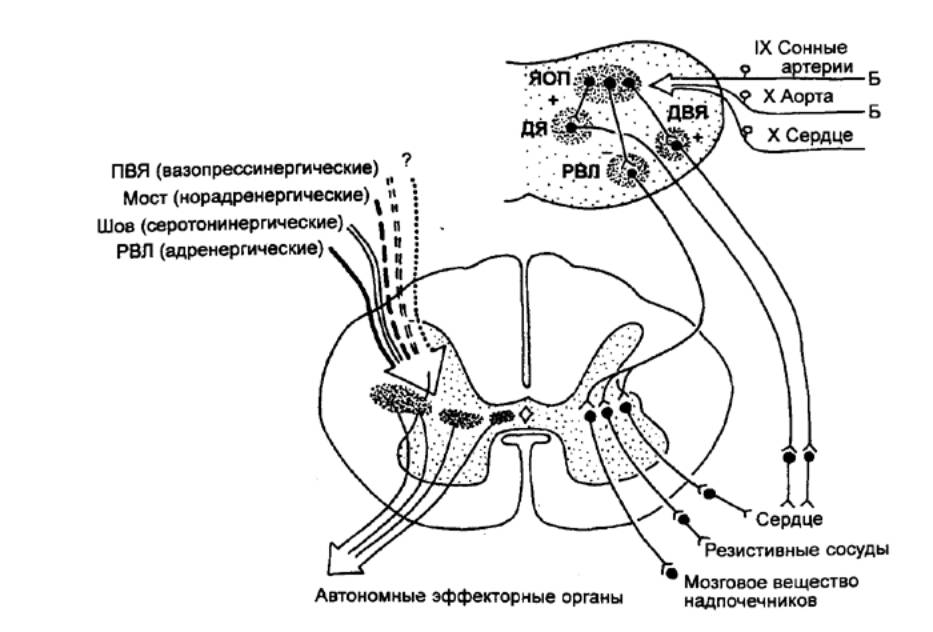
Экстракардиальный
уровень регуляции обеспечивают специальные супраспинальные и корковые
механизмы, передающие свои влияния по волокнам блуждающих и симпатических
нервов.
Эволюция
внесердечных регуляторных нервных механизмов шла по пути специализации и совершенствования. У моллюсков сердце
снабжено ускоряющими и тормозными нервными волокнами, идущими в составе
висцеральных нервов. У одних видов моллюсков при стимуляции этих волокон
преобладает торможение сердечной деятельности. При этом один залп импульсов
может вызвать задержку одного сердечного сокращения. У других видов более
выражено ускорение, у третьих — вслед за ускорением наступает торможение.
Ускоряющие волокна имеют более высокий порог, чем тормозные. При повторном
раздражении может возрастать амплитуда сердечных сокращений.
Строение
экстракардиальных путей ракообразных более совершенно. Из ЦНС к сердцу
направляется несколько нервов. Они регулируют пейсмекерный ганглий и сердечную
мышцу. У отдельных видов к сердцу подходят две пары ускоряющих и одна пара
тормозных нервов, берущих начало в подглоточном ганглии.
Внесердечные
механизмы регуляции у высших позвоночных принципиально одинаковы. Деятельностью
сердца у них непосредственно управляют сердечные центры продолговатого мозга и
моста, влияния которых передаются сердцу по блуждающим и симпатическим нервам
(рис. 9.23).
Регистрация
электрических процессов в одиночных чувствительных нервных волокнах предсердия
выявила существование двух типов механорецепторов. На активное
напряжение реагируют А—рецепторы, на пассивное растяжение отвечают В—рецепторы.
Волокна от этих специализированных рецепторов идут в составе блуждающего нерва.
Помимо того, имеется большая группа свободных нервных окончаний,
локализующихся преимущественно в субэндокардиальном сплетении. Их волокна
проходят в составе симпатических путей и передают сигналы болевой
чувствительности.
Вагусные влияния. В продолговатом мозгу располагается парасимпатическое
ядро блуждающего нерва. Аксоны клеток этого ядра в составе правого и левого
нервных стволов направляются к сердцу и образуют синапсы на моторных
метасимпатических нейронах интрамуральных ганглиев. Волокна правого блуждающего
нерва распределяются преимущественно в правом предсердии. В соответствии с этим
связанные с ним метасимпатические нейроны иннервируют миокард, коронарные
сосуды и особенно густо пронизывают синусно—предсердный узел. Напротив, волокна
левого блуждающего нерва через посредство метасимпатических нейронов передают
свои влияния предсердно—желудочковому узлу. В результате такой структурной
топографии стимуляция правого блуждающего нерва сказывается преимущественно на
частоте сердечных сокращений, левого — на предсердно—желудочковом проведении.
Впервые влияние блуждающих
нервов на сердце обнаружили братья Э. и Э. Г. Веберы (1845). Они установили,
что стимуляция этих нервов уменьшает частоту сокращений сердца и ослабляет их
силу. Как было показано позднее, сильные раздражения периферического конца
перерезанного блуждающего нерва или введение ацетилхолина в сердце
сопровождаются замедлением сердечного ритма, или так называемым отрицательным
хронотропным эффектом. Одновременно возникает уменьшение амплитуды
сокращений сердца — отрицательный инотропный эффект, понижается
возбудимость сердечной мышцы — отрицательный батмотропный эффект,
уменьшается скорость проведения возбуждения в сердце — отрицательный
дромотропный эффект. При этом иногда возникает полная блокада проведения
возбуждения в предсердно—желудочковом узле.
Сильное раздражение
блуждающих нервов
|
|
|
Рис. 9.23 Общая иннервация
сердца 1 — мозжечковые влияния, 2 — ядро одиночного пути, 3 — гипоталамические влияния, 4 — афференты от периферических
механо— и хеморецепторов, 5 — ядро блуждающего нерва, 6 — блуждающий нерв, 7 — сердце, 8 — метасимпатическая нервная сеть, 9 — симпатический узел, 10
— спинной мозг, 11 —
ядро сосудодвигательного центра, 12
— стволовые центры, 13 —
ствол мозга. |
может
вызвать полную остановку сердечной деятельности, однако прекратившиеся вначале
сокращения сердца, несмотря на продолжающееся раздражение, способны постепенно
восстановиться. Это явление получило название ускользания сердца из—под
влияния блуждающего нерва.
Во
время умеренной стимуляции блуждающего нерва хронотропный эффект из—за
замедления диастолической деполяризации может изменяться. При этом мембранный
потенциал сердечных клеток приобретает пороговое значение позднее, чем в
обычных условиях. Во время сильных раздражении диастолическая деполяризация
исчезает совсем и возникает гиперполяризация клеток—водителей ритма. Отрицательный
инотропный эффект связан с укорочением ПД, хотя форма последнего остается
неизменной. Слабое раздражение блуждающих нервов может быть подобным действию
симпатических нервов. Это явление объясняется тем, что в составе интрамуральных
метасимпатических эффекторных нейронов кроме холинергических находятся нейроны
с адренергическим или другим видом передачи, обладающие более низким порогом
возбуждения.
Эффект
блуждающего нерва при одной и той же силе раздражения может иногда
сопровождаться и противоположными реакциями. Это связано со степенью наполнения
сердца и сердечных сосудов кровью, т. е. с активностью собственного
внутрисердечного нервного аппарата. При его переполнении или значительном
наполнении раздражение волокон блуждающего нерва сопровождается появлением
тормозных реакций. Напротив, при слабом наполнении сердца и, соответственно,
слабом возбуждении механорецепторов внутрисердечной нервной сети проявляются
стимулирующие влияния.
Следовательно,
наполнение кровью артериальной системы посредством насосной функции сердца
регулируется двумя дублирующими механизмами его деятельности — собственными
внутрисердечным и центральным, передаваемым по волокнам блуждающего нерва.
Симпатические влияния. Влияние на сердце раздражения симпатического нерва впервые
исследовали И. Ф. Цион (1867), а затем в 80—х гг. одновременно И. IL Павлов и У. Гаскелл. Оказалось, что симпатический
нерв, как и блуждающий, влияет на все стороны сердечной функции. Однако это
влияние имеет противоположную направленность по сравнению с раздражением
блуждающего нерва и проявляется в учащении сокращений сердца — положительный
хронотропный эффект, усилении сокращений предсердий и желудочков — положительный
инотропный эффект, улучшении проведения возбуждения в сердце — положительный
дромотропный эффект, повышении возбудимости сердца — положительный
батмотропный эффект.
Среди
симпатических ветвей, идущих к сердцу, как установил И. П. Павлов находятся
волокна, раздражение которых вызывает избирательное увеличение силы сердечных
сокращений, это усиливающий нерв сердца. По мнению И. П. Павлова, этот
нерв играет трофическую роль, он оказывает влияние на проведение возбуждения в
сердечной мышце. Посредством его стимуляции можно снять блокаду проведения
возбуждения в предсердно—желудочковом узле.
При положительном инотропном
эффекте восходящая часть кривой, отражающей сокращение предсердий и желудочков,
бывает круче, помимо того уменьшается интервал от начала сокращения до пика.
При этом увеличивается скорость расслабления миокарда. Положительный
дромотропный эффект относится только к предсердно—желудочковому узлу.
Симпатическая стимуляция усиливает в нем проведение возбуждения и тем самым
укорачивает интервал между сокращениями предсердий и желудочков. Что касается
батмотропии, под которой понимают влияние на возбудимость ткани, то стимуляция
симпатических нервов повышает возбудимость лишь в том случае, если она была
перед этим снижена. (Некоторые авторы считают понятие батмотропного эффекта
неясным и путаным и предлагают вообще от него отказаться.)
Вызываемые раздражением
симпатических волокон эффекты возникают через большие промежутки времени,
превышающие 10 с, и продолжаются еще длительное время после окончания
раздражения. Характерно, что при одновременном раздражении симпатических и
блуждающих нервов преобладает действие на сердце блуждающих нервов.
|
|
|
Рис. 9.24 Опыт О. Леви А — схема опыта, Б — кривые сердечных сокращений при раздражении блуждающего
нерва; I — денервированное
сердце лягушки, 2 — сердце
лягушки с оставшейся веточкой блуждающего нерва, 3 — стимулятор, 4 —
вагусная остановка раздражаемого сердца, 5 — остановка второго сердца. |
В основе эффектов, вызываемых стимуляцией
периферических концов тех и других нервов, лежит выделение биологически
активных веществ, с помощью которых осуществляется передача возбуждения.
Впервые это было установлено австрийским фармакологом О. Леви (1921). Он
соединил два изолированных сердца лягушки с двумя концами одной и той же канюли
(рис. 9.24).
Сильное
раздражение блуждающего нерва одного из сердец вызывало остановку не только
иннервируемого этим нервом сердца, но и другого, интактного, связанного с
первым только общим раствором канюли. Следовательно, при раздражении первого
сердца в раствор выделялось вещество, влияющее на второе сердце. Это вещество
было названо «вагусштофф» и оказалось впоследствии ацетилхолином. При
аналогичном раздражении симпатического нерва сердца было получено другое
вещество — «симпатикусштофф», представляющее собой адреналин или норадреналин,
сходные по своему химическому строению.
Действие
ацетилхолина на сердце (рис. 9.25) в первую очередь основано на
повышении мембранной проницаемости для иона K+,
препятствующей развитию деполяризации. С этим же явлением связано запаздывание
в синусно—предсердном узле медленной диастолической деполяризации, что
сопровождается укорочением ПД кардиомиоцитов и в итоге ослаблением сокращения
сердца. В предсердно—желудочковом узле усиленный отток K+
противодействует входящему току ионов Са2+ Ацетилхолин быстро
разрушается и оказывает только местное действие, связываясь с определенными
молекулярными структурами клеток — холинорецепторами. Антагонистом
ацетилхолина и раздражающих влияний блуждающего нерва в сердце является
атропин.
По—иному
влияет на возбудимые структуры сердца норадреналин (рис. 9.26). Его
действие связано с ростом мембранной проницаемости для Са2+, что
сопровождается повышением степени сопряжения возбуждения и сокращения миокарда,
а также потенциалозависимой проницаемости для К+. Норадреналин может
в определенных пределах восстанавливать изменение функции сердца при сдвигах
содержания калия в крови во время чрезмерных физических нагрузок, или других
состояний. Сниженная избытком К+ возбудимость и проводимость
предсердий и желудочков восстанавливается норадреналином. Норадреналин
разрушается значительно медленнее, чем ацетилхолин, поэтому его взаимодействие
с адренорецепторами сердечных клеток, как и раздражение симпатических волокон,
сопровождается более продолжительным эффектом.
|
|
|
Рис.
9.25 Влияние раздражения блуждающего
нерва на сердце лягушки А — запись сокращения изолированного сердца, под
кривой — отметка раздражения блуждающего нерва; Б — запись сокращения второго изолированного сердца. Стрелкой
отмечен момент переноса жидкости, питавшей первое сердце во время
раздражения, во второе сердце. |
|
|
|
Рис. 9.26 Влияние раздражения
симпатического нерва на сердце лягушки А — резкое усиление и учащение сердечных сокращений
при раздражении симпатического нерва (отметка раздражения на нижней линии); Б — действие физиологического
раствора, взятого из первого сердца во время стимуляции симпатического нерва,
на второе сердце, не подвергавшееся раздражению. |
Гуморальная
регуляция деятельности сердца осуществляется биологически активными веществами,
выделяющимися в кровь и лимфу из эндокринных желез, а также ионным составом межклеточной
жидкости. Эта регуляция в наибольшей степени присуща адреналину,
секретируемому мозговым слоем надпочечников. Адреналин выделяется в кровь при
эмоциональных нагрузках, физическом напряжении и других состояниях (см. разд.
5.2.2 и 6.4.1). Его взаимодействие с (β—адренорецепторами кардиомиоцитов
приводит к активации внутриклеточного фермента аденилатциклазы.
Последний ускоряет образование циклического АМФ (цАМФ). В свою очередь, цАМФ
необходим для превращения неактивной фосфорилазы в активную. Активная
фосфорилаза обеспечивает снабжение миокарда энергией путем расщепления
внутриклеточного гликогена с образованием глюкозы. Адреналин повышает также
проницаемость клеточных мембран .для ионов Са2+
Важное
значение имеет гормон поджелудочной железы и кишки — глюкагон. Он
оказывает на сердце положительный инотропный эффект путем стимуляции
аденилатциклазы. Гормон щитовидной железы — тироксин — увеличивает
частоту сердечных сокращений и повышает чувствительность сердца к симпатическим
воздействиям. Гормоны коры надпочечников — кортикостероиды, биологически
активный полипептид — ангиотензин II, вещество энтерохромаффинных клеток
кишки — серотонин — увеличивают силу сокращений миокарда.
Большое
влияние на деятельность сердечной мышцы оказывает ионный состав среды.
Повышение содержания во внеклеточной среде К+ угнетает деятельность
сердца. При этом вследствие изменения градиента концентрации иона увеличивается
проницаемость мембран для К+ падают возбудимость, скорость
проведения возбуждения и длительность ПД. В этих условиях синусно—предсердный
узел перестает выполнять роль водителя ритма. Подобным образом на сердце влияют
ионы НСО3— и Н+. Ионы Са2+
повышают возбудимость и проводимость мышечных волокон, активируя фосфорилазу и
обеспечивая сопряжение возбуждения и сокращения.
Как уже было показано, первая ступень иерархии
нервных центров, регулирующих нормальную работу сердца, представлена местными
рефлексами, которые осуществляются метасимпатической нервной системой. Второй
ступенью являются ядра блуждающих и симпатических нервов, обладающие
характерным тоническим свойством. Под тонусом обычно понимают длительное, то
усиливающееся, то ослабевающее возбуждение, не сменяющееся торможением (см.
разд. 5.4.4).
У человека и большинства млекопитающих работа
предсердий и синусно—предсердного узла постоянно контролируется блуждающим и
симпатическим нервами, в то время как желудочки находятся под контролем
преимущественно симпатических нервов. В существовании тонуса блуждающих нервов
легко убедиться, перерезав у животного правый и левый нервы. В этом случае
частота сердечных сокращений возрастает почти вдвое. Отсюда может быть сделан
вывод, что автоматическая деятельность сердца все время подвергается угнетению
импульсами, идущими по волокнам блуждающего нерва. Наличие этих разрядов легко
прослеживается при регистрации эфферентной импульсации. В покое тонус
блуждающих нервов преобладает над симпатическим тонусом.
Тонус блуждающих нервов (см. разд. 5.4.4) возникает в результате притока
импульсации от рецептивных зон дуги аорты, каротидного синуса, кроме того, он
обусловлен восходящими активирующими влияниями ретикулярной формации, клеткам
которой свойственна постоянная импульсная активность. Она связана с
конвергенцией коллатералей огромного числа чувствительных путей, а также с
высокой чувствительностью ее клеточных мембран.
В поддержании тонуса участвуют различные гуморальные
раздражители, такие как гормоны, уровень парциального давления CO2. Тонус
блуждающих нервов находится в зависимости и от фаз дыхательного цикла. Во время
выдоха он повышается, что влечет за собой урежение частоты сердечных
сокращений. Это обычное в нормальных условиях состояние называют дыхательной
аритмией (феномен Геринга). Дыхательная аритмия исчезает после атропинизации
животных или перерезки у них блуждающих нервов.
Определенным тонусом обладают также симпатические
клетки, посылающие свои аксоны к сердцу. После перерезки всех симпатических
путей или удаления основных источников симпатической иннервации сердца — шейно—грудных
(звездчатых) ганглиев — ритм сердца собаки снижается на 15—25%. При полной
симпатической и парасимпатической денервации сердца оно начинает сокращаться в
ритме, который задается синусно—предсердным узлом. Этот собственный ритм сердца
несколько выше, чем ритм интактного сердца.
Таким образом, перерезка блуждающих и симпатических
нервов, равно как и их раздельная стимуляция, приводит к противоположным
изменениям различных показателей сердечной деятельности. Однако это не означает,
что действие этих нервов на сердце взаимно нейтрализуется. Напротив, нормальная
работа сердца определяется взаимодействием влияний, поступающих к нему по
блуждающим и симпатическим путям.
9.4.7. Гипоталамическая регуляция
Ядра гипоталамуса являются следующей ступенью в
иерархии нервных центров, регулирующих сердечную деятельность (см. разд. 6.2).
В процессе филогенеза эта функция возникает с первым появлением гипоталамуса
среди позвоночных — у рыб. Гипоталамус рыб может облегчать и тормозить сердечные
рефлексы. У млекопитающих посредством прямых связей гипоталамус соединяется с
ядрами блуждающих нервов в продолговатом мозгу и боковыми рогами спинного
мозга, т. е. с центрами парасимпатической и симпатической иннервации сердца.
У наркотизированных животных при раздражении
различных зон гипоталамуса удалось выявить точки, стимуляция которых
сопровождается изменением либо только ритма сердца, либо только силы сокращений
или расслабления миокарда левого желудочка. Следовательно, в гипоталамусе
существуют отдельные структуры, регулирующие определенные функции сердца. При
раздражении одной и той же точки гипоталамуса возникающие эффекты чаще всего
обусловлены одновременно и симпатическими, и парасимпатическими механизмами. По
своей силе и выраженности эти реакции значительно превосходят реакции в
естественных условиях, где они не возникают изолированно друг от друга.
Непосредственное участие в регуляции работы сердца принимают
паравентрикулярное, вентромедиальное и предоптическое ядра, сосцевидные тела.
Гипоталамус — интегративный центр, который может
изменять параметры сердечной деятельности для обеспечения текущих потребностей
организма и всех его систем при различных поведенческих реакциях. Однако
осуществляемая им перестройка деятельности висцеральных органов не является
самостоятельной, а зависит от сигналов, поступающих из лимбической системы и
коры головного мозга.
Кора головного мозга является высшей ступенью
в иерархии механизмов целенаправленного управления деятельностью сердца (см.
разд. 5.5.7). Электрическая стимуляция почти любого участка коры мозга вызывает
ответы сердечнососудистой системы. Они проявляются особенно отчетливо при
раздражении моторной и премоторной зон коры, поясной извилины, орбитальной
поверхности лобных долей, передней части височной доли. Эти активные области
совпадают с зонами проекций в кору больших полушарий блуждающего нерва и его
сердечных ветвей. Анатомическое соседство пунктов, ответственных за
возникновение двигательных реакций и реакций сердца, имеет важное значение для
оптимального обеспечения сердцем поведенческих реакций индивидуума.
При относительно нормальном функционировании
организма кора мозга как и гипоталамус, способна тормозить или активировать
работу сердца. Использование в экспериментах хирургической декортикации или
распространяющейся калиевой депрессии изменяет характер исходных сердечных
рефлексов, снимая модулирующее влияние коры полушарий.
Кора головного мозга является органом психической
деятельности обеспечивающим целостные приспособительные реакции организма.
Многочисленные наблюдения показывают, что работа сердца изменяется при действии
условии, влияющих на деятельность коры мозга: боли, страха, радости, тревоги,
ярости и т. п. Например, у спортсменов наблюдается так называемое предстартовое
состояние, проявляющееся учащением сердцебиения. Оно связано с активацией
корой мозга гипоталамо—гипофизарной системы и надпочечников выделяющих
адреналин в кровь. Сигналы, непосредственно предвещающие возникновение этих
ситуаций или возможность их наступления, способны по механизму условного
рефлекса вызвать перестройку функций сердца, чтобы обеспечить предстоящую
деятельность организма.
Влияние коры полушарий на работу сердца
подтверждается многочисленными наблюдениями с образованием экстероцептивных и
интероцептивных условных рефлексов. В обоих случаях модулирующие влияния коры
направлены к центрам продолговатого и спинного мозга, где формируется
эфферентная импульсация к сердцу. Она приспосабливает работу сердца к текущим
или предстоящим потребностям организма в целом, отдельных органов и систем и,
наконец, самого сердца. При очень сложных ситуациях, действиях чрезвычайных
раздражителей могут возникнуть нарушения и срывы высших регуляторных механизмов
(неврозы). В этих случаях параллельно с расстройствами поведенческих
реакций возможны существенные нарушения деятельности сердца.
Емкость сосудистого русла варьирует в широких
пределах в зависимости от условий существования организма в окружающей среде, а
также при изменении деятельности любых его органов. В связи с этим частота и
сила сердечных сокращений могут рефлекторно увеличиваться или уменьшаться.
Изменение деятельности сердца обычно происходит параллельно с изменением
состояния сосудов. Регуляция сердечной деятельности является сложным
рефлекторным актом при участии центральных и периферических механизмов. По
эфферентным нервным волокнам к сердцу передаются импульсы, возникающие
рефлекторно в ответ на раздражение различных интеро— и экстероцепторов.
В системе кровообращения существует ряд рефлексов,
имеющих важное гемодинамическое значение. Характерным признаком этих
рефлексов является постоянство в расположении их рецептивных полей. К числу
таких полей относятся (см. рис. 9.23) устья полых вен, дуга аорты и сонный
(каротидный) синус — область разветвления сонной артерии на наружную и
внутреннюю. В этих рецептивных полях, именуемых иначе рецептивными зонами,
сосредоточено огромное количество механо— и хеморецепторов, тонко реагирующих
на различные изменения гемодинамики. Возникающие в этих рецепторах импульсы по
чувствительным волокнам поступают к циркуляторным центрам продолговатого мозга
и другим отделам ЦНС.
В устье полых вен при их впадении в сердце находятся рецепторы
растяжения, разделяющиеся, как и в предсердии, на рецепторы типа А и
рецепторы типа В. Оба вида рецепторов возбуждаются при малейшем колебании
внутрисосудистого объема крови, первые — при активном сокращении предсердий,
вторые — при пассивном растяжении мускулатуры предсердий.
Эта область является рецептивным полем для рефлекса
Бейнбриджа, состоящего в том, что при повышении давления крови в полых
венах возникает возбуждение рецепторов обоих типов, рефлекторно уменьшается
тонус блуждающего нерва и возрастает тонус симпатического нерва. Сигналы от А—рецепторов
повышают симпатический тонус. Оба эти влияния вызывают ускорение сердечного
ритма с возрастанием силы сокращений. Тем самым при интенсивном притоке крови
предсердия и венозная часть кровеносной системы предохраняются от чрезмерного
растяжения.
Из рефлекторных влияний на деятельность сердца особую
роль играют импульсы от механорецелторов каротидного синуса и дуги
аорты. Пока существует циркуляция крови и поддерживается кровяное давление,
эти рецепторы постоянно находятся в возбужденном состоянии. Степень их
возбуждения зависит от уровня кровяного давления. Чем оно выше, тем сильнее
разряжаются рецепторы, тем интенсивнее рефлекторное возбуждение сердечных
волокон блуждающего нерва и, как следствие, торможение деятельности сердца.
Наряду с механорецепторами этих областей в
рефлекторной регуляции сердца принимают непосредственное участие и хеморецепторы.
Адекватными раздражителями для них является напряжение O2 и СО2
(или повышение концентрации ионов Н+) в крови. При возбуждении
импульсы от хеморецепторов, направляясь в центры продолговатого мозга, приводят
к снижению частоты сердечных сокращений.
|
|
|
Рис. 9.27 Вагусные рефлексы на сердце (А, Б) и их
графическое отражение А — рефлекс Гольтца
(раздражение — удар в надчревную область, реакция — рефлекторная остановка
сердца); В — рефлекс Даньини—Ашнера
(раздражение — давление на глазные яблоки, реакция — рефлекторное замедление
сердечных сокращений); 1 —
продолговатый мозг, 2 —
блуждающий нерв, 3 — сердце, 4 —
гипоталамус. |
Рецептивные зоны расположены и в легочной артерии,
поэтому при повышении давления в малом кругу происходит замедление сердечного
ритма и увеличение объема селезенки (рефлекс П (Ирина).
Интенсивное механическое или химическое раздражение
интероцепторов, содержащихся во всех кровеносных сосудах, тканях и органах, как
было установлено В. Н. Черниговским, может рефлекторно изменять деятельность
сердца, вызывая либо учащение и усиление, либо ослабление сердечных сокращений.
Отчетливое торможение сердечной деятельности наблюдается при раздражении
рецепторов брюшины. Так, поколачиванием по брюху лягушки пинцетом можно
уменьшить частоту сердечных сокращений вплоть до остановки сердца (рефлекс
Гольтца). У человека подобная обратимая остановка сердца возникает при
сильном ударе в живот. В этом случае афферентные импульсы по чревным нервам
достигают спинного мозга, а затем ядер блуждающих нервов. Оттуда по эфферентным
волокнам они направляются к сердцу. К вагусным рефлексам относится и глазосердечный
рефлекс (рефлекс Даньини—Ашнера), заключающийся в том, что при надавливании
на глазные яблоки происходит замедление пульса на 4—8 ударов в 1 мин и снижение
артериального давления (рис. 9.27).
Импульсы от проприоцепторов скелетных мышц могут
оказывать влияние на регуляцию сердечного ритма. Возникающий при интенсивной
мышечной деятельности поток разрядов тормозит центры продолговатого мозга, что
сопровождается учащением сердечного ритма и изменением сосудистого тонуса.
9.4.10. Эндокринная функция сердца
Известно, что мышечные клетки предсердий секретируют
специфический гормон — атриальный натрийуретический пептид. Его
выделение стимулируется растяжением предсердий, возникающим в результате
притока крови, изменением в ней уровня натрия, а также симпатическими и
парасимпатическими влияниями и содержанием в крови вазопрессина.
Натрийуретический гормон характеризуется широким спектром биологической
активности. Он обладает способностью отчетливого повышения почками экскреции
ионов Na+ и Cl—,
подавляя реабсорбцию этих ионов в канальцах нефронов. Влияние гормона на диурез
происходит также за счет увеличения клубочковой фильтрации и подавления
реабсорбции воды в канальцах. Гормон расслабляет гладкие мышцы стенки пищеварительного
тракта и мелких сосудов. Последнее способствует снижению артериального
давления. Гормон подавляет секрецию ренина, тормозит действие альдостерона и
ангиотензина II.
Присущие крови функции могут выполняться только при
условии ее постоянного движения по кровеносным сосудам. У позвоночных животных
кровь находится в системе эластичных сосудов — артерий, вен, капилляров, —
не выходя из этой системы. Основные структуры сосудистой системы млекопитающих
представлены на рис. 9.28. В связи с тем, что кровь всегда остается внутри
замкнутого объема, систему кровообращения позвоночных, головоногих моллюсков
(осьминога), иглокожих принято называть замкнутой. В отличие от
позвоночных у насекомых, большинства ракообразных, многих моллюсков и
оболочечников кровеносные сосуды обрываются, и кровь, прежде чем вновь
вернуться к сердцу, свободно распределяется между тканями. Такая система
кровообращения получила название незамкнутой.
|
|
|
Рис. 9.28 Основные структуры, сосудистой системы млекопитающих Кровь поступает из крупных
артерий в крупные вены через микроциркуляторные русла; в. д. — внутренний
диаметр; А—В — артерио—венозный. |
Замкнутая система характеризуется тем, что давление в
ней относительно велико и постоянно. Для поддержания давления в промежутках
между сердечными сокращениями в системе необходимо наличие эластических стенок.
Помимо того, потребности в кровоснабжении разных органов не только различны но
постоянно изменяются в зависимости от деятельности снабжаемых кровью органов.
Отсюда становится необходимым существование ряда специальных контролирующих и
регулирующих механизмов. Наконец, в замкнутой системе кровь быстро возвращается
к сердцу.
В незамкнутой системе давление, как правило,
небольшое и создание в ней высокого давления невозможно. Невозможно также
поддержание и постоянного давления. Распределение крови между органами в этой
системе является труднорегулируемым процессом. В отличие от замкнутой системы
кровь в ней возвращается к сердцу медленно.
9.5.1. Эволюция сосудистой системы
У кишечнополостных и низших червей еще нет
кровеносной системы в принятом понимании этого слова. Жидкость, посредством
которой осуществляются транспортные функции, находится в системе специальных,
густо разветвляющихся в теле животного каналов. Каждый из каналов одним концом
соединяется с первичной полостью. Жидкость в каналах перемешивается благодаря
общим движениям тела и деятельности мерцательного эпителия, выстилающего стенки
канальцев. По существу, у этих животных имеет место не циркуляция крови, а лишь
перемешивание тканевой жидкости.
Впервые примитивная система кровообращения,
специально предназначенная для перемещения жидкости, появляется у кольчатых
червей. Характерным для этой системы является возникновение
перистальтических сокращений сосудистых трубок, перегоняющих жидкость. Однако у
этой системы отсутствует капиллярная часть и артериальные сосуды открываются
непосредственно в межтканевые пространства — лакуны. Здесь «кровь»
смешивается с тканевой жидкостью и, пропитывая ткани, соприкасается
непосредственно с каждой клеткой. Из этих же пространств берут начало вены.
Следовательно, у червей сосуды являются не более как приносящими и
коллекторными трубками.
Дальнейшее совершенствование
организации сосудистой системы шло в трех направлениях. Во—первых, происходило
обособление сократительных элементов стенки сосудов в специальной насосный
орган — сердце. Во—вторых, развивалась капиллярная сеть и происходило
превращение лакунарной системы в замкнутую кровеносную систему. В—третьих,
происходило разделение циркулярной системы на две специализированные части,
одна из которых снабжала кровью органы и ткани — большой круг, другая
предназначалась для обогащения крови кислородом — малый круг.
У моллюсков, хотя сосудистая система остается
лакунарной, уже появляется полый орган — сердце, состоящий из двух
камер, имеющих собственный ритм сокращения и отличающийся от пульсирующей
трубки червей. Следующим этапом эволюции явилось образование у рыб полностью
дифференцированного двухкамерного сердца и замкнутой сосудистой
системы. Однако у них нет разделения кровообращения на малый и большой
круги, и сердце просто располагается в венозной части кровяного русла. Из
желудочков кровь у рыб поступает непосредственно в жаберные сосуды. Последние
распадаются на капилляры, где и происходит обмен газов. Капилляры жабр
соединяются снова, образуя аорту, по которой кровь распределяется по органам и
тканям.
Основным эволюционным приобретением двоякодышащих
рыб явилось то, что в дополнение к жабрам дыхательными органами, связанными
с системой кровообращения, становятся и легкие. Жабры у них получают
частично кровь, которая уже прошла легкие, но жаберные дуги дегенерировали и по
некоторым из них кровь проходит транзитом, не задерживаясь для газообмена.
Претерпело изменение и строение сердца. Предсердие полностью разделено на две
камеры. Частичному разделению подвергся желудочек, напоминая этим сердце
млекопитающих и отличаясь от стоящих на более высокой ступени эволюционной
иерархии амфибий. У двоякодышащих рыб обогащенная кислородом кровь переносится
из легких в левое предсердие, венозная кровь поступает из большого круга
кровообращения в правое предсердие. Частичное разделение желудочка не позволяет
крови полностью смешиваться, и, таким образом, более оксигенированная кровь
направляется в голову, менее насыщенная кислородом из правой половины сердца
попадает в спинную аорту и частично в легкие.
Следовательно, на этом этапе эволюции
был сделан первый шаг к разделению кровообращения на легочный круг и круг
кровообращения через остальные органы.
. У современных земноводных (лягушек,
саламандр) сердце состоит из разделенных предсердий и одного неразделенного
желудочка. Правое предсердие получает венозную кровь и проталкивает ее в
желудочек. Из желудочка кровь поступает в аорту, вблизи основания которой
расположено пульсирующее утолщение с внутренней спиральной перегородкой.
Благодаря этому приспособлению кровяной поток распределяется по двум
направлениям. Одна часть идет в легочную артерию, другая — непосредственно к
органам, т. е. в большой круг кровообращения. Пройдя через систему легочных
капилляров, кровь возращается в левое предсердие и отсюда снова попадает в
левый желудочек и аорту. Легочные артерии посылают ветви также в кожу, что
имеет большое значение, так как кожа земноводных играет значительную роль в
поглощении кислорода.
Следовательно, у земноводных малый
круг кровообращения является лишь ответвлением от общей системы циркуляции.
В результате особенностей устройства
кровеносного русла у земноводных в желудочек из левого предсердия поступает
оксигенированная кровь и одновременно из правого предсердия — восстановленная.
И хотя в желудочке перегородка отсутствует, полного смешивания артериальной и
венозной крови в нем не происходит. В связи с расположением на эндотелиальной
поверхности желудочков особых выростов поток крови из правого предсердия по
правой половине сердца направляется в легочную артерию, из левого предсердия —
непосредственно к органам тела.
У рептилий (ящериц, змей)
практически заканчивается процесс дифференциации сердца на правую и
левую половины. Предсердия у рептилий (за исключением крокодилов) разделены
полностью, а в перегородке между желудочками существует отверстие. Даже при
этих условиях потоки насыщенной и бедной кислородом крови хорошо отделяются
друг от друга и перемешивания крови в обычных условиях существования почти не
бывает. В соответствии с этим возникает практически полное разделение
кровообращения на большой и малый круги.
У млекопитающих большой круг
кровообращения начинается от левого
желудочка сердца аортой, которая ветвится на многочисленные артерии, дающие
начало регионарным сосудистым сетям. По мере ветвления число артерий
возрастает, диаметр их уменьшается. Эти артерии снабжают кровью каждый
отдельный орган (кожу, мышцы, печень, сердце, легкие, мозг и т. д.). В
толще органов мельчайшие артерии (артериолы)
формируют густое сплетение мелких сосудов с тонкими стенками — капиллярную
сеть. Именно здесь происходит обмен веществами вены между клетками и кровью. Общая площадь
поверхности всех капилляров организма достигает у человека 1000 м2.
Сливаясь между собой, капилляры образуют венулы. Процесс слияния
заканчивается двумя большими венами — краниальной и каудальной полыми
венами, впадающими в правое предсердие. Таково общее правило. Исключением
являются кишка и селезенка; сосуды, несущие от них венозную кровь,
разветвляются в печени еще на одну систему капилляров (портальное
кровообращение), после чего кровь по печеночным венам попадает в каудальную
полую вену (рис. 9.29).
|
|
|
Рис.
9.29 Кровообращение млекопитающего . В процентах указано относительное содержание крови в различных
участках сердечнососудистой системы. |
Малый
круг кровообращения начинается от правого желудочка легочной артерией,
которая, разветвляясь, переходит в сосудистые сети легких и заканчивается
легочными венами, впадающими в левое предсердие. В итоге оба круга
кровообращения замыкаются. Легочная артерия — единственная в организме
артерия, по которой из правого желудочка в
легкие течет венозная кровь, а легочная вена —
единственная вена, по которой из легких в левое предсердие течет обогащенная
кислородом артериальная кровь.
Помимо большого и малого круга кровообращения в
организме существует система лимфатических сосудов (см. разд. 9.10). Эта
система осуществляет резорбцию межклеточной жидкости и белка из тканей,
образование лимфы и отведение ее в венозную систему. В органах наряду с
кровеносными капиллярами существуют сети лимфатических капилляров, из которых
начинаются лимфатические сосуды. Из сплетений мелких лимфатических сосудов
формируются более крупные. Они отводят лимфу из органов к регионарным
лимфатическим узлам. Пройдя через узлы, лимфа поступает в лимфатические стволы,
а затем в грудной проток и правый лимфатический проток, впадающие в вены.
В процессе эволюции выделение лимфатической
системы в самостоятельную происходит у рыб. У них она представлена
лимфатическими мешками и сложноразветвленными трубками, периферические концы
которых замкнуты, центральные — впадают в вены.
На всех более высоких ступенях эволюции — у птиц и
млекопитающих — существует четырехкамерное сердце с полным отделением
правой половины от левой и полным обособлением большого и малого кругов
кровообращения (см. разд. 9.1). Различия между кровообращением птиц и
млекопитающих касаются главным образом анатомии. У птиц, например, сохранилась
правая дуга аорты, у млекопитающих — левая. Функциональным различием является
то, что птицы, как и другие позвоночные, сохранили воротную систему почек (т.
е. почки получают венозную кровь от задней половины тела). У млекопитающих
почечная воротная система отсутствует.
9.5.2. Функциональные типы
сосудов.
Сосуды, составляющие большой
и малый круг кровообращения (табл. 9.1), подразделяют на несколько типов:
амортизирующие, резистивные, сосуды—сфинктеры, обменные, емкостные,
шунтирующие.
К амортизирующим сосудам
относят аорту, легочную артерию и прилежащие к ним участки крупных сосудов. В
их средней оболочке преобладают эластические элементы. Благодаря такому
приспособлению сглаживаются возникающие во время регулярных систол подъемы
артериального давления.
Резистивные сосуды — концевые артерии и артериолы
— характеризуются толстыми гладкомышечными стенками, способными при
сокращении изменять величину просвета, что является основным механизмом
регуляции кровоснабжения различных органов.
Сосуды—сфинктеры являются последними
участками прекапиллярных артериол. Они, как и резистивные сосуды, также способны
изменять свой внутренний диаметр, определяя тем самым число функционирующих
капилляров и, соответственно, величину обменной поверхности.
К обменным
сосудам относят капилляры, в которых происходит обмен различных веществ и
газов между кровью и тканевой жидкостью. Стенки капилляров состоят из одного
слоя эпителия и звездчатых клеток. Способность к сокращению у
капилляров отсутствует: величина их просвета зависит
от давления
в резистивных сосудах.
Емкостное
звено
сердечно—сосудистой системы составляют посткапиллярные венулы, вены и крупные
вены. Вены по строению сходны с артериями, но их средняя оболочка значительно
тоньше. Они имеют также клапаны, препятствующие обратному току венозной
крови. Вены могут вмещать и выбрасывать большие количества крови, способствуя
тем самым ее перераспределению в организме. Наиболее емкими являются вены
печени, брюшной полости, подсосочкового сплетения кожи.
Таблица 9.1
Сравнение структуры и функций артерий, капилляров и вен
|
Артерии |
Капилляры
|
Вены |
|
Несут кровь от сердца |
Соединяют артерии с
венами. Служат местом обмена веществами между кровью и тканями |
Несут кровь к сердцу |
|
Средний слой стенки толстый,
состоит из эластических и мышечных волокон |
Средний слой отсутствует.
Стенки состоят только из эндотелия и не содержат |
Средний слой относительно
тонкий и содержит мало мышечных элементов. Эластические волокна
немногочисленны |
|
Полулунные клапаны
отсутствуют |
Полулунные клапаны
отсутствуют |
По всей длине имеются
полулунные клапаны, препятствующие обратному току крови |
|
Давление крови высокое и
пульсирующее |
Давление крови
понижающееся, непульсирующее |
Давление крови низкое,
непульсирующее |
|
Кровь течет быстро |
Течение крови замедляется |
Кровь течет медленно |
|
Кровь оксигенированная,
за исключением легочных артерий |
Смешанная
оксигенированная и дезоксигенированная кровь |
Кровь
дезоксигенированная, за исключением легочных вен |
Шунтирующие
сосуды находятся лишь в некоторых областях тела (койка уха, носа, стопы и
других органов) и представляют анастомозы, связывающие между собой
артериальное русло с венозным (артериолы и венулы), минуя капилляры. При
открытом состоянии этих сосудов кровь устремляется в венозное русло, резко
уменьшая или полностью прекращая кровоток в капиллярах. Шунтирующие сосуды
выполняют функцию регуляции регионарного периферического кровотока. Они
участвуют в терморегуляции, регуляции давления крови, ее распределении.
Сосуды разных областей тела млекопитающих отличаются
друг от друга по уровню спонтанной ритмической активности их гладкой
мускулатуры. Например, у крыс сосуды составляют следующий ряд по убыванию
спонтанной ритмической активности: воротная вена → пупочная
артерия → аорта →мозговые сосуды.
9.5.3. Основные законы гемодинамики
Гемодинамика — раздел физиологии кровообращения, использующий законы гидродинамики
(физические явления движения жидкости в замкнутых сосудах) для исследования
причин, условий и механизмов движения крови в сердечно—сосудистой системе.
Гемодинамика определяется двумя силами: давлением, которое оказывает
влияние на жидкость, и сопротивлением, которое она испытывает при трении
о стенки сосудов и вихревых движениях.
Силой, создающей давление в сосудистой системе,
является сердце. У человека среднего возраста при каждом сокращении сердца в
сосудистую систему выталкивается 60—70 мл крови (систолический объем)
или 4—5 л/мин (минутный объем). Движущей силой крови служат разность
давлений, возникающая в начале и конце трубки.
Почти во всех отделах сосудистой системы кровоток
носит ламинарный характер — кровь движется отдельными слоями параллельно
оси сосуда. При этом слой, прилежащий к стенке сосуда, остается практически неподвижным,
по этому слою скользит второй, а по нему, в свою очередь, третий и т. д.
Форменные элементы крови составляют центральный, осевой поток, плазма движется
ближе к стенке сосуда. Следовательно, чем меньше диаметр сосуда, тем ближе
располагаются центральные слои к стенке и больше тормозится скорость их
движения из—за вязкого взаимодействия со стенкой. В целом это означает, что в
мелких сосудах скорость кровотока ниже, чем в крупных. В правильности этого
положения легко убедиться, сопоставив скорости кровотока в разных участках
сосудистого русла. В аорте она составляет 50—70 см/с, в артериях — от 40 до 10,
артериолах — 10—0,1, капиллярах — меньше 0.1, венулах — меньше 0,3, венах — 0,3—5,0,
полой вене — 5—20 см/с.
Наряду с ламинарным в сосудистой системе существует турбулентное
движение с характерным завихрением крови. Частицы крови перемещаются не
только , параллельно оси сосуда, как при ламинарном кровотоке, но и
перпендикулярно ей. Результатом такого сложного перемещения является
значительное увеличение внутреннего трения жидкости. В этом случае объемная
скорость тока крови будет уже не пропорциональной градиенту давления, а
примерно равной квадратному корню из него. Турбулентное движение обычно
возникает в местах разветвлений и сужений артерий, в участках крутых изгибов
сосудов.
Кровь представляет собой взвесь форменных элементов в
коллоидно—солевом растворе, она обладает определенной вязкостью, не
являющейся величиной постоянной. При протекании крови через капилляр, диаметр
которого меньше 1 мм, вязкость уменьшается. Последующее уменьшение диаметра
капилляра еще более уменьшает вязкость протекающей крови. Этот гемодинамический
парадокс объясняется тем, что во время движения крови эритроциты
сосредоточиваются в центре потока. Пристеночный же слой состоит из чистой
плазмы с гораздо меньшей вязкостью, по которому легко скользят форменные
элементы. В итоге улучшаются условия тока крови и происходит снижение перепадов
давления, что, в общем, компенсирует увеличение вязкости крови и снижение
скорости ее тока в мелких артериях. Переход от ламинарного движения крови к
турбулентному сопровождается значительным ростом сопротивления течению крови.
Соотношение между характером течения
жидкости в жестких трубках и давлением обычно определяют по формуле
Пуазейля. Используя эту формулу, можно вычислить сопротивление R току крови в зависимости от ее вязкости ή, длины
l и
радиуса r сосуда:
R=8lή/πr2
Сосудистую систему в целом можно представить в виде
последовательно и параллельно соединенных трубок разной длины и диаметра. В
случае последовательного соединения общее сопротивление составляет сумму
сопротивлений отдельных сосудов: R = R1+ R2
+ … + Rn.При параллельном соединении величину
сопротивления вычисляют по другой формуле: 1/R = 1/R1 + 1/R2 + ... + + 1/Rn. Учитывая
сложность геометрии сосудов целого организма, ее непостоянство, зависящее от
открытия и закрытия шунтов, коллатералей, степени сокращения гладких мышц,
эластичности стенок, изменения вязкости крови и других причин, в реальных
условиях рассчитать величину сосудистого сопротивления трудно. Поэтому его
принято определять как частное от деления кровяного давления Р на
минутный объем крови Q:
R = P/Q.
Для всей сосудистой системы организма в целом эта
формула применима лишь при том условии, если в конце системы, т. е. в полых
венах вблизи места их впадения в сердце, давление будет близким к нулю.
Соответственно при необходимости вычисления сопротивления отдельного участка
сосудистой системы формула приобретает вид
R=Р1—Р2/Q
Значения P1 и P2 отражают давление в начале и конце определяемого
участка.
Основная кинетическая энергия, необходимая для движения крови, сообщается ей
сердцем во время систолы. Одна часть этой энергии расходуется на проталкивание крови,
другая — превращается в потенциальную энергию растягиваемой во время систолы
эластичной стенки аорты, крупных и средних артерий. Их свойства зависят от
наличия эластических и коллагеновых волокон, растяжимость которых примерно в
шесть раз выше, чем, например, резиновых нитей той же толщины. Во время
диастолы энергия стенки аорты и сосудов переходит в кинетическую энергию
движения крови.
Кроме эластичности и растяжимости, т. е. пассивных
свойств, сосуды обладают еще способностью активно реагировать на изменение в
них кровяного давления. При повышении давления гладкие мышцы стенок сокращаются
и диаметр сосуда уменьшается. Таким образом, пульсирующий ток крови,
создаваемый функцией сердца, благодаря особенностям аорты и крупных сосудов
выравнивается и становится относительно непрерывным.
Основными показателями гемодинамики являются объемная скорость, скорость кругооборота
крови, давление в разных областях сосудистой системы.
Объемная скорость движения крови характеризует ее количество (в миллилитрах), протекающее
через поперечное сечение сосуда за единицу времени (1 мин). Объемная скорость
кровотока прямо пропорциональна перепаду давления в начале и конце сосуда и
обратно пропорциональна его сопротивлению току крови. В организме отток крови
от сердца соответствует ее притоку к нему. Это означает, что объем крови,
протекающей за единицу времени через всю артериальную и всю венозную систему
большого и малого круга кровообращения, одинаков.
Линейная скорость движения крови (v)
характеризует скорость перемещения ее частиц вдоль сосуда при ламинарном
потоке. Она выражается в сантиметрах в секунду и определяется как отношение
объемной скорости кровотока Q к площади
поперечного сечения сосуда πr2:
v=Q/πr2
Полученная таким образом величина является сугубо средним
показателем, так как, согласно законам ламинарного движения, скорость
перемещения крови в центре сосуда является максимальной и падает в слоях,
прилежащих к сосудистой стенке.
Линейная скорость кровотока различна и в отдельных
участках сосудистого русла по ходу сосудистого дерева. Она зависит от общей
суммы площади просветов сосудов этого калибра в рассматриваемом участке.
Наименьшим поперечным сечением характеризуется аорта, в связи с чем и скорость
движения крови в ней самая большая — 50—70 см/с. Наибольшей суммарной площадью
поперечного сечения обладают капилляры, у млекопитающих она приблизительно в
600—800 раз больше площади поперечного сечения аорты. Соответственно и скорость
крови здесь около 0,05 см/с. В артериях она составляет 20—40 см/с, в артериолах
— 0,5 см/с. В силу того, что при слиянии вен их суммарный просвет уменьшается,
линейная скорость кровотока снова возрастает, достигая в полой вене 20 см/с
(рис. 9.30).
Кровь выталкивается отдельными порциями, поэтому
кровоток в аорте и артериях пульсирует. При этом его линейная скорость
возрастает в фазе систолы и снижается во время диастолы. В капиллярной сети в
силу особенностей строения предшествующих ей артерий пульсовые толчки исчезают
и линейная скорость кровотока приобретает постоянный характер.
|
|
|
Рис. 9.30 Соотношение
объемной и линейной скоростей кровотока в разных отделах сосудистого русла А —
линейная скорость кровотока по ходу сосудистого русла; Б — различные по высоте, но равные по
объему цилиндры, изображающие суммарную объемную скорость кровотока; В — суммарный просвет сосудов: 1 — артерии, 2 — капилляры, 3 — вены
(капиллярный просвет должен превышать просвет аорты в 600—800 раз); hi,
h2, h3 — высота цилиндра (длина отрезка сосуда); SI, S2, S3 —
суммарный просвет сосудов в разных отделах русла. |
Скорость кругооборота крови отражает время, за которое частица крови проходит
большой и малый круг кровообращения. Для определения скорости кругооборота обычно
используют введение радиоактивной метки с последующим контролем ее появления в
соответствующей области. У различных насекомых время кругооборота равно 20—30
мин, у крабов — 37—65 с, у кролика — 7 с, у собаки — 16 с. У человека
минимальное время полного кругооборота составляет 20—23 с. При этом на
прохождение малого круга кровообращения приходится около 1/5 времени, а на
прохождение большого — нередко 4/5.
9.5.4. Давление в артериальном русле
Основной функцией артерий является создание постоянного напора, под которым
кровь движется по капиллярам. Обычно объем крови, заполняющий всю артериальную
систему, составляет примерно 10—15% от общего объема циркулирующей в организме
крови.
Уровень кровяного давления (обычно выражаемый в миллиметрах ртутного столба)
определяется совокупностью ряда таких факторов, как нагнетающая сила сердца,
периферическое сопротивление сосудов, объем крови. Однако главным из них
является работа сердца.
Нагнетающая сила сердца. При каждой систоле и диастоле кровяное давление в
артериях колеблется. Его подъем вследствие систолы желудочков характеризует систолическое
(максимальное), давление. Систолическое давление, в свою очередь,
подразделяется на боковое и конечное. Боковое давление представляет собой
давление крови, передаваемое на стенки сосудов. Конечное давление
является суммой потенциальной и кинетической энергии, которой обладает масса
крови, движущейся на определенном участке сосудистого русла. Оно на 10—20 мм
рт. ст. выше бокового.
Разность между боковым и конечным систолическим
давлениями называется ударным давлением. Его величина отражает
деятельность сердца и состояние стенок сосудов. У человека в возрасте 16—45 лет
систолическое давление в аорте составляет 110—125 мм рт. ст. В концевых разветвлениях
артерий и артериолах оно уменьшается до 20—30 мм рт. ст., что связано с высоким
гидродинамическим сопротивлением этих сосудов.
Спад давления во время диастолы соответствует диастолическому
(минимальному) давлению. Его величина зависит главным образом от
периферического сопротивления кровотоку и частоты сердечных сокращений.
Разность между систолическим и диастолическим
давлением, т. е. амплитуду колебаний, называют пульсовым давлением.
Пульсовое давление пропорционально объему крови, выбрасываемой сердцем при
каждой систоле. В мелких артериях пульсовое давление снижается, а в артериолах
и капиллярах оно постоянно.
Эти три величины — систолическое, диастолическое и
пульсовое давление крови — служат важными показателями функционального
состояния всей сердечно—сосудистой системы и деятельности сердца в определенный
период. Они являются видовыми и у здоровых особей одного вида поддерживаются на
постоянном уровне.
Как известно, в любой замкнутой системе трубок с
нагнетающим устройством типа насоса наибольшее давление возникает в прилежащей
к насосу области. По мере продвижения по трубкам давление расходуется на
преодоление сопротивления. Если рассматривать кровяное русло высших позвоночных
как систему замкнутых трубок, то из этого следует, что давление крови,
Таблица 9.2
Средние показатели систолического и диастолического давления у отдельных видов животных
|
|
|
Давление, мм рт. ст. |
|
Личинка стрекозы |
Брюшной гемоцель |
33 |
|
Сом |
Брюшная аорта |
40/30* |
|
Лягушка |
Тоже |
22/11 |
|
Курица |
Сонная артерия |
150/40 |
|
Морская свинка |
Тоже |
77/47 |
|
Мышь |
Тоже |
113/81 |
|
Крыса |
Тоже |
130/90 |
|
Кролик |
Тоже |
110/80 |
|
Собака |
Бедренная артерия |
150/90 |
|
Лошадь |
Запястная
артерия |
172/123 |
|
Свинья |
Тоже |
139/99 |
|
Овца |
Бедренная артерия |
151/114 |
|
Макака—резус |
Лучевая артерия |
160/130 |
Числитель означает систолическое давление, знаменатель —
диастолическое.
обусловленное работой сердца, по мере удаления от сердца
будет падать. Следовательно, чем больше будут разветвляться сосуды, тем сильнее
будет падение давления. Наиболее значительно падение давления в артериолах и
капиллярах.
В результате этого кровь в венах течет под низким
давлением, которое, в свою очередь, постепенно понижается по направлению к
правому предсердию.
К плечевой артерии здорового человека в возрасте
20—40 лет систолическое давление составляет 110—120 мм рт. ст., диастолическое
— 70—80 мм рт. ст., пульсовое — 40 мм рт. ст. В мелких сосудах большого круга
кровообращения разность между этими уровнями, т. е. пульсовое давление,
значительно меньше. Давление в легочной артерии малого круга кровообращения
равно соответственно 25 и 10 мм рт. ст. Показатели артериального давления у
некоторых видов животных приведены в табл. 9.2.
У самцов млекопитающих и птиц артериальное давление
выше, чем у самок; в условиях покоя у крупных животных оно выше, чем у мелких.
Артериальное давление претерпевает суточные колебания. У человека они не
превышают ±10 мм рт. ст.
У гомойотермных животных, а также у лягушки,
аллигатора, черепахи повышение температуры тела приводит к повышению кровяного
давления. В организме пойкилотермных животных кровь циркулирует медленнее, чем
у гомойотермных, и артериальное давление у них ниже. У рыб давление тесно
коррелирует с частотой сердечных сокращений.
Повышение артериального давления по сравнению с
определенными для данного организма величинами называют артериальной
гипертензией, снижение — артериальной гипотензией.
Помимо систолического, диастолического и пульсового
артериального давления существует так называемое среднее артериальное
давление. Оно представляет собой как бы равнодействующую колебаний
артериального давления в разные фазы сердечного цикла, т. е. среднюю величину
давления, но без пульсовых колебаний, хотя и с таким же гемодинамическим
эффектом.
Периферическое сопротивление сосудистого русла
большого круга кровообращения.
Периферическое сопротивление — это второй фактор, определяющий артериальное давление.
Сопротивление зависит в основном от диаметра прекапиллярных сосудов — мелких
артерий и артериол, вследствие чего их называют сосудами сопротивления,
или резистивными сосудами. Артериолы имеют толстые гладкомышечные стенки
и способны легко изменять свой просвет. Уменьшение просвета приводит к задержке
крови в артериях и, соответственно, к повышению систолического и
диастолического давления, ухудшению местного кровообращения питаемой сосудом
области. При расширении просвета артериол направленность реакции
противоположна.
Количество циркулирующей в сосудах крови и ее
вязкость. Это третий и четвертый
факторы, от которых зависит уровень артериального давления. Обильные
кровопотери приводят к снижению кровяного давления, напротив, переливание
больших количеств крови повышает артериальное давление.
Артериальное давление зависит и от притока венозной
крови к сердцу, например при мышечной работе. Это происходит потому, что,
согласно закону Франка—Старлинга (см. разд. 9.2.3), приток крови в сердце
усиливает систолическое сокращение и, следовательно, увеличивает ее отток в
сосуды.
Определение величины кровяного давления. Кровяное давление определяют двумя способами: прямым
(кровавым) путем, применяемым в эксперименте на животных, и косвенным
(бескровным), используемым для измерения давления у человека.
Впервые измерение артериального давления прямым
путем было произведено в 1733 г. Стефаном Хейлсом у лошади. Для этого на
одну из крупных артерий был наложен зажим и в сосуд по направлению к сердцу
введена трубка. Эта трубка соединялась с другой трубкой, поставленной
вертикально (прообраз манометра). Когда зажим снимали, кровь устремлялась в
вертикальную трубку и поднималась до уровня, соответствующего артериальному
давлению. Примененный Хейлсом принцип соединения сосуда с манометром остался
неизменным до сих пор, усовершенствованию подвергались лишь регистрирующие
приборы.
Косвенным путем кровяное давление определяют при помощи аппарата (сфигмоманометра) Рива—Роччи.
Для этого вокруг руки человека или конечности животного укрепляют полую
резиновую манжету, соединенную трубкой с ртутным или пружинным манометром и
резиновым баллоном для нагнетания воздуха. Накачивание в манжету воздуха
создает в ней давление, которое сжимает артерию. Момент, когда сосуд перестает
пропускать кровь, устанавливают по прекращению пульса в периферическом от
манжеты конце артерии. Затем медленно выпускают воздух из манжеты до появления
пульса. Величину давления в манжете в этот момент регистрируют с помощью
манометра.
В 1905 г. Н. С. Коротков предложил определять
давление путем прослушивания звуков в артерии ниже манжеты. В обычных условиях,
когда кровь течет по артерии непрерывно, колебания, создаваемые пульсирующим
током крови, не слышны. В момент зажатия артерии манжетой в сосуде возникают турбулентность
и завихрения, создающие характерный звук, прослушиваемый через фонендоскоп.
Появление тона Короткова характеризует прохождение кровью
|
|
|
Рис. 9.31 Артериальное давление А — регистрация в остром
опыте; В — кривая кровяного
давления (схема); В — кривые кровяного
давления: / — волны первого порядка (пульсовые), II — волны второго порядка (дыхательные), III — волны третьего порядка; 1 — датчик, 2 — электронный измеритель
давления, 3 — регистрирующее устройство, 4 — канюля, б —
сосуд. |
сдавленного участка сосуда и соответствует систолическому
давлению. Исчезновение звука совпадает с диастолическим давлением.
На кривой кровяного давления отчетливо видны три вида
волн (рис. 9.31). Волны первого порядка протекают параллельно с ритмом
сердцебиений. При каждой систоле кровяное давление увеличивается, что
записывается на кривой в виде зубца. При каждой диастоле давление уменьшается.
Число зубцов соответствует числу систол. Если записывать одновременно артериальное
давление и дыхание, то можно заметить, что волны первого порядка дополнительно
изменяют свой уровень. В большом круге кровообращения артериальное давление
снижается при вдохе и повышается при выдохе. Эти колебания, связанные с
дыхательными движениями, называются волнами второго порядка. Их
появление связано с присасывающим действием грудной клетки и изменением
внутригрудного давления. В малом круге кровообращения также происходят
гемодинамические изменения. Во время вдоха приток крови в нем возрастает, во
время выдоха — снижается.
Помимо этих двух видов волн на кривой наблюдаются
выраженные с различной интенсивностью редкие повышения и западения давления, не
связанные ни с сердечной, ни с дыхательной деятельностью. Эти колебания,
обозначаемые как волны третьего порядка (волны Траубе—Геринга),
совершаются в редком (6—9 в 1 мин) ритме. Чаще всего они возникают при
недостаточном снабжении мозга кислородом, кровопотерях, отравлениях ядами. Своим
происхождением они обязаны медленным процессам изменения тонуса
сосудодвигательного центра. Этот тонус ритмически ослабевает и усиливается,
вызывая соответственно понижение и повышение сопротивления артериального русла,
что, в свою очередь, обусловливает понижение и повышение кровяного давления. В
том случае, когда все три вида волн отчетливо выражены, кривая кровяного
давления принимает вид, показанный на рис. 9.31.
Под пульсом понимают периодические колебания
объема сосудов, связанные с динамикой их кровенаполнения и давления в них в
течение одного сердечного цикла.
Систолический объем крови, выбрасываемый в аорту,
вызывает ее растяжение и повышение в ней давления. В результате того, что
стенки аорты и артерий обладают эластичностью, систолический прирост давления
не продвигает весь столб крови (как происходило бы, если бы артериальная
система состояла из жестких, неэластичных трубок), а вызывает растяжение стенок
артерий. Благодаря такому растяжению аорта и артериальные стволы вмещают в себя
выбрасываемый сердцем систолический объем крови.
Стенки сосудов, получившие во время систолы
добавочное напряжение, стремятся в силу упругости уменьшить свою емкость и во
время диастолы продвигают вперед систолический объем крови. Расширение стенки и
повышение давления происходит теперь на прилежащем участке. Колебания давления,
волнообразно повторяясь и постепенно ослабевая, захватывают все новые и новые
участки (рис. 9.32) артерий, пока не достигают артериол и капилляров, где
пульсовая волна гаснет.
Соответственно пульсирующим изменениям давления
пульсирующий характер приобретает и продвижение крови по артериям: ускорение
кровотока во время систолы и замедление во время диастолы.
Амплитуда колебания пульсовой волны, или волны
повышения давления, затухает по мере продвижения от центра к периферии.
Линейная скорость кровотока также снижается в результате увеличения сечения
русла. Скорость распространения пульсовой волны в аорте человека составляет 5,5—8
м/с, в крупных артериях — 6—9,5 м/с. Она не зависит от линейной скорости
продвижения крови, которая в крупных артериях не превышает 0,5 м/с. На скорость
распространения пульсовой волны почти не оказывает влияния сопротивление
кровотоку, возникающее, например, в результате сокращения мышечной стенки
сосудов.
Пульс можно исследовать или непосредственным
прощупыванием через кожу пульсирующей артерии, или путем регистрации кривой
пульсового давления с помощью предложенного Ж. Мареем (1832) прибора — сфигмографа.
На сфигмограмме аорты и крупных артерий различают начальный резкий подъем
кривой — анакроту (рис. 9.33). Он связан с открытием полулунных
клапанов, когда кровь с силой выталкивается в аорту и растягивает ее стенки.
Далее следует более отлогий спад пульсовой кривой — катакрота. Он
возникает
|
|
|
Рис. 9.32 Механизм
возникновения артериального пульса А— функция
«компенсаторной камеры» и механизм распространения пульсовой волны: 1 — растяжение ближайшего к сердцу
участка аорты, 2 — растяжение
следующего участка и заполнение его кровью, 3 — повторение этого процесса и
распространение крови вдоль эластических артерий; Б — изображение того, каким образом артерии, расположенные
вблизи сердца, способствуют непрерывному току крови, несмотря на перерывы в
поступлении крови из желудочков сердца: 4 — желудочек сокращается, клапан открыт, 5 — желудочек
расслабляется, клапан закрыт, происходит упругое сжатие растянутого сосуда. |
|
|
|
Рис. 9.33 А — регистрация пульса на
сонной артерии: 1 —
онкометрический (для определения кровенаполнения) датчик, 2 — сфигмограф, 3 — регистрирующее
устройство; В — артериальный
пульс (сфигмограмма) сонной артерии: а—б—в
(анакрота) — повышение давления во время систолы , в—г — снижение давления в
конце систолы, д —
захлопывание полулунных клапанов, е—ж—з
(катакрота) — снижение давления во время диастолы; В — сфигмограммы сонной (7), лучевой (2), пальцевой (3) артерий, записанные синхронно; Г — венный пульс (флебограмма):
отражение систолы предсердий (а), систолы желудочков (с), конца диастолы
предсердий (и). |
в конце систолы желудочка, когда давление в нем начинает
падать. Нисходящее колено кривой имеет выемку и добавочную волну — вторичный,
или дикротический, подъем. По времени их появление совпадает с моментом
закрытия полулунных клапанов и возникновения обратной волны тока крови. В
периферических артериях анакротическое колено кривой более плавное,
дикротический подъем выражен меньше.
Количество крови, протекающей через определенный
участок артерии в течение каждого пульсового периода, называют пульсовым
объемом. Его величина зависит от сечения артерии, степени раскрытия ее
просвета, систолического объема, скорости кровотока.
Пульсирующий характер кровотока имеет существенное
значение для регуляции кровообращения в целом. Частота и амплитуда колебаний
давления оказывают влияние на тонус сосудов. Это влияние осуществляется либо
путем прямого механического воздействия на гладкую мышцу сосудистой стенки либо
путем активации барорецепторов сосудистых рефлексогенных зон.
Кровеносные капилляры являются самыми тонкими и
многочисленными сосудами. Они располагаются в межклеточных пространствах.
Просвет капилляров варьирует от 4,5 до 30 мкм и более, что обусловлено
органными особенностями строения сосудистой системы. Общее число капилляров в
различных тканях не одинаково. В органах с высоким уровнем метаболизма число
капилляров на 1 мм поперечного сечения больше, чем в органах с менее
интенсивным обменом. Например, сердечная мышца содержит вдвое больше
капилляров, чем скелетная, в сером веществе головного мозга капиллярная сеть
значительно гуще, чем в белом. Длина отдельного капилляра колеблется от 0,5 до
1,1 мм.
Количество всех капилляров организма чрезвычайно
велико. Например, у человека оно составляет около 40 млрд., общая длина
капилляров достигает 100 000 км. Этой величины достаточно, чтобы два с
половиной раза опоясать земной шар по экватору. Также велика и общая площадь их
поверхности; она составляет примерно 1500 м2.
В местах отхождения капилляров от артериол
гладкомышечные клетки образуют прекапиллярные сфинктеры. От степени их
сокращения зависит какая
|
|
|
Рис. 9.34 Показатели
гемодинамики в различных отделах сосудистого русла А —
распределение крови, Б —
уровень кровяного давления, суммарный просвет сосудов и линейная скорость
кровотока. а — сердце, б, в — резистивные сосуды (б — артерии, в — артериолы), г — капилляры, д, е — емкостные сосуды (д — венулы, е — вены). |
часть крови будете проходить через капилляры. В
остальных участках капилляров сократительные элементы полностью отсутствуют. Стенка
капилляров представляет собой полупроницаемую мембрану, тесно связанную
функционально и морфологически с окружающей соединительной тканью. Она состоит
из двух оболочек: внутренней — эндотелиальной, наружной — базальной. Различают три
типа капилляров: соматический, висцеральный и синусоидный.
Стенка капилляров соматического типа
характеризуется непрерывностью эндотелиальной и базальной оболочек. Она
малопроницаема для крупных молекул белка, но легко пропускает воду и
растворенные в ней минеральные вещества. Капилляры такого рода располагаются
преимущественно в коже, скелетной и гладкой мускулатуре, в головном мозгу, что
соответствует характеру метаболических процессов этих органов и тканей.
В стенках капилляров висцерального типа
имеются окна (фенестры). Такие капилляры характерны для органов, которые
секретируют и всасывают большие количества воды и растворенных в ней веществ
или участвуют в быстром транспорте макромолекул (почки, пищеварительный канал,
эндокринные железы).
У капилляров синусоидного типа,
характеризующихся большим просветом, эндотелиальная оболочка прерывиста,
базальная мембрана частично отсутствует. Местом локализации таких капилляров
являются костный мозг, печень, селезенка. Через их стенки легко проникают
макромолекулы и форменные элементы крови.
Функция капилляров заключается в снабжении клеток питательными и пластическими веществами
и удалении продуктов метаболизма, т. е. в обеспечении транскапиллярного обмена.
Для осуществления этих процессов необходим ряд условий, важнейшими из которых
являются скорость кровотока в капилляре, величина гидростатического и
онкотического давления, проницаемость стенки капилляра, число перфузируемых
капилляров на единицу массы ткани.
Кровяное давление в капиллярах зависит от сопротивления в разветвляющемся артериальном
русле (рис. 9.34). Оно продолжает падать и на протяжении самих капилляров.
Например, в артериальной части капилляра кожи кровяное давление составляет в
среднем 30 мм рт. ст., а в венулярном — 10. Средняя линейная скорость
капиллярного кровотока у млекопитающих достигает 0,5—1 мм/с. Следовательно,
время контакта каждого эритроцита со стенкой капилляра длиной 100 мкм не
превышает 0,15 с. Интенсивность эритроцитарного потока
|
|
|
Рис.
9.35 Обмен веществ в пределах
микроциркуляторного русла 1 — ткани,
2 — артерио—венозный
анастомоз, 3 — венула, 4 —
артериола, 5 — капилляры; цифрами показано изменение соотношений
гидростатического (числитель) и онкотического (знаменатель) давлений (мм рт.
ст.). |
|
|
|
Рис. 9.36 Тургорный
механизм расширения капилляров А—
эндотелий капилляра в расслабленной мышце; Б— эндотелий капилляра в
сокращенной мышце .1— продукты метаболизма, 2 — эндотелий капилляров, 3—просвет капилляров, 4 — межклеточное мышечные волокна. |
в капиллярах колеблется от 12 до 25 и более клеток в
1 с. Таким образом, каждая клетка крови находится в капилляре около 1 с.
Скорость капиллярного кровотока зависит от просвета сосуда, области тела и
реологических свойств крови.
Движение жидкости через капиллярную стенку происходит
в результате разности гидростатического давления крови и гидростатического
давления окружающей ткани (рис. 9.35, 9.36), а также под действием разности
онкотического давления крови и межклеточной жидкости. Процесс фильтрации
из капилляров в межклеточную жидкость осуществляется под давлением 7 мм рт.
ст., а обратный ток в просвет капилляра — 8 мм рт. ст.
В нормальных условиях скорость фильтрации жидкости
практически равна скорости ее реабсорбции. Только небольшая часть межклеточной
жидкости поступает, минуя кровеносные капилляры, в лимфатические капилляры и
оттуда в виде лимфы снова возвращается в кровяное русло. Средняя скорость
фильтрации во всех капиллярах организма человека составляет примерно 14 мл/мин,
т. е. 20 л/сут. Обратный процесс, или реабсорбция, составляет около 12,5
мл/мин, или 18 л/сут; по лимфатическим сосудам оттекает 2 л/сут.
Изменение любого параметра равновесия приводит к
изменению остальных параметров. Например, увеличение капиллярного гидростатического
давления сопровождается усилением фильтрации воды из капилляра, в результате в
тканевых пространствах повышается гидростатическое и снижается онкотическое
давление. Одновременно с этим возрастает онкотическое давление белков плазмы
крови, вызывающее, в свою очередь, усиление абсорбции в венозном конце
капилляра. Следовательно, усиление фильтрации сопровождается соответствующим
повышением абсорбции жидкости в капилляре.
Процессу фильтрации через стенку
капилляра способствует и поршневой механизм прохождения через капилляр
эритроцита. Вследствие закупорки артериального конца капилляра возникает
небольшое снижение давления в его
|
|
|
Рис. 9.37 Возможные
пути перехода крови из артериолы в венулу |
венозной части. После прохождения эритроцита давление
в этом отрезке восстанавливается. Эритроцит при этом играет роль поршня.
Процессу фильтрации также способствует конвекция межклеточной жидкости.
По ходу капилляров и окружающей их соединительной
ткани находятся чувствительные нервные окончания. Значительное место среди них
занимают хеморецепторы, сигнализирующие о состоянии метаболических
процессов. Эффекторные нервные окончания непосредственно у стенок капилляров в
большинстве органов не обнаруживаются.
Регуляция капиллярного кровотока осуществляется
нервными и гуморальными механизмами, которые обеспечивают оптимальный кровоток
в этих сосудах для транскапиллярного обмена между кровью и тканями. Различают три
уровня регуляции капиллярного кровотока: общесистемную регуляцию, местную
(в пределах органа) и саморегуляцию (в пределах капиллярной единицы).
Основным механизмом нервной регуляции капилляров является их эфферентная иннервация бессинаптического
типа. Она осуществляется благодаря свободной диффузии медиаторов по направлению
к стенкам капилляров. Ведущая роль в местной регуляции капиллярного кровотока
принадлежит физиологически активным веществам. В частности, гистамин и кинины
— одни из самых активных вазодилататоров; серотонин, ангиотензин II —
констрикторы некоторых сосудов. Вазоактивным действием обладают гормон задней
доли гипофиза (нейрогипофиза) — вазопрессин, а также простагландины.
Капилляры могут образовать либо прямой кратчайший
путь между артериолами и венулами, либо формировать капиллярные сети (рис.
9.37). В таком случае капилляры отходят от артериального конца магистрального
сосуда и впадают в него в его венозной части. Такая анатомическая архитектура
имеет важное значение в распределении крови в капиллярных сетях.
Для терминального артериального русла характерно
также наличие сосудов, несущих артериальную и венозную кровь в обход
капиллярного русла — артериоло—венулярные (артерио—венозные) анастомозы
(рис. 9.37, 9.38). Они существуют почти во всех органах и влияют на скорость и
объем кровотока в капиллярах. Артериоло—венулярные анастомозы участвуют в
терморегуляции, регуляции тока крови через орган, стимуляции венозного
кровотока.
|
|
|
|
Рис. 9.38 Капилляры мышцы: строение микроциркуляторного
русла АВА — артерио—венозный
анастомоз. |
|
|
|
|
|
Рис. 9.39 Скорость
кровотока и величина давления в разных областях кровяного русла А —
линейная скорость кровотока в сосудах каждого отдела кровяного русла обратно
пропорциональна площади поверхности поперечного сечения этого отдела.
наиболее высока эта скорость в магистральных артериях и венах и наиболее
низка — в капиллярах; напротив, суммарная площадь поверхностей поперечного
сечения наибольшая для капилляров и наименьшая — Для крупных артерий и вен. Б — среднее давление в различных
отделах кровеносной системы. Наибольшее падение давления происходит в области
артериол. |
|
Венозная система начинается посткапиллярными
венулами в сосудах микроциркуляторного русла и представляет собой отводящее
кровь звено (рис. 9.39). Вены являются емкостными сосудами обладающими самой
большой растяжимостью и относительно низкой эластичностью. Внутренняя
поверхность большинства вен, за исключением мелких венул, вен воротной системы
и полых вен, снабжена клапанами, представляющими собой тонкие складки
внутренней оболочки. Их основу составляет волокнистая соединительная ткань.
Клапаны способствуют току крови к сердцу и препятствуют ее обратному движению.
Одновременно они предохраняют сердце от излишней затраты энергии на преодоление
колебательных движений крови, постоянно возникающих в венах под влиянием
различных внешних воздействий, таких как атмосферное давление, мышечное сжатие
и др.
Вены вмещают 70—80% крови организма. Они в большой
степени определяют емкость всей системы кровообращения, величину возврата крови
к сердцу, минутный объем кровообращения (табл. 9.3). В основе венозного
возврата лежит ряд механизмов.
Кровь перекачивается из области высокого давления
в область более низкого давления, в начале венозного русла в венулах
большого круга кровообращения оно составляет примерно 15 мм рт. ст., в крупных
венах за пределами грудной полости — 5—6 мм рт. ст., в венах грудной полости и
при впадении их в правое предсердие почти равно атмосферному и зависит от фаз
дыхания. Во время вдоха, когда грудная клетка расширяется, давление в венах
понижается и становится ниже атмосферного, при выдохе повышается обычно на 2—5
мм рт. ст.
Давление в начале венозной системы
обусловлено остатком движущей силы, которая сообщается крови
сокращениями сердца и сохранилась после преодоления сопротивления в артериолах
и капиллярах (остаточная сила сердца).
Большую роль в венозном возврате играет присасывающее
действие грудной клетки. При вдохе расширяются легкие, возникает
отрицательное внутрилегочное давление и одновременно расширяются крупные полые
вены. В результате этого возрастает разность давления между началом венозной
системы и местом впадения полых вен в сердце. Тем самым облегчается приток
венозной крови к сердцу. Воздействие дыхательных движений на венозное
кровообращение называют дыхательным насосом. Движение крови к сердцу
обеспечивается также его присасывающим действием в фазу диастолы.
Определенное влияние на кровоток в венах оказывают сокращения
скелетных мышц, сдавливающие проходящие в них сосуды (рис. 9.40). При
сжатии вен давление в них повышается и благодаря наличию в венах клапанов (рис.
9.41), препятствующих оттоку крови к капиллярам, кровоток становится
однонаправленным в сторону сердца. Это явление получило название мышечного
насоса.
Еще одним фактором, облегчающим приток крови к
сердцу, является присасывающе—сдавливающий насосный эффект, оказываемый
диафрагмой на органы брюшной полости. Во время вдоха диафрагма сокращается,
внутрибрюшное давление увеличивается. Оттесненные диафрагмой органы давят на
стенки вен, выжимая кровь в сторону воротной вены и далее в полую вену.
Повышение градиента давления между брюшными и грудными венами сопровождается
увеличением венозного притока к сердцу. Во время выдоха наблюдается обратная
картина. В движении крови играют роль и перистальтические сокращения стенок
некоторых вен. В венах печени они сокращаются с частотой 2—3 в 1 мин.
На движение крови в венах действует и гидростатический
фактор — тяжесть столба крови, которая давит на стенки всех сосудов,
расположенных при вертикальном положении тела ниже
Таблица 9.3
Объемная скорость кровотока
в органах (мл/мин на 100 г массы)
|
Орган |
Кровоток |
|
Щитовидная железа |
560 |
|
Почки |
420 |
|
Печень |
150 |
|
Сердце (коронарные сосуды) |
85 |
|
Кишка |
50 |
|
Мозг |
65 |
|
Селезенка |
70 |
|
Желудок |
35 |
|
Мышцы рук и ног (в покое) |
2—3 |
|
|
|
Рис. 9.40 Сокращение окружающих вену мышц, способствующее
однонаправленному движению крови к сердцу А — мышцы
расслаблены, клапаны закрыты, Б —
мышцы сокращаются, верхний клапан открывается и кровь выталкивается вверх;
нижний клапан остается закрытым, В — мышцы расслабляются, верхний клапан
закрывается, а нижний открывается вследствие сокращения мышц в
нижнежелудочковых участках, и кровь проходит через него. 1 — верхний клапан, 2 — нижний клапан, 3 — мышца, 4 — движение крови к сердцу, 5 —
вена. |
|
|
|
Рис. 9.41 Действие
клапана в вене А — давление крови, направленное вверх, заставляет
венозный клапан открыться, и кровь течет по направлению к сердцу; Б — обратное движение крови
приводит к закрытию клапанов, поэтому кровь не может течь по направлению от
сердца. |
|
|
|
Рис. 9.42 Влияние гидростатического фактора на
венозное и артериальное давление Горизонтальная
плоскость соответствует уровню постоянного гидростатического давления. |
|
|
|
Рис. 9.43 Венный
пульс а — волна,
обусловленная систолой правого предсердия; с — волна, возникающая вследствие
того, что в период напряжения правого желудочка повышение давления в его
полости передается через закрытые створки предсердно—желудочкового клапана на
кровь, заполняющую правое предсердие и близкие к нему вены; о — волна,
наблюдаемая во второй половине систолы желудочков: она зависит от притока
крови из вен в предсердие; крутое падение от с до х
соответствует падению давления в предсердиях в начале фазы изгнания крови из
желудочков, а от v к y — после раскрытия трехстворчатого клапана. |
сердца (рис. 9.42). Это ведет к скоплению крови в
сосудах и их растяжению. Большому скоплению крови в венах противодействуют, помимо
других факторов, перистальтические сокращения мышц стенок некоторых вен,
например в печени. Если вследствие патологического состояния этого сокращения
не происходит или если оно недостаточно то кровь при вертикальном положении
тела в значительном количестве скапливается в венах конечностей и брюшной
полости (отеки).
В венулах и терминальных венах кровоток, как правило,
имеет постоянный характер. В более крупных сосудах возникают небольшие
колебания давления и скорости кровотока. В венах среднего калибра скорость
кровотока составляет 7—14 см/с, в полых венах она несколько выше — до 20 см/с и
более. Колебания скорости кровотока зависят от фаз дыхания и сердечных
сокращений. На величину венозного и артериального давления определенное влияние
оказывает гидростатический фактор (рис. 9.42).
Венный пульс. Венным пульсом называют колебания давления и объема в венах за время
одного сердечного цикла, связанные с динамикой оттока крови в правое предсердие
в разные фазы систолы и диастолы. Эти колебания передаются ретроградно, и их
можно обнаружить в крупных, близко расположенных к сердцу венах — обычно в
полых и яремных. Скорость распространения пульсовой волны составляет 1—3 м/с.
Пульсацию периферических вен определить практически невозможно.
Происхождение пульсовой волны венного пульса иное,
чем артериального. В то время как причиной артериального пульса является
систолическое ускорение, сообщаемое столбу крови энергией сердечного
сокращения, причиной венного пульса является прекращение оттока крови из вен к
сердцу во время систолы предсердий и желудочков. В этот момент ток крови в
больших венах задерживается и давление в них возрастает.
На кривой венного пульса, или флебограмме,
различают три волны (рис. 9.43). Они расшифровываются следующим образом. Первая
волна (а) возникает во время систолы правого предсердия. В этот момент
отток крови из вен к сердцу прекращается и давление в них возрастает. Когда
предсердие расслабляется и кровь снова начинает поступать в его полость,
давление в вене падает и кривая возвращается к исходному уровню. Однако падение
давления прерывается новой волной (с). По времени она совпадает с пульсом
соседней сонной артерии и отражает колебание ее стенки. Толчок сонной артерии
сообщается вене и вызывает в ней возникновение быстро протекающей волны
повышенного давления. После такого кратковременного подъема давление продолжает
равномерно падать. Это происходит потому, что кровь непрерывно оттекает в
предсердие, находящееся в это время в диастоле. После заполнения предсердий
давление в вене вновь начинает повышаться, происходит застой крови и растяжение
венозной стенки. Все это вызывает возникновение третьей пологой волны (v). После
этого начинается новый сердечный цикл, и в момент систолы предсердий возникает
новая первая волна венного пульса.
О регуляции давления и тока циркулирующих жидкостей у
беспозвоночных известно мало. Большинство из них имеет незамкнутую
циркуляторную систему, в которой давление и скорость тока низки и изменчивы, а объем
гемолимфы велик. В таких системах ток жидкости зачастую больше зависит от
сокращения соматических мышц, чем от деятельности сердца и состояния сосудов.
Это автоматически обеспечивает усиление циркуляции во время активности
животных. Для многих групп беспозвоночных характерно использование давления
внутренней жидкости для поддержания тела и передвижения. Ясно, что перепады
давления, обеспечивающие ток жидкости, при этом имеют лишь второстепенное
значение.
Наибольшего развития среди
беспозвоночных регуляция давления и тока циркулирующих жидкостей достигла у
головоногих моллюсков, обладающих уже замкнутой циркуляторной системой и мощным
сердцем. Несмотря на невероятное разнообразие насекомых, о регуляции их
сосудистой системы практически ничего не известно.
Вазомоторная регуляция у рыб изучена
мало. Большинство периферических кровеносных сосудов у них снабжено
симпатическими нервами, хотя некоторые из этих нервов на самом деле выделяют ацетилхолин.
У млекопитающих ацетилхолин обладает сосудорасширяющим действием (см. разд.
5.2.1), у рыб же, напротив, он обнаруживает тенденцию повышения давления,
увеличивая периферическое сопротивление.
Основа для рефлекторной регуляции
гемодинамики в филогенезе появляется у амфибий. Она обеспечивается, в сущности,
так же, как у рептилий, птиц и млекопитающих.
Каждый орган тела способен эффективно
работать лишь при условии адекватного кровообращения. Изменение деятельности
органа должно сопровождаться и соответствующим изменением кровотока. Регуляция
кровообращения осуществляется за счет детерминированных изменений минутного
объема крови и сопротивления регионарных отделов сосудистого русла. Механизмы
регуляции кровообращения для удобства изучения условно подразделяют на местные
(периферические, или регионарные) и центральные нейрогуморальные. Первые
регулируют кровоток в органах и тканях в соответствии с их функцией и
интенсивностью метаболизма, вторые — системную гемодинамику при общих
адаптивных реакциях организма.
9.6.1.
Местные механизмы регуляции кровообращения
Различному уровню деятельности органов и тканей
соответствуют различный уровень процессов расщепления органических соединений и
связанная с ним потребность в кислороде. Кислород приносится к тканям только с
кровью и только с кровью удаляются из тканей образующиеся в них продукты
окисления. Отсюда следует, что увеличенный приток крови, соответствующий
усиленному метаболизму, является обязательным условием длительной работы любого
органа. Так, в отдельно работающей мышце или железе кровоток усиливается и в
этом процессе участвуют сосуды микроциркуляторного русла. На основании
взаимосвязи между тканевой микроциркуляцией и состоянием клеток реализуются
механизмы саморегуляции, которые и обеспечивают соответствие между уровнем
функции органа и его кровоснабжением.
В основе этих местных механизмов лежит то, что
образующиеся в процессе метаболизма продукты способны расширять прекапиллярные
артериолы и увеличивать в соответствии с деятельностью органа количество
открытых функционирующих капилляров. Например, при усилении деятельности
скелетной мышцы образование АТФ вначале отстает от ее потребности, но
возрастает количество продуктов его распада — АДФ и АМФ. Их избыток активирует
ресинтез АТФ в митохондриях и увеличивает потребление кислорода в клетке.
Возникающий при этом избыток аденозина тормозит транспорт Са2+ в
клетки гладкой мышцы артериол. В результате их стенки расслабляются,
увеличивается тканевый кровоток, что влечет за собой увеличение кислородного
снабжения мышцы и увеличение синтеза АТФ.
Понижение тонуса гладких мышц сосудов
микроциркуляторного русла и возникающее в результате расширение сосудов
происходят и под влиянием ряда других продуктов метаболизма, например ионов H+.
Важную роль в местной регуляции кровообращения играют также биологически
активные вещества типа кининов, простагландинов, гистамина и т. д. Они
оказывают прямое влияние на тонус гладкомышечных клеток сосудов, приспосабливая
местный кровоток к потребностям органа.
Гладкие мышцы стенок сосудов никогда не бывают
полностью расслаблены. В них постоянно сохраняется некоторое напряжение — мышечный
тонус. Тоническое состояние сопровождается изменением электрических
характеристик и незначительным сокращением мышцы. Тонус гладких мышц
обеспечивается двумя механизмами: миогенным и нейрогуморальным.
Миогенная регуляция играет ведущую роль в поддержании сосудистого тонуса. В
этом легко убедиться, так как даже при полном отсутствии внешних нервных и
гуморальных влияний продолжает сохраняться остаточный тонус сосудов, получивший
название базального, или периферического.
В основе базального тонуса лежит способность
некоторых гладкомышечных клеток сосудов к спонтанной активности и
распространению возбуждения от клетки к клетке, что создает ритмичные колебания
тонуса — эндогенную вазомоторику. Она отчетливо выражена в артериолах,
метартериолах, прекапиллярных сфинктерах. Воздействия, уменьшающие уровень
мембранного потенциала (такие как механическое растяжение), увеличивают частоту
спонтанных разрядов и амплитуду сокращения гладких мышц. Напротив,
гиперполяризация клеточных мембран приводит к исчезновению спонтанного
возбуждения и мышечных сокращений. Вырабатываемые тканями метаболиты оказывают
активное воздействие на гладкомышечные клетки по принципу отрицательной
обратной связи. Так, при повышении тонуса прекапиллярных сфинктеров капиллярный
кровоток уменьшается, соответственно увеличивается концентрация метаболитов,
что оказывает сосудорасширяющее действие. Подобными эффектами обладают низкое
напряжение 02 и высокое СO2, повышение концентрации H+.
Базальный тонус не одинаков для разных областей
сосудистого русла. Он наиболее выражен в сосудах органов с высоким уровнем
метаболизма. Благодаря наличию базального тонуса и способности его к местной
саморегуляции сосуды некоторых областей могут поддерживать объемную скорость
кровотока на постоянном уровне независимо от колебаний системного артериального
давления. Эта особенность наиболее отчетливо выражена в сосудах почки, сердца,
мозга.
Местные механизмы — необходимое звено регуляции
кровообращения, хотя и недостаточное для того, чтобы обеспечить быстрые и
значительные изменения кровообращения, возникающие в процессе приспособления
организма к изменениям среды. Последнее достигается благодаря координации
местных саморегуляторных механизмов и центральной нейрогуморальной регуляции.
9.6.2.
Нейрогуморальная регуляция системного кровообращения
Координационные акты, которые приспосабливают
сердечно—сосудистую систему к оптимальному обеспечению кровоснабжением органов
и тканей в соответствии с их функциональным состоянием, осуществляются за счет
деятельности нервной системы и гуморальных факторов. Эта регуляция
обеспечивается сложным механизмом, включающим чувствительное, центральное и
эфферентное звенья. Эфферентное звено представлено нервным и эндокринным
компонентами.
Чувствительное звено. Чувствительная иннервация сосудов представлена
главным образом свободными древовидно разветвляющимися нервными окончаниями,
которые располагаются между коллагеновыми волокнами адвентиции. Рецепторы
сосудов — ангиоцепторы — по своей функции подразделяются на барорецепторы
(прессорецепторы), реагирующие на изменение артериального давления, и хеморецепторы,
чувствительные к изменению химического состава крови. Раздражителем
барорецепторов является не давление как таковое, а скорость и степень
растяжения стенки сосуда пульсовыми или нарастающими колебаниями кровяного
давления.
Ангиоцепторы расположены по всей сосудистой системе и
составляют единое рецептивное поле (В. Н. Черниговский). Их наибольшие
скопления находятся в главных рефлексогенных зонах: аортальной,
синокаротидной, в сосудах легочного круга кровообращения. В ответ на каждое
систолическое повышение артериального давления барорецепторы зон генерируют
залп импульсов, которые затухают при диастолическом снижении давления.
Минимальный порог возбуждения барорецепторов — 40 мм рт. ст., максимальный —
200 мм рт. ст. Повышение давления выше этого уровня не ведет к дополнительному
учащению импульсации.
Аортальная рефлексогенная зона. Существование этой зоны было открыто И. Ф. Ционом и
К. Людвигом в 1866 г. При повышении артериального давления происходит
растяжение стенки аорты, что влечет за собой раздражение барорецепторов. По
волокнам депрессорного нерва возбуждение достигает сосудодвигательного центра в
продолговатом мозгу, вызывая уменьшение частоты разрядов, следующих по
эфферентным волокнам к гладким мышцам стенок сосудов. Одновременно с этим
снижается частота сердечных сокращений. Итогом снижения тонуса сосудов и
появления брадикардии является понижение общего артериального давления.
|
|
|
Рис. 9.44 Влияние повышения давления в изолированном
каротидном синусе на артериальное давление собаки 1 —
давление в каротидном синусе; 2 — артериальное
давление; 3 — отметка времени 3 с. Цифрами справа обозначены величины
артериального давления, вверху — величины давления в каротидном синусе. |
Аортальная рефлексогенная зона является не только депрессорной,
как это вначале считали. При падении артериального давления частота импульсов в
депрессорном нерве уменьшается, что приводит к торможению центра блуждающего
нерва и активации симпатического. Разряды в последнем учащаются, что вызывает
сужение сосудов, стимуляцию деятельности сердца и в итоге — повышение общего
артериального давления. Эти два примера свидетельствуют о том, что
поддержание постоянства давления в аорте осуществляется авторегуляторными
механизмами, основанными на принципе отрицательной обратной связи.
Область сонного (каротидного) синуса. Эта область — место разветвления общей сонной
артерии на внутреннюю и наружную (см. рис. 5.3) — вторая главная рефлексогенная
зона. Она была описана в 1923 г. Г. Герингом. Возбуждение барорецепторов зоны
каротидного синуса, возникающее в результате повышения давления в сонной
артерии, вызывает так называемый вазокардиальный рефлекс (рефлекс
Бейнбриджа), заключающийся в расширении сосудов и замедлении частоты
сердечных сокращений. Это, в свою очередь, приводит к общему снижению
артериального давления (рис. 9.44, 9.45).
Следовательно, чем выше давление в
дуге аорты и каротидном синусе, тем сильнее нервные влияния, ведущие к снижению
кровяного давления. Синокаротидная зона, подобно артериальной, может быть и
депрессорной, и прессорной. В случае падения давления в сонной артерии
интенсивность
|
|
|
Рис. 9.45 Взаимоотношения
между сонным (каротидным) клубком, каротидным синусом, сосудодвигательным
центром и общей системой кровообращения |
импульсации от барорецепторов уменьшается, что
сопровождается рефлекторным повышением тонуса мышц сосудистой стенки.
Соответственно повышается периферическое сопротивление сосудов и вследствие
этого нормализуется артериальное давление.
Сосуды легочного круга кровообращения. Как и в большом круге кровообращения, повышение
давления в легочной артерии при раздражении ее барорецепторов закономерно
приводит к брадикардии, гипотонии и расширению сосудов селезенки (рефлекс Парина),
что сопровождается снижением давления и, следовательно, устранением застоя
крови в легких.
В аортальной и каротидной рефлексогенных зонах наряду
с барорецепторами имеются еще и хеморецепторы, чувствительные к
изменению химического состава крови. Они открыты бельгийскими учеными Корнеем и
Жаном Хеймансами в 1926 г. Скопления сенсорных окончаний названы соответственно
аортальным и каротидным клубочками (гломусами). Хеморецепторы
дуги аорты представляют собой простое расположение клеток. В отличие от них
каротидный гломус имеет сложную капиллярную структуру с большим количеством
артериоло—венулярных анастомозов. Между капиллярами располагаются клетки двух
типов. Клетки I типа заполнены электронно—плотными везикулами, содержащими
биогенные амины. Клетки II типа не содержат аминов; своими отростками они
окружают клетки I типа. Собственно хеморецепторами считают клетки I типа и
свободные нервные окончания.
Хеморецепторы реагируют на изменение концентрации в
крови O2, C02, H+. Их возбуждение
может возникать также под влиянием некоторых неорганических и органических
веществ. Гипоксия, гиперкапния, которые сопровождаются изменением химического
состава крови, приводят к возникновению сердечно—сосудистых и дыхательных
рефлексов, которые направлены на нормализацию состава крови и поддержание
гомеостаза. Каротидные хеморецепторы в большей степени участвуют в регуляции
легочной вентиляции, аортальные — преимущественно в регуляции деятельности
сердечно—сосудистой системы. Как установлено В. Н. Черниговским, хеморецепторы
находятся также в сосудах сердца, селезенки, почек, костного мозга, органов
пищеварения и др. Их физиологическая роль состоит в восприятии концентрации
питательных веществ, гормонов, осмотического давления крови и передаче сигнала
об их изменении в ЦНС.
Механо— и хеморецепторы расположены также в стенках
венозного русла. Так, повышение давления в венах брюшной полости неизменно
сопровождается рефлекторным учащением и углублением дыхания, усилением
сердечного кровотока и присасывающего действия грудной клетки.
Рефлексы, возникающие с рецептивных зон сердечно—сосудистой
системы и определяющие регуляцию взаимоотношений в пределах именно этой
системы, носят название собственных (системных) рефлексов кровообращения (В.
Н. Черниговский). При небольших силах раздражения рецепторов они возникают без
сопровождения другими рефлексами (см. разд. 5.3.1). Так, незначительные
изменения давления в каротидных синусах влекут за собой прежде всего изменение
в системе кровообращения. Это будет собственный рефлекс кровообращения.
При увеличении силы раздражения в ответную реакцию помимо сердечно—сосудистой
системы вовлекается дыхание. Это будет уже сопряженный рефлекс. Пороги
раздражения для собственных рефлексов всегда ниже, чем для сопряженных. Переход
от собственных рефлексов к сопряженным совершается постепенно. Сопряженные
рефлексы рассматривают как определенную фазу в развитии цепи последовательных
рефлексов, вызываемых раздражением сосудистых рефлексогенных зон. Существование
сопряженных рефлексов дает возможность системе кровообращения быстро и
адекватно приспосабливаться к меняющимся условиям внутренней среды организма.
Центральное звено. Центральные механизмы, регулирующие поддержание артериального давления
на необходимом организму уровне, т. е. взаимодействие между величиной сердечного
выброса и тонуса сосудов, осуществляются за счет совокупности нервных структур,
которые принято называть сосудодвигательным (вазомоторным) центром. Это
понятие имеет собирательное функциональное значение, включающее различные
уровни центральной регуляции кровообращения с иерархической соподчиненностью
разных ее этажей. Структуры, относящиеся к вазомоторному центру, локализуются в
спинном, продолговатом мозгу, гипоталамусе, коре больших полушарий (рис. 9.46).
Спинальный уровень регуляции. Нервные клетки, аксоны которых образуют
сосудосуживающие волокна, располагаются в боковых рогах грудных и первых
поясничных сегментов спинного мозга. Эти клетки И. П. Павлов назвал спинальным
сосудосуживающим центром. Установлено, что при раздражении чувствительных
окончаний соматических нервов в спинном мозгу происходит передача возбуждения
на преганглионарные симпатические нейроны и таким образом осуществляется
замыкание рефлексов, регулирующих сосудистый тонус. Отделение спинного мозга от
продолговатого сопровождается падением величины кровяного давления, которое
вскоре восстанавливается до исходных показателей. Спинальные сосудосуживающие
нейроны поддерживают свой уровень возбудимости в основном импульсами от
вышерасположенных структур нервной
системы.
Бульварный уровень регуляции. Сосудодвигательный центр продолговатого мозга
является основным центром поддержания тонуса сосудов и рефлекторной регуляции
кровяного давления. Его локализация была установлена Ф. В. Овсянниковым (1871)
с помощью метода перерезок ствола мозга. У млекопитающих этот центр расположен
на дне IV желудочка головного мозга в его верхней части по обе стороны от
средней линии.
Сосудодвигательный центр подразделяется на
депрессорную, прессорную и кардиоингибирующую зоны. Депрессорная зона
способствует снижению артериального давления путем уменьшения активности
симпатических сосудосуживающих волокон, вызывая тем самым расширение сосудов и
падение периферического сопротивления, а также путем ослабления симпатической
стимуляции сердца, т. е. уменьшения сердечного выброса. Депрессорная зона
является местом переключения импульсов, поступающих сюда с
барорецепторов рефлексогенных зон, которые вызывают центральное торможение
тонических разрядов вазоконстрикторов. Кроме того, Депрессорная область
оказывает рефлекторное угнетение прессорной зоны и активирует парасимпатические
механизмы.
Прессорная зона оказывает прямо противоположное действие, повышая артериальное давление
через увеличение периферического сопротивления сосудов и сердечного выброса.
Взаимодействие депрессорных и прессорных структур сосудодвигательного центра
носит сложный синерго—антагонистический характер.
Кардиоингибирующее действие третьей зоны
опосредуется волокнами блуждающего нерва, идущими к сердцу. Его активность
приводит к уменьшению сердечного выброса и тем самым объединяется с активностью
депрессорной зоны в снижении артериального давления.
Деление сосудодвигательного центра на зоны довольно
условно, так как из—за взаимного перекрытия
зон определить границы невозможно. В одной и той же
|
|
|
Рис. 9.46 Важнейшие
«входы» и «выходы» сосудодвигательных центров
продолговатого мозга Эфферентные
волокна, усиливающие кровообращение, исходят преимущественно из
ипсилатеральных прессорных отделов, тогда как тормозные волокна от
депрессорных отделов пересекают продолговатый мозг и идут в вентралатеральных
участках спинного мозга на противоположной (контрлатеральной) стороне. |
зоне могут быть зарегистрированы и сосудорасширяющие,
и сосудосуживающие нейроны. Функциональное различие нейронов согласуется с
представлением о наличии депрессорной и прессорной зон.
Состояние тонического возбуждения
сосудодвигательного центра и, соответственно, уровень общего артериального
давления регулируются импульсами, идущими от сосудистых рефлексогенных зон
(рис. 9.47). Кроме того, этот центр входит в состав ретикулярной формации
продолговатого мозга, откуда также получает многочисленные коллатеральные
возбуждения от всех специфически проводящих путей.
Будучи автоматическим
саморегулирующимся центром, обеспечивающим основные элементарные функции
кровообращения (и в первую очередь оптимальный уровень давления в магистральных
сосудах), сосудодвигательный центр продолговатого мозга в реакциях целого
организма выступает в тесном взаимодействии с гипоталамусом, мозжечком,
базальными ядрами, корой головного мозга. Он осуществляет срочные ответы
кровеносной системы, связанные с усиленной мышечной работой, гипоксией,
гиперкапнией, ацидозом (Г. П. Конради). Высшая же форма регуляции
кровообращения, касающаяся энергетического обеспечения и интеграции
разнообразных сложных приспособительных актов и поведенческих реакций,
обеспечивается более высоким уровнем нервной системы.
|
|
|
Рис.
9.47 Нисходящие пути ствола мозга и
гипоталамуса, конвергирующие на преганглионарных нейронах промежуточной зоны пояснично—грудного
отдела спинного мозга (слева). Нервная регуляция артериального давления
(справа). «+», «—» — соответственно возбуждающие и тормозные эффекты
раздражения артериальных барорецепторов (Б) ЯОП —
ядро одиночного пути; ДЯ — дорсальное ядро блуждающего нерва; ДВЯ — двойное
ядро; ПВЯ — паравентрикулярное ядро гипоталамуса; РВЛ — рострально—вентралатеральная
область продолговатого мозга; IX — языкоглоточный нерв; Х — блуждающий нерв. |
Влияния самого сосудодвигательного центра осуществляются
через спинной мозг, ядра черепных нервов (VII, IX и Х пар), периферические
образования автономной нервной системы (рис. 9.48).
Гипоталамический уровень регуляции. Промежуточный мозг и особенно различные ядра
гипоталамической области рассматривают как сосредоточение высших подкорковых
центров, регулирующих функции разных отделов автономной нервной системы. С их
состоянием тесно связаны вазомоторные реакции гипоталамического происхождения,
играющие роль главным образом в осуществлении адаптивных реакций
кровообращения.
Интегративные центры гипоталамуса оказывают
нисходящее влияние на сердечно—сосудистый центр продолговатого мозга,
обеспечивая дифференцированный фазный и тонический контроль. Раздражение этого
отдела ведет к значительным изменениям кровяного давления. Лабораторные
животные v которых удалена вся кора мозга,
но сохранен промежуточный мозг, обнаруживают сложнокоординированные сосудистые
рефлексы в виде повышения кровяного давления и изменения частоты сердечных
сокращений.
В гипоталамусе, так же как в бульбарном
сосудодвигательном центре, различают депрессорные и прессорные
зоны (рис. 9.48). В целом это дает основание рассматривать гипоталамический
уровень как надстройку, выступающую в роли своеобразного дублера основного
бульбарного центра.
Корковый уровень регуляции. Влияние раздражения коры головного мозга на функции
кровообращения было обнаружено В. Я. Данилевским, Н. А. Миславским, В. М.
Бехтеревым, которые установили, что раздражение лобной и теменной областей
вследствие изменения сосудистого тонуса закономерно ведет к изменению кровяного
давления. Наиболее подробно эти реакции изучены с помощью методов условных
рефлексов. Так, сравнительно легко удается выработать сосудистую реакцию на
ранее индифферентный раздражитель, вызывая при этом ощущение жары, холода, боли
и т. д.
Определенные зоны коры головного мозга, как и
гипоталамус, оказывают нисходящее влияние на основной центр продолговатого
мозга. Эти влияния формируются в результате сопоставления информации, которая
поступила в высшие отделы нервной системы от различных рецептивных зон, с
предшествующим опытом организма. Они обеспечивают реализацию сердечно—сосудистого
компонента эмоций, мотиваций, поведенческих реакций.
Эфферентное звено. Эфферентная регуляция кровообращения реализуется через один и тот же
.аппарат, в основе которого лежат нервный и эндокринный механизмы.
Нервный механизм осуществляется, во—первых, при участии
преганглионарных симпатических нейронов, тела которых расположены в передних
рогах грудного и поясничного отделов спинного мозга, а также постганглионарных
нейронов, лежащих в пара— и превертебральных симпатических ганглиях. Вторым компонентом
являются преганглионарные парасимпатические нейроны ядра блуждающего нерва,
находящегося в продолговатом мозгу, и ядра тазового нерва, расположенного в
крестцовом отделе спинного мозга, и их постганлионарные нейроны. Третью часть
для полых висцеральных органов составляют эфферентные нейроны метасимпатической
нервной системы, локализующиеся в интрамуральных ганглиях их стенок. Названные
нейроны представляют собой общий конечный путь всех эфферентных и
центральных влияний, которые через адренергическое, холинергическое и другие
звенья регуляции действуют на сердце и сосуды.
Эндокринный отдел включает в себя
мозговой и корковый слои надпочечников, заднюю долю гипофиза,
юкстагломерулярный аппарат почек.
Впервые сосудосуживающее влияние симпатических
нервных волокон было показано отечественным физиологом А. П. Вальтером (1842)
на плавательной перепонке лягушки. Позже К. Бернар (1851) поставил специальные
опыты на ухе кролика. После перерезки симпатического нерва на шее кролика через
1—2 мин он наблюдал значительное расширение сосудов ушной раковины (рис. 9.49),
что проявлялось в покраснении кожи уха и повышении ее температуры. При
раздражении периферического конца этого перерезанного нерва кожа, покрасневшая
после перерезки симпатических волокон, становилась бледной и холодной на ощупь.
Это происходит в результате сужения просвета сосудов уха.
Тот же эффект характерен для сосудов органов брюшной
полости, почек, мозговых оболочек, кожи, однако в различных областях
сосудистого русла симпатический тонус проявляется не одинаково. Так, диаметр
сосудов кожи полностью зависит от симпатической иннервации, в то время как в
других органах эта зависимость проявляется в меньшей степени. Из этих опытов
следует, что симпатические волокна являются главными вазоконстрикторами, поддерживающими
тонус сосудов. Они постоянно находятся в состоянии тонического возбуждения,
поддерживая некоторую степень напряжения кольцевой сосудистой мышцы.
Особенно четко регуляторное значение симпатической
иннервации было установлено в экспериментах на симпатэктомированных кошках. В
случае незначительных кровопотерь у этих животных возникало резкое и стабильное
падение кровяного давления.
Симпатическая регуляция диаметра сосудов имеет
большое биологическое значение, так как, во—первых, она позволяет поддерживать
постоянным уровень кровяного давления, во—вторых, в зависимости от уровня метаболизма
регулировать кровоснабжение отдельных органов.
|
|
|
Рис.
9.48 Компоненты сосудодвигательного
центра А —
корковое представительство сосудодвигательного центра; Б — центры гипоталамуса: передний
гипоталамус (депрессорные зоны), задний гипоталамус (прессорные зоны); В — бульбарные центры
(сосудорасширяющий, сосудосуживающий); Г — центры спинного мозга (боковые
рога). 1 — кора больших
полушарий, 2 — ретикулярная
формация, 3 — сосудодвигательный центр, 4 — спинной мозг, 5 — симпатический ганглий, 6 — кровеносные сосуды, 7 —
продолговатый мозг, 8 —
гипофиз, 9 — гипоталамус. |
|
|
|
Рис.
9.49 Механизмы сосудодвигательных
реакций А — влияние
симпатического нерва (опыт К. Бернара): I — результат десимпатизации, II — результат раздражения периферического
конца перерезанного симпатического нерва; Б — нервная регуляция просвета сосуда: а —
сосудосуживающие симпатические нервы (адренергические), б — сосудорасширяющие нервы; В — гуморальная регуляция просвета
мелких сосудов; 1 —
стимулятор, 2 — симпатический
ганглий, 3 — норадреналин, ангиотензин, вазопрессин и др., 4 — СО2, молочная
кислота, гистамин, брадикинин и др. |
Степень сокращения сосудистых гладких мышц зависит от
частоты разрядов в сосудодвигательных волокнах. Следовательно, возрастание
числа импульсов приводит к вазоконстрикции. Однако, если уменьшение числа
импульсов идет от некоторого уровня, наступает дилатация. Дилатация не
является беспредельной, она ограничена базальным тонусом сосудов. После
симпатэктомии в денервированном участке также наблюдается вазодилатация, и в
этом случае диаметр сосудов целиком определяется базальным тонусом.
Помимо вазоконстрикторных волокон существуют
специальные волокна возбуждение которых сопровождается вазодилатацией. Эти
волокна были идентифицированы М. Шиффом и позже К. Бернаром при раздражении барабанной
струны — веточки язычного нерва, идущей к поднижнечелюстной слюнной железе.
Раздражение веточки вызывает сильное расширение сосудов железы.
Аналогичный эффект возникает при стимуляции других
нервов — языкоглоточного, верхнегортанного, тазового. Все они являются
парасимпатическими. Однако это вовсе не означает, что все вазодилататоры
относятся к парасимпатической нервной системе и что все парасимпатические
волокна расширяют сосуды. Например, волокна парасимпатического блуждающего
нерва сужают сосуды сердца. К закономерному расширению сосудов сердца и
скелетных мышц может привести возбуждение симпатических волокон. Это свидетельствует
о том, что указанные волокна относятся к холинергическим волокнам
симпатического происхождения. Имеются сосудорасширяющие волокна и в
соматических нервах, таких как седалищный, однако из—за присутствия в этом
стволе вазоконстрикторов их трудно обнаружить. Нельзя не учитывать, что сосуды
способны к расширению и без участия дилататоров, а, как было показано выше,
просто в результате снижения вазоконстрикторной активности.
Иннервация вен соответствует иннервации артерий, хотя
в целом плотность иннервации вен значительно меньше. Нервные окончания
эфферентных волокон точно прослежены до прекапиллярных сфинктеров, где они
оканчиваются на гладкомышечных клетках. Сфинктеры способны активно отвечать на
проходящие импульсы.
Основным механизмом нервной регуляции капилляров является эфферентная иннервация бессинаптического
типа посредством свободной диффузии медиаторов в направлении стенки сосуда. В
зависимости от расстояния, которое проходит медиатор, нервные влияния на
капилляры могут быть быстрыми и непосредственными или замедленными и
опосредованными. Распространяясь во все стороны от терминали, медиатор влияет
на все части функционального элемента в пределах целого микроучастка.
Эндокринная регуляция. Главную роль в эндокринной регуляции сосудистого
русла играют гормоны— мозгового и коркового слоев надпочечников, задней
доли гипофиза и юкстагломерулярного аппарата почек.
Адреналин
обладает резким сосудистым действием. На артерии и артериолы кожи, органов
пищеварения, почек и легких он оказывает сосудосуживающее влияние, на
сосуды скелетных мышц, гладкой мускулатуры бронхов — расширяющее,
содействуя тем самым перераспределению крови в организме. При физическом
напряжении, эмоциональном возбуждении он способствует увеличению кровотока
через скелетные мышцы, мозг, сердце.
Адреналин, как и норадреналин, выделяющийся в
постганглионарных симпатических окончаниях, иннервирующих кровеносные сосуды,
активирует аденилатциклазу, которая находится на внешней мембране мышечных
клеток. Через образовавшийся 3,5—АМФ он вызывает сужение сосудов.
Влияние адреналина и норадреналина на сосудистую
стенку определяется существованием разных типов адренорецепторов — α и
β, представляющих собой участки гладкомышечных клеток с особой химической
чувствительностью. В сосудах обычно имеются оба типа рецепторов. Взаимодействие
медиатора с α—адренорецептором ведет к сокращению стенки сосуда, с (β—рецептором
— к расслаблению. Норадреналин взаимодействует в основном с альфа—адренорецепторами,
адреналин — с α— и (β—рецепторами. По мнению У. Кеннона, адреналин —
это «аварийный гормон», осуществляющий в трудных, иногда экстремальных условиях
мобилизацию функций и сил организма.
Альдостерон — другое необходимое звено регуляции кровообращения железами
надпочечников. Он вырабатывается в их корковом слое. Альдостерон обладает
необычайно высокой способностью усиливать обратное всасывание натрия в почках,
слюнных железах, пищеварительной системе, изменяя таким образом
чувствительность стенок сосудов к влиянию адреналина и норадреналина.
Вазопрессин — гормон задней доли гипофиза. Он вызывает сужение артерий и артериол
органов брюшной полости и легких. Однако, как и под влиянием адреналина, сосуды
мозга и сердца реагируют на этот гормон расширением, что способствует улучшению
питания и мозговой ткани, и сердечной мышцы.
Клетки юкстагломерулярного аппарата почек продуцируют
фермент ренин. Он обнаружен у некоторых видов костистых рыб, амфибий,
рептилий. У млекопитающих в цепи ферментативных реакций с участием глобулинов
крови он превращается в ангиотензин II. Ангиотензин II обладает мощным
вазоконстрикторным действием, значительно превосходящим по силе норадреналин,
но в отличие от последнего не вызывает выброса крови из депо. Это объясняется
наличием чувствительных к ангиотензину рецепторов только в прекапиллярных
артериолах, которые расположены в организме неравномерно. Поэтому его действие
на сосуды различных областей не одинаково. Системный прессорный эффект
сопровождается уменьшением кровотока в почках, кишке, коже и увеличением его в
мозгу, сердце и надпочечниках. Изменения кровотока в мышце незначительны.
Большие дозы ангиотензина могут вызвать сужение сосудов сердца и мозга. Ренин и
ангиотензин представляют собой ренин—ангиотензиновую систему.
Помимо прямого действия на сосудистую систему
ангиотензин оказывает влияние и опосредованно через автономную нервную систему
и эндокринные железы. Он увеличивает секрецию альдостерона, адреналина и
норадреналина, усиливает вазоконстрикторные симпатические эффекты.
Способностью расширять сосуды обладают биологически активные
вещества и местные гормоны, такие как гистамин, серотонин, брадикинин,
простагландины.
Гистамин
содержится главным образом в тучных клетках и базофильных гранулоцитах. Он
расширяет сосуды сердца, печени, кишки, увеличивает наполнение капилляров, повышает
проницаемость их эндотелия, а также уменьшает объем циркулирующей крови.
Действием гистамина объясняется реакция покраснения кожи. При введении его в
организм возникает резкое снижение артериального давления, сходное с состоянием
организма при обильном кровотечении или возникновении гистаминового шока.
Серотонин
найден у некоторых беспозвоночных и почти у всех позвоночных животных. Главным
местом его образования являются энтерохромаффинные клетки кишки. В зависимости
от вида животного и условий эксперимента изменения артериального давления могут
иметь фазный характер: гипотензия сменяется гипертензией, после которой вновь
развивается гипотензия. Это объясняется тем, что на тонус сосудов серотонин
оказывает прямое и рефлекторное действие. Прямое действие на гладкую
мускулатуру приводит к спазму сосудов и повышению артериального давления,
воздействие на рефлексогенные зоны вызывает гипотензию.
Брадикинин
образуется в плазме крови, но особенно много его в поднижнечелюстной слюнной и
поджелудочной железах. Являясь регуляторным пептидом он расширяет сосуды кожи,
скелетных мышц, мозговые и коронарные сосуды.
Простагландины представляют большую группу биологически активных веществ. Они являются
производными ненасыщенных жирных кислот. Простагландины образуются практически
во всех органах и тканях, однако термин для их обозначения связан с
предстательной железой, из которой они были впервые выделены. Биологическое
действие простагландинов чрезвычайно многообразно. Один из их эффектов
проявляется в выраженном действии на тонус гладкой мускулатуры сосудов, причем
влияние разных типов простагландинов часто диаметрально противоположно. Одни
Простагландины сокращают стенки кровеносных сосудов и повышают артериальное
давление, другие — оказывают сосудорасширяющее действие, сопровождающееся
гипотензивным эффектом.
В нервной и эндокринной регуляции различают
гемодинамические механизмы кратковременного действия, промежуточные и
длительного действия.
К механизмам кратковременного действия относят
циркуляторные реакции нервного происхождения — барорецепторные,
хеморецепторные, рефлекс на ишемию ЦНС. Их развитие происходит, в течение
нескольких секунд. Промежуточные (по времени) механизмы охватывают
изменения транскапиллярного обмена, расслабление напряженной стенки сосуда, реакцию
ренин—ангиотензиновой системы. Для включения этих механизмов требуются минуты,
а для максимального развития — часы. Регуляторные механизмы длительного действия
влияют на соотношение между внутрисосудистым объемом крови и емкостью сосудов.
Это осуществляется посредством транскапиллярного обмена жидкости. В этом
процессе участвуют почечная регуляция объема жидкости вазопрессин и
альдостерон.
Не весь объем крови в организме циркулирует
равномерно. Ее значительная часть (до 45—50%) находится в так называемых кровяных
депо — селезенке, печени, легких, подкожных сосудистых сплетениях. Роль
депо выполняет и вся венозная система. Значение кровяных депо состоит в
возможности быстрого увеличения массы циркулирующей крови, необходимой в данный
момент для обеспечения потребностей организма. Выброс крови из депо вызывают
эмоциональные состояния, интенсивное физическое напряжение, состояние
кислородного голодания организма, кровопотери и др. Для каждого из основных
органов депо механизмы задержания крови и ее мобилизации специфичны.
Селезенка.
У млекопитающих в селезенке может застаиваться до 20% общего количества крови,
т. е. выключаться из общего кровообращения. Задержка крови происходит в силу
особенности строения сосудов органа: из капилляров кровь поступает вначале в
тонкостенные и легко растяжимые синусы, а затем в венулы.
В местах выхода сосудов из синусов имеются
специальные сфинктеры, благодаря состоянию которых регулируется отток крови
(рис. 9.50). При сокращении сфинктеров отток затрудняется, происходит
заполнение синусов, растяжение их
|
|
|
Рис. 9.50 Заполнение
кровью и опорожнение синуса селезенки А — синус
«включен» в циркуляцию крови (эфферентный и афферентный сфинктеры открыты); Б, В — постепенное заполнение
синуса, Г — синус заполнен
кровью и отключен от циркуляции, Д —
начало опорожнения (эфферентный сфинктер открыт). 1 — вена, 2 — эфферентный сфинктер, 3 — синус селезенки, 4 — афферентный сфинктер; стрелками
показано направление тока крови. |
стенок и увеличение объема селезенки. Сфинктеры
закрыты не полностью, так что через них просачивается плазма крови и
задерживаются форменные элементы.
Таким образом, в синусах скапливается
более густая кровь, содержащая до 20% эритроцитов всей крови организма, что
имеет определенное биологическое значение.
При возрастании потребности организма
в кислороде возникает возбуждение симпатической нервной системы, сфинктеры
синусов расслабляются и происходит выбрасывание крови в венозное русло. Этому
процессу способствует сокращение гладких мышц селезенки и ее
соединительнотканных перемычек (трабекул). В результате возрастает гематокрит,
увеличивается количество гемоглобина, что способствует улучшению транспорта O2 и CO2.
Депонирующая функция селезенки может регулироваться условнорефлекторно.
Печень. Печень также способна депонировать и концентрировать
значительные количества крови, не выключая ее, в отличие от селезенки, из
общего кровотока. Механизм депонирования основан на сокращении диффузного
сфинктера печеночных вен и синусов при меняющемся притоке крови или за счет
увеличенного притока крови при неменяющемся оттоке. Опорожнение депо
осуществляется рефлекторно. На быстрый выход крови влияет адреналин. Он
вызывает сужение брыжеечных артерий и, соответственно, снижение притока крови в
печень. Одновременно он расслабляет мускулатуру сфинктеров и сокращает стенку
синусов. Выброс крови из печени зависит от колебания давления в системе полой
вены и брюшной полости. Этому способствуют также интенсивность дыхательных движений
и сокращение мышц брюшного пресса.
Легкие. Депонирование крови в легких осуществляется за счет
изменения емкости артерий и вен. Артерии легких имеют более тонкие и растяжимые
стенки, и кровь находится в них под давлением в 5—6 раз ниже, чем в большом
круге кровообращения. Однако главным резервуаром органа являются легочные вены.
Они также тонкостенные и легко растяжимые. Скопление крови в легких
увеличивается при сужении сосудов большого круга кровообращения под влиянием
ряда факторов. Таким образом, между сосудами обоих кругов кровообращения
проявляются реципрокные отношения.
Кожа. Капилляры подсосочкового слоя кожи, расширяясь,
могут вмещать значительные количества крови. У человека ее объем достигает 1 л.
Эта кровь мало подвижна и застаивается. Находящиеся здесь артериоло—венулярные
анастомозы способствуют тому, что кровь протекает через кожу, минуя сплетения
капилляров. Депонирование крови в коже в первую очередь связано с процессом
терморегуляции.
9.8.
ОСОБЕННОСТИ КРОВООБРАЩЕНИЯ В НЕКОТОРЫХ ОТДЕЛЬНЫХ ОРГАНАХ
В связи с неоднородностью строения разных органов,
различиями протекающих в них обменных процессов, а также разными функциями
принято различать регионарное (локальное) кровообращение в отдельных органах и
тканях: коронарное, мозговое, легочное и т. д.
9.8.1. Кровообращение в сердце
У млекопитающих миокард получает кровь по двум венечным
(коронарным) артериям — правой и левой, устья которых располагаются в
корне аорты. Ветви левой снабжают кровью левый желудочек и межжелудочковую
перегородку, левое предсердие и правый желудочек. Ветви правой венечной артерии
проникают в стенки правой половины сердца. Капиллярная сеть миокарда очень
густая: число капилляров приближается к числу мышечных волокон. Миокард
пронизан сетью так называемых несосудистых каналов. По диаметру они
соответствуют венулам и артериолам, а по строению стенки напоминают капилляры.
Они соединяют соответствующие сосуды с полостями сердца. К дренажной системе
сердца относятся еще и синусы, располагающиеся в глубоких слоях миокарда. В них
открываются капилляры.
Условия циркуляции крови в венечных сосудах
значительно отличаются от условий циркуляции в сосудах других органов тела.
Ритмические колебания давления в полостях сердца и изменение его формы и
размеров в течение сердечного цикла оказывают существенное влияние на кровоток
через венечные сосуды. Так, в момент систолического напряжения желудочков
сердечная мышца сдавливает находящиеся в ней сосуды, поэтому кровоток
ослабевает, доставка кислорода к тканям снижается. Сразу же после конца систолы
кровоснабжение сердца увеличивается. Ток коронарного кровообращения может
изменяться и в зависимости от давления в аорте. Однако кровоток через сердце
может возрастать при неизменности артериального давления благодаря механизмам
регуляции коронарного кровообращения.
Нервная регуляция коронарного кровообращения остается во многом до конца не
исследованной. Основная регулирующая роль взаимодействия естественных
симпатических и парасимпатических влияний состоит в быстром и адекватном
приспособлении коронарного кровообращения к текущим потребностям организма.
Возбуждение блуждающих нервов расширяет коронарные сосуды. При раздражении
сердечных симпатических ветвей также наблюдается расширение коронарных сосудов
и увеличение кровотока. При этом увеличиваются сила и частота сердечных
сокращений, растет скорость сокращения сердечной мышцы и интрамуральное
давление. Эти факторы, изменяющие метаболизм миокарда, сами по себе вызывают
расширение коронарных сосудов.
9.8.2. Мозговое
кровообращение
Кровообращение головного мозга более
интенсивно, чем других органов. Около 15% крови каждого сердечного выброса в
большой круг кровообращения поступает в сосуды мозга. Мозговые артерии являются
сосудами мышечного типа с обильной адренергической иннервацией, что позволяет
им менять просвет в широких пределах.
Головной мозг приматов снабжается
кровью одновременно четырьмя магистральными артериями — парными внутренними
сонными и позвоночными, которые объединены между собой широкими анастомозами в
области артериального (виллизиевого) круга большого мозга. В
обычных условиях кровь здесь не смешивается, поступая ипсилатерально из каждой
внутренней сонной артерии в полушария мозга, а из позвоночных — преимущественно
в отделы мозга, расположенные в области задней черепной ямки.
Мозг получает кровь от артерий, радиально отходящих
от сосудов мягкой оболочки головного мозга. В последние кровь поступает из
артериального круга. Между артериолами и венулами анастомозов нет, капилляры
находятся в открытом состоянии. Количество капилляров тем больше, чем
интенсивнее метаболизм ткани. В сером веществе капилляры расположены
значительно гуще, чем в белом.
Оттекающая от мозга кровь поступает в вены,
образующие синусы в твердой оболочке головного мозга. В отличие от других частей
тела венозная система мозга не выполняет емкостной функции.
Эффекторами регулирования мозгового кровотока
являются магистральные внутримозговые артерии и артерии мягкой мозговой
оболочки, которые характеризуются специфическими функциональными особенностями.
При изменении общего артериального давления в определенных пределах
интенсивность мозгового кровообращения остается постоянной. Осуществляется это
благодаря изменению сопротивления в артериях мозга, которые сужаются при
повышении общего артериального давления и расширяются при его понижении. Кроме
такой ауторегуляции кровотока, предохранение головного мозга от высокого
кровяного давления и избыточности пульсации происходит главным образом
благодаря особенностям строения сосудистой системы этой области. Особенности
эти заключаются в том, что по ходу сосудистого русла имеются многочисленные
изгибы («сифоны»). Изгибы сглаживают перепады давления и пульсирующий характер
кровотока. При повышенной активности всего организма, например, в условиях
эмоционального возбуждения или чрезмерного физического напряжения, мозговой
кровоток увеличивается на 20—25%. Однако такие сдвиги не вызывают возникновения
дисфункций. Происходит это потому, что мозг является единственным органом,
основной сосудистый бассейн которого находится на поверхности этого органа и
представлен системой сосудов мягкой мозговой оболочки. В этом случае
своеобразным резервом для некоторого кровенаполнения является определенное
пространство до твердой оболочки головного мозга.
Клетки высших отделов ЦНС при недостаточном снабжении
кислородом перестают функционировать раньше, чем клетки других органов.
Прекращение притока крови к мозгу кошки на 20 с вызывает уже полное
исчезновение электрических процессов в коре больших полушарий, а прекращение
кровотока на 5 мин приводит к необратимому повреждению мозговых клеток.
9.8.3. Легочное кровообращение
Кровоснабжение легких осуществляется легочными и
бронхиальными сосудами. Легочные сосуды составляют малый круг кровообращения и
выполняют главным образом функцию газообмена между кровью и воздухом.
Бронхиальные сосуды обеспечивают питание легкого и принадлежат к большому кругу
кровообращения. Между этими двумя системами существуют выраженные анастомозы.
Особенностью малого круга кровообращения являются
относительно небольшая длина его сосудов, меньшее (примерно в 10 раз по
сравнению с большим кругом) сопротивление, оказываемое току крови, тонкость
стенок артериальных сосудов и почти непосредственное соприкосновение капилляров
с воздухом легочных альвеол. Из—за меньшего сопротивления кровяное давление в
артериях малого круга в 5—6 раз меньше давления в аорте. Эритроциты проходят
через легкие примерно за 6 с, находясь в обменных капиллярах 0,7 с.
Бронхиальные артерии большого круга разветвляются в
легких только до дыхательных бронхиол, и питание стенки альвеол происходит
через капиллярную сеть легочных сосудов.
9.8.4. Кровообращение в печени
Печень получает одновременно артериальную и венозную
кровь. Артериальная кровь поступает по печеночной артерии, венозная — из воротной
вены от пищеварительного тракта, поджелудочной железы и селезенки. Общий отток
крови в полую вену осуществляется по печеночным венам. Через собственно
печеночную артерию проходит 20—30% всей крови, остальное — через воротную вену.
Следовательно, венозная кровь от пищеварительного тракта, поджелудочной железы
и селезенки возвращается к сердцу только пройдя еще дополнительно через печень.
Такая особенность кровоснабжения печени, получившая название портального
кровообращения, связана с пищеварением и выполнением барьерной функции.
Кровь в портальной системе проходит через две сети капилляров. Первая сеть
расположена в стенках органов пищеварения, поджелудочной железы, селезенки, она
обеспечивает всасывательную, выделительную и двигательную функции этих органов.
Вторая сеть капилляров находится непосредственно в паренхиме печени. Она
обеспечивает ее обменную и экскреторную функции, предотвращение интоксикации
организма продуктами, образующимися в пищеварительном тракте.
Исследования русского хирурга и физиолога Н. В. Экка
показали, что если кровь из воротной вены направить непосредственно в полую
вену, т. е. минуя печень, произойдет отравление организма со смертельным
исходом.
Особенностью микроциркуляции в печени является тесная
связь между разветвлениями воротной вены и собственно печеночной артерии с
образованием в дольках печени синусоидных капилляров, к мембранам которых
непосредственно прилежат гепатоциты. Большая поверхность соприкосновения
крови с гепатоцитами и медленный кровоток в синусоидных капиллярах создают
оптимальные условия для обменных и синтетических процессов.
В системе портального кровообращения артериальная
кровь под давлением 110—120 мм рт. ст. поступает в первую сеть капилляров
(например, стенки кишки), где оно понижается до 10—15 мм рт. ст. После
прохождения второй сети капилляров уже в печеночных венах оно составляет 0—5 мм
рт. ст. Эта разность давлений обеспечивает поступательное движение крови.
Регуляция портальной гемодинамики осуществляется посредством
системы периодически сокращающихся входных и выходных сфинктеров синусоидных
капилляров. Такая система приспосабливает кровоток к деятельности органов
брюшной полости, а также обеспечивает депонирование крови.
9.8.5. Почечное
кровообращение
Через каждую почку человека в течение 1 мин проходит
около 750 мл крови, что в 2,5 раза превышает массу органа и в 20 раз
превосходит кровоснабжение многих других органов. За сутки через почки суммарно
проходит около 1000 л крови. Следовательно, при таком объеме кровоснабжения все
количество имеющейся в теле человека крови в течение 5—10 мин проходит через
почки.
Кровь поступает к почкам по почечным артериям. Войдя
в орган на границе между корковым и мозговым веществом, они разветвляются на
дуговые артерии.
От последних в корковое вещество отходят междольковые
артерии, в мозговое вещество — прямые артериолы. В свою очередь от междольковых
артерий в стороны расходятся приносящие клубочковые артериолы, из которых
верхние направляются к корковым нефронам, нижние — к юкстамедуллярным нефронам.
Такая сосудистая топография явилась основанием к условному различению в почке кортикального
кровообращения, снабжающего кровью корковые нефроны, и юкстамедуллярного,
связанного с околомозговыми нефронами.
Приносящие артериолы кортикальной системы
кровообращения разветвляются на капилляры, которые образуют сосудистые клубочки
почечных телец корковых нефронов. Капилляры клубочков собираются в выносящие
клубочковые артериолы. В результате такого соотношения в капиллярах клубочков корковых
нефронов возникает необычайно высокое кровяное давление — до 70—90 мм рт. ст.,
что служит основой возникновения первой фазы мочеобразования, носящей характер
фильтрации вещества из плазмы крови в канальцевую систему почек.
Выносящие артериолы, пройдя короткий путь, вновь
распадаются на капилляры. Капилляры оплетают канальцы нефрона, образуя
перитубуллярную капиллярную сеть. Это «вторичные» капилляры. В отличие от
«первичных» давление крови в них относительно низкое — 10—12 мм рт. ст. Такое
низкое давление способствует возникновению второй фазы мочеобразования, которая
носит характер процесса обратного всасывания жидкости и растворенных в ней
веществ канальцев в кровь. Обе артериолы — приносящий и выносящий сосуды —
могут изменять свой просвет в результате сокращения или расслабления имеющихся
в их стенках гладких мышечных волокон. То обстоятельство, что капилляры
клубочка представляют собой сеть, разветвляющуюся между двумя сосудами
артериального типа, оправдывает ее старинное название — rete mirabile,
что означает «чудесная сеть».
Из «вторичных» капилляров кровь поступает сначала в
звездчатые, а затем междольковые вены. Последние впадают в дуговые вены,
которые в свою очередь переходят в междолевые и, наконец, в почечные.
В юкстамедуллярной системе кровообращения приносящие
и выносящие артериолы сосудистых клубочков околомозговых нефронов почти
одинакового размера, выносящие могут быть несколько больше. Разница в просвете
сосудов служит причиной того, что кровяное давление в капиллярах этих клубочков
значительно ниже (не превышает 40 мм рт. ст.), чем в клубочках корковых
нефронов. В отличие от корковых нефронов выносящие артериолы не распадаются
здесь на густую перитубуллярную сеть капилляров. По типу артериоло—венулярных
анастомозов они переходят в прямые венулы, впадающие в дуговые венозные сосуды.
Юкстагломерулярное кровообращение играет роль своеобразного шунта,
представляющего собой легкий и короткий путь, по которому в условиях сильного
наполнения почек кровью сбрасывается ее часть.
9.8.6. Кровообращение в селезенке
Селезенка — важный кроветворный и защитный орган,
сильно варьирующий в объеме и массе в зависимости от количества депонированной
в ней крови и активности процессов кроветворения. Селезенка принимает участие в
элиминации отживающих или поврежденных эритроцитов и нейтрализации экзо— и
эндогенных антигенов, которые не были задержаны лимфатическими узлами и
проникли в кровоток.
Сосудистая система селезенки благодаря своеобразной
структуре играет существенную роль в функции данного органа. Известно, что от
селезеночных ветвей одноименной артерии отходят артерии трабекул, идущие затем
через
|
|
|
Рис. 9.51 Кровообращение
плода млекопитающих 1 — дуга
аорты, 2 — артериальный
(боталлов) проток, d — левая легочная
артерия, 4 — легочный ствол,
5 — ветви от подвздошных артерий, переходящие в пупочные, 6— плацентарная
вена, несущая артериальную кровь, 7
— пупочные артерии от подвздошной артерии плода, 8— плацента, 9 — каудальная полая вена, 10 — венозный (аранциев) проток, 11 — печень, 12 — правое предсердие, 13 — овальное отверстие в
предсердиях, 14 — краниальная
полая вена. |
лимфатические фолликулы и дающие начало капиллярам.
Покидая лимфатические фолликулы, эти капилляры разделяются на тонкие ветви, частично
исчезающие в пульпе (мякоти) селезенки. Особенность кровообращения в селезенке
обусловлена нетипичным строением ее капилляров. Концевые ветви капилляров имеют
кисточки, заканчивающиеся слепыми расширениями с отверстиями. Через эти
отверстия кровь переходит в пульпу, а оттуда в синусы имеющие отверстия в
стенках. Вследствие этой особенности строения селезенка, как губка, может
впитывать большое количество крови. Ее кровь содержит больше эритроцитов и на
15% больше гемоглобина, нежели кровь, циркулирующая в сосудах, поэтому
поступление крови из селезенки способствует повышению транспорта кислорода.
Кровообращение плода млекопитающих значительно
отличается от такового у взрослых организмов. Как и после рождения, систола предсердий
сердца плода направляет кровь в желудочки, оттуда из левого желудочка она
поступает в аорту, из правого — в легочную артерию. Предсердия плода не
обособлены, а соединяются с помощью овального отверстия, поэтому левый
желудочек направляет в аорту кровь частично и из правого сердца. По легочной
артерии кровь проходит в легкие в весьма незначительном количестве, так как
легкие у плода еще не функционируют. Большая же часть крови из легочной
артерии, минуя легкие, направляется по временно образующемуся сосуду — артериальному
(боталлову) протоку — в аорту.
Важнейшую роль в кровоснабжении плода выполняют пупочные
артерии, отходящие от подвздошной артерии. Через пупочное отверстие они
выходят из плода, затем разветвляются в алантохорионе и образуют густую сеть
артерий и капилляров. Последние входят в ворсинки хориона (рис. 9.51), где
кровь обогащается кислородом и питательными веществами, перешедшими из крови
матери. От плаценты кровь оттекает по пупочной вене в том же канатике и в
дальнейшем впадает в воротную вену печени.
Система кровообращения плода замкнута, кровь матери
никогда не попадает в кровеносные сосуды плода, и наоборот. Все органы и ткани
плода снабжаются смешанной кровью с небольшим содержанием О2 и
повышенной концентрацией С02. Поступление О2 из крови
матери в кровь плода осуществляется путем диффузии, так как напряжение
кислорода в плаценте всегда выше напряжения кислорода в крови пупочной вены.
После рождения пупочные вены и артерии запустевают и
превращаются в соединительнотканные тяжи (связки). С первым вдохом
новорожденного начинают функционировать легкие и устанавливается легочное
кровообращение. Кровь из правого желудочка поступает в легочную артерию и
дальше в легкие. Артериальный проток запустевает, отверстие между предсердиями
зарастает. Левое предсердие заполняется кровью из легочных вен, давление крови
в обоих предсердиях выравнивается. Появляется новая система кровообращения,
аналогичная кровообращению взрослого.
Наряду с кровеносными сосудами в организме существует
система лимфатических сосудов, представляющая собой дополнительную
дренажную систему. По ней в кровяное русло из тканей возвращаются вода,
коллоидные растворы белков, эмульсии липидов, растворенные в воде кристаллы,
продукты распада клеток и др.
9.10.1.
Основные функции лимфатической системы и элементы ее строения
К основным функциям лимфатической системы
относятся: 1) поддержание постоянства объема и состава тканевой жидкости; 2)
обеспечение гуморальной связи между тканевой жидкостью всех органов, тканей и
кровью; 3) всасывание и перенос питательных веществ из пищеварительного канала
в венозную систему; 4) участие в иммунологических реакциях организма
посредством доставки из лимфоидных органов лимфоцитов, клеток плазматического
ряда, антител; 5) участие в ответах организма на чрезвычайные воздействия
посредством переноса в костный мозг и к месту повреждения мигрирующих из
лимфоидных органов лимфоцитов, плазмоцитов и т. д.
Лимфатическая система высших позвоночных состоит из лимфатических
сосудов, лимфатических узлов и лимфатических протоков. Все ткани,
кроме костной, нервной и поверхностных слоев кожи, пронизаны сетью
лимфокапилярных сосудов. Они начинаются петлями или слепыми выростами и
характеризуются наличием лакун в местах слияний. Диаметр капилляров колеблется
от 10 до 100 мкм. Стенки их легко растягиваются, поэтому просвет капилляров при
усиленном поступлении лимфы может увеличиваться в 2—3 раза. При этом возрастает
и их всасывающая поверхность. В обычных условиях многие капилляры находятся в
спавшемся состоянии.
При слиянии нескольких капилляров образуется лимфатический
сосуд (лимфангион). Здесь же находится и первый клапан. В стенках
сосуда между эндотелием и соединительнотканной оболочкой появляется мышечный
слой, который по мере укрупнения сосуда утолщается. В дальнейшем по ходу
сосудов в местах их сужения также находятся клапаны. Расстояние между ними
составляет 2—8 мм, а в крупных сосудах — до 15 мм. Клапаны представляют собой
парные, лежащие друг против друга складки полулунной формы. Они препятствуют
обратному току лимфы, которая отжимает их створки от стенок сосудов. Из каждого
органа или части тела выходят отводящие лимфатические сосуды, которые
направляются к регионарным лимфатическим узлам. Сосуды, по которым лимфа
поступает в узел, называют приносящими; сосуды, которые выходят из ворот
узла, называют выносящими лимфатическими сосудами.
|
|
|
Рис. 9.52 Лимфатический узел млекопитающих 1 —
капсула, 2 — трабекула, 3 —
перекладина, 4 — корковое
вещество, 5 — фолликулы, в —
приносящие лимфатические сосуды, 7 — мозговое вещество, 8 — выносящие лимфатические сосуды,
9 — ворота лимфатического
узла. |
|
|
|
Рис. 9.53 Лимфатическая
система и кровообращение млекопитающих 1 —
легкие, 2— лимфатическая система,
3 — венозная система, 4—артериальная система, 5 — ткани. |
Функциональное значение лимфатических сосудов
многообразно: они участвуют в процессах лимфообразования, которое происходит в лимфатических
капиллярах, выполняют дренажную функцию и лимфоотток.
Лимфатические узлы располагаются по ходу лимфатических сосудов и составляют вместе с ними
единую систему. У млекопитающих они имеют округлую или овальную форму (рис.
9.52), располагаются группами. Число их у собаки около 60, свиньи — 190, быка—
300, человека — около 460. Лимфатические узлы с одной стороны обычно вдавлены.
В этом месте, называемом воротами, в узел входят артерии и симпатические
нервные волокна, а выходят вены и выносящие лимфатические сосуды. Сосуды,
приносящие лимфу, входят с противоположной, выпуклой стороны узла. В связи
с таким расположением по ходу сосудов лимфатический узел представляется не
только кроветворным органом, но и своеобразным ,фильтром для оттекающей от тканей
лимфы на ее пути в венозное русло.
Лимфатические узлы являются органами лимфоцитопоэза.
В их корковом и мозговом веществе образуются В— и Т—лимфоциты (см. разд. 8) и
вырабатывается лейкоцитарный фактор, который стимулирует размножение клеток.
Зрелые лимфоциты попадают в синусы узлов и из них выносятся с лимфой в
отводящие сосуды. Узлы осуществляют также барьерно—фильтрационную функцию.
В просветах их синусов задерживаются и захватываются макрофагами поступающие с
током лимфы микробные тела и инородные частицы. Лимфатические узлы посредством
дифференцировки лимфоцитов, выработки иммуноглобулинов, образования
плазматических клеток участвуют в иммунных процессах. Они также выполняют
функцию депо лимфы, участвуют в перераспределении жидкости и форменных элементов
между кровью и лимфой.
На поперечных срезах узла различают периферическое,
более плотное корковое вещество, которое состоит из кортикальной и
паракортикальной зон, и центральное мозговое вещество. Большую часть
первого составляет область заселения В—лимфоцитов, а паракортикальную, тимус—зависимую
— Т—лимфоцитов. Лимфатические узлы имеют чувствительную и эфферентную
адренергическую и холинергическую иннервацию. Рецепторный аппарат хорошо
выражен в капсуле, трабекулах, сосудах, корковом и мозговом веществе. На пути
от периферии к коллекторам лимфа проходит, как правило, несколько узлов.
Основным коллектором
лимфатической системы, по которому лимфа оттекает в венозное русло от таза, тазовых
конечностей, стенок и органов брюшной полости, левой половины груди и
расположенных в ней органов, а также грудной конечности, является грудной
проток. Начавшись в брюшной полости, проток проникает через аортальное
отверстие диафрагмы в грудную полость и впадает в угол слияния подключичных
вен. Вторым коллектором является шейный проток, собирающий лимфу от
головы и прилегающих областей. Он также впадает в венозную систему в месте
слияния подключичных вен (рис. 9.53).
|
|
|
Рис. 9.54 Расположение регионарных лимфатических
узлов 1
— локтевая ямка,
2 — область шеи, 3 —
подмышечная ямка, 4 — паховая
область, 5 — подколенная ямка. |
9.10.2. Эволюция лимфатической системы
Лимфатическая система, обособленная от кровеносной, присуща
высшим позвоночным животным. У ланцетника и круглоротых имеется еще
недифференцированная гемолимфатическая система.
Отделение лимфатической системы от
кровеносной впервые происходит у костистых рыб, где она представлена
поверхностными и глубокими продольными, а также кишечно—брыжеечными
лимфатическими сосудами. Кроме того, между внутренними органами, перикардом и
жаберными мешками расположены лимфатические синусы.
У амфибий и рептилий появляются так
называемые лимфатические сердца. Они представляют собой сократительные
органы, в стенках которых находятся мышечные волокна. Лимфатические сердца
имеют вид одно— или многокамерных пузырьков, которые соединены с одной стороны
с лимфатическими сосудами и синусами, с другой — с венами. У лягушки таких
сердец 4, у тритона 15 боковых и несколько — в тазовой, лопаточной и других
областях. У рептилий наряду с синусами появляются сплетения лимфатических
сосудов и два задних лимфатических сердца. У неплавающих птиц лимфатические
сердца обнаруживаются только на эмбриональной стадии.
Лимфатические узлы отсутствуют у рыб,
амфибий, рептилий и появляются у водоплавающих птиц. Их лимфатические сосуды
впадают в вены в нескольких местах. У млекопитающих строение лимфатической
системы усложняется, в лимфатических сосудах появляются клапаны, возникает
большое число лимфатических узлов (рис. 9.54).
9.10.3. Состав, свойства, количество лимфы
Лимфа образуется в результате всасывания тканевой
жидкости в лимфатические капилляры. От лимфы необходимо отличать гидролимфу
— жидкость кишечно—сосудистой системы медуз, гребневиков, которая
непосредственно сообщается с жидкой средой обитания этих животных. Лимфу также
следует отличать от гемолимфы — жидкости, находящейся в сосудах и
межклеточных пространствах у животных, не имеющих замкнутой системы
кровообращения (например, у моллюсков). У млекопитающих пространство между
перепончатым лабиринтом и костной основой внутреннего уха заполнено особой
жидкостью — перилимфой, а сам перепончатый лабиринт — эндолимфой
(см. рис. 7.1).
Взятая из лимфатических протоков во время голодания
или после приема нежирной пищи лимфа представляет почти прозрачную бесцветную
жидкость (см. разд. 7.10) со средним содержанием белков 20 г/л, что уступает их
концентрации в плазме крови. Наиболее низкое содержание белков зарегистрировано
в лимфе, оттекающей от кожи, мышц, наибольшее — от печени. Этот показатель
значительно варьирует в зависимости от функционального состояния органов. Так,
лимфа кишечных лимфатических сосудов и грудного лимфатического протока после
приема жирной пищи становится молочно—белого цвета. Это происходит потому, что
в лимфе содержится взвесь капелек всосавшегося в кишке жира.
По составу лимфа отличается от капиллярного фильтрата
и плазмы крови. В ней содержатся (мкг/100 мл) анионы: CL— — 438,
НСОз— — 48,0, Н2Р04 — 1,5; катионы: Na+ — 524,
K+ — 9,8, Са2+ — 4,5, а также различные ферменты.
Лимфатическая ткань депонирует витамины. В лимфе имеются компоненты
свертывающей системы, благодаря чему она способна к быстрому свертыванию. Концентрация
остальных веществ совпадает с их содержанием в плазме крови.
Количество лимфы в организме человека составляет
примерно 1500 мл, однако ее содержание в разных органах различно и соответствует
их функции. Так, на 1 кг массы печени приходится 21—36 мл лимфы, сердца — 5—18,
селезенки — 3—12, мышц конечностей — 2—3 мл. Наиболее высокое содержание лимфы
в печени объясняется ее участием в транспорте питательных веществ из кишки.
Механизм образования лимфы основывается на процессах
фильтрации, диффузии и осмоса, разности гидростатического давления крови в
капиллярах и межтканевой жидкости. Среди этих факторов большое значение придают
проницаемости лимфатических капилляров в связи с особенностями
ультраструктурного строения их стенки и взаимоотношений с окружающей
соединительной тканью.
Существует два пути, по которым различные по
размеру частицы проходят через стенку лимфатических капилляров в их просвет —
межклеточный и через эндотелий. Первый основан на том, что межклеточные щели
стенок капилляров могут расширяться и пропускать из окружающих тканей
крупнодисперсные частицы. Межклеточные соединения могут быть открытыми и
закрытыми. Через открытые соединения, величина которых колеблется от 10 нм до
10 мкм, могут свободно проходить в зависимости от локализации и условий
функционирования органа крупные и мелкие частицы. Второй путь транспорта
веществ в лимфатический капилляр основан на их непосредственном прохождении через
цитоплазму эндотелиальных клеток с помощью микропиноцитозных пузырьков и
везикул. Прохождение жидкости и различных частиц по обоим путям осуществляется
одновременно.
Согласно классической теории Старлинга (1894), помимо
разницы гидростатического давления в кровеносных капиллярах и тканях
значительная роль в лимфообразовании принадлежит онкотическому давлению.
Повышение гидростатического давления крови способствует образованию лимфы,
напротив, увеличение онкотического давления препятствует этому.
Процесс фильтрации жидкости из крови происходит в
артериальном конце капилляра, возвращается же жидкость в кровяное русло в
венозном. Это связано, во—первых, с разницей кровяного давления в артериальном
и венозном концах капилляра, во—вторых, с повышением онкотического давления в
венозном конце капилляра.
В организме человека средняя скорость фильтрации во
всех кровеносных капиллярах составляет примерно 14 мл/мин, т. е. 20 л/сут;
скорость обратного всасывания — около 12,5 мл/мин, или 18 л/сут. Следовательно,
в лимфатические капилляры попадает 2 л жидкости в сутки.
Снижение онкотического давления плазмы крови влечет
за собой усиленный переход жидкости из крови в ткани, повышение осмотического
давления межтканевой жидкости и лимфы, сопровождается усиленным образованием
лимфы. Этот механизм особенно отчетливо выступает при накоплении в тканевой
жидкости низкомолекулярных продуктов метаболизма, например, при мышечной
работе.
Эти особенности организации стенки лимфатических
капилляров, а также соотношение гидростатического и онкотического давлений
определяют всасывание коллоидных растворов, взвесей, бактерий, инородных и
других частиц. Проницаемость капилляров может изменяться в ту или иную сторону
при различных функциональных состояниях органа и под влиянием некоторых веществ
— гистамина, пептидов и др. Она зависит также от механических, химических,
нервных и гуморальных факторов, поэтому постоянно меняется. Например, при
уменьшении количества белка в плазме крови возрастает объем лимфы, протекающей
по грудному протоку. Это связано с понижением всасывания жидкости в венозных
частях капилляров в результате падения осмотического давления крови и
повышением поступления ее в лимфатические капилляры.
У низших позвоночных лимфа продвигается посредством
автоматических сокращений расширенных участков лимфатических сосудов, имеющих
утолщенную мышечную стенку, — лимфатических сердец. У высших позвоночных и
человека образовавшаяся в капиллярах лимфа постоянно оттекает в грудной проток,
правый лимфатический, яремный, подключичный протоки (рис. 9.55). Собирая лимфу
из разных частей тела, протоки обеспечивают ее продвижение в вену.
В оттоке лимфы ведущее значение
принадлежит силе напорного и проталкивающего действия жидкости, проникающей из
межтканевого пространства в лимфатические капилляры. Этот обмен происходит на
основе гидростатического давления, под действием которого кровь движется
по микроциркуляторному руслу, а также на основе физико—химических
закономерностей диффузии и осмоса (рис. 9.56). Следовательно, обмен зависит от
разности между коллоидно—осмотическим давлением белков плазмы крови и тканевой
жидкости. Вновь образующаяся лимфа механически вытесняет ту, которая ранее
заполняла лимфатические капилляры. В мелких лимфатических сосудах давление
лимфы составляет 8—10 мм вод. ст., а у места впадения грудного протока в
венозную
|
|
|
Рис. 9.55 Схема
лимфооттока I —
плечеголовной ствол, 2 —
аорта, 3 — внутренняя яремная вена, 4
— грудной проток, 5 — левая подключичная вена, б — левая плечеголовная вена, 7 — добавочная полунепарная вена, 8 — межреберные вены, 9
— полунепарная вена, 10 —
грудной проток, II —
лимфатические сосуды, 12 —
лимфатические узлы, 13 —
цистерна грудного протока, 14 —
межреберные лимфатические узлы, 15 —
непарная вена, 16 — верхняя
полая вена, 17— правая
плечеголовная вена, 18—
правый лимфатический проток, 19 —
правые подключичные артерия и вена. |
|
|
|
Рис. 9.56 Соотношение давлений, обеспечивающих
движение жидкости в кровеносных капиллярах, межклеточном. пространстве и
лимфатических сосудах а —
отрицательное давление в межклеточном пространстве, возникающее благодаря
отсасыванию жидкости лимфатическими сосудами; б — результирующее давление, обеспечивающее движение жидкости
из капилляра в ткани; в —
результирующее давление, определяющее движение жидкости из тканей в капилляр;
ГД — гидростатическое давление ОД — онкотическое давление (в мм рт. ст.). |
|
|
|
Рис. 9.57 Движение
лимфы по лимфатическим сосудам Лимфангион
в фазах: сокращения (А),
заполнения (Б), покоя (В); а — мышечная манжета лимфангиона; о
— клапан; 1 — мембранный
потенциал и потенциал действия миоцитов лимфангиона, 2 — давление в полости, 3 — напряжение мышечной стенки.
Стрелкой показано направление движения лимфы. |
систему оно, как и в крупных венах, ниже атмосферного. Такая разница
давления также способствует оттоку лимфы.
В движении лимфы значительную роль играют ритмические
сокращения стенок самих лимфатических сосудов. Некоторые из них могут
спонтанно сокращаться с частотой 8—10 в 1 мин. Волна сокращений продольной и
циркулярной мускулатуры распространяется в центральном направлении и продвигает
лимфу через поочередно открывающиеся и закрывающиеся клапаны (рис. 9.57).
На продвижение лимфы по сосудам существенное влияние
оказывает сокращение скелетной мускулатуры, окружающей лимфатические
пути. Эти сокращения Создают своеобразный лимфатический насос, попеременно
сдавливающий и расслабляющий сосуды. Лимфооттоку способствуют изменение внутрибрюшного
давления и движение органов пищеварения, что создает непрерывный
отток лимфы в брюшных лимфатических сосудах, а также пульсация аорты и дыхательные
движения, вызывающие расширение грудного протока при вдохе и сдавливающие
его при выдохе. Существование клапанов в месте впадения протоков в вену
предотвращает заброс в них крови.
Скорость движения лимфы не одинакова в разных
областях тела, однако она значительно меньше, чем скорость движения крови в
венах. Например в шейном лимфатическом сосуде лошади она составляет 27—30
см/мин. В работающих органах отток лимфы многократно увеличивается. Лимфоотток
зависит от рефлекторных влияний. Он изменяется при повышении давления в
каротидном синусе и воздействиях на другие рефлексогенные зоны. При стимуляции
идущих к лимфатическим сосудам симпатических волокон можно наблюдать полное
прекращение движения лимфы в результате спазма лимфатических сосудов.
Одной из самых значительных дат в истории
биологической науки, в том числе и физиологии, является 1628 г. Именно в этом
году Уильям Гарвей (1576—1657) — великий английский врач, физиолог и эмбриолог
— подвел итоги многолетних исследований и доказал, что у высших животных кровь
находится в непрерывном движении по замкнутому кругу. Заслуга У. Гарвея
состоит в том, что впервые в истории науки он дал правильное во всех деталях
описание одной из важнейших функций человека и животных — кровообращения.
Гарвей опроверг гипотетические построения, созданные его предшественниками, был
первым физиологом, решившим большую проблему не на основе догадок и
размышлений, а посредством эксперимента. В своем классическом труде
«Анатомическое исследование о движении сердца и крови у животных» он писал: «Когда
я впервые обратился к вивисекции, как средству для того, чтобы изучить движения
и свойства сердца, я думал, что изучу их непосредственно наблюдая, а не из
описания других; однако я нашел, что предмет этот поистине столь тяжек, столь
полон трудности, что я почти что начал думать так же, как и Фракасториус (Джироламо Фракасторо (1478—1553)
— итальянский ученый), что движение
сердца может быть понятно только Богу. Но, наконец, исполненный огромного и
ежедневного прилежания, как можно чаще прибегая к вивисекциям и употребив для
этого большое количество животных и сделав очень много наблюдений, я думаю, что
постиг истину».
У. Гарвей допускал возврат одной и
той же крови к сердцу через посредство замкнутого цикла. Замкнутость круга
кровообращения он объяснял прямым соединением артерий и вен через посредство
мельчайших трубочек. Эти трубочки—капилляры были открыты М. Мальпиги спустя
четыре года после смерти У. Гарвея. Таким образом было найдено последнее звено
в учении о кругообороте крови.
Эволюция циркуляторных механизмов шла
несколькими параллельными путями, однако в основе всех их была выработка
способа заставить объем жидкости как можно эффективнее выполнять транспортную
функцию, обеспечивать доставку крови туда, где она необходима в данный
момент, и в соответствующем количестве.
Для низших организмов, у которых
дыхательные и питательные потребности ограничены, достаточными оказываются незамкнутые
системы, без специального насосного устройства — сердца. Однако повышение в
процессе филогенеза массы тела и двигательной активности животных привело у
моллюсков и ракообразных к появлению сердца. В такой системе сердце еще
не может создавать высокого давления и движение жидкости в определенной мере
поддерживается сокращениями соматической мускулатуры.
Рыбы обладают вполне замкнутой сосудистой системой и
вполне дифференцированным двухкамерным сердцем. Процесс дифференциации
сердца на правую и левую половину и, соответственно, этому возникновение
полного разделения кровообращения на большой и малый круги заканчивается в
основном у рептилий. У всех более высоко расположенных в эволюционном ряду
животных, как и у человека, существует четырехкамерное сердце с полным
отделением правой половины от левой и со своими общими и характерными
особенностями функциональной организации.
Сердечная мышца состоит из отдельных мышечных клеток (волокон) содержащих миофибриллы,
которые имеют поперечную исчерченность. Благодаря этому сердечная мышца по
строению похожа на скелетные мышцы. Однако функциональные свойства их несколько
различны. Сердечная мышца обладает возбудимостью, проводимостью,
сократимостью и автоматией.
Возбудимость
сердечной мышцьг проявляется при возникновении в ней возбуждения под действием
раздражителей. Сразу после действия раздражителей сердце невосприимчиво к
повторным раздражениям. Этот период невозбудимости получил название рефракторного.
Сократимость сердечной мышцы т. е. способность развивать напряжение и
укорачиваться при возбуждении' зависит не только от силы раздражителя, но и от
степени предварительного растяжения, которое связано с объемом поступающей в
сердце крови.
Особым свойством сердечной мышцы в целом является автоматия
т. е. способность возбуждаться без внешних воздействий. Однако не все мышечные
волокна обладают таким качеством. Участки, в которых расположены волокна с
наибольшей способностью к автоматии, получили название водителей ритма
сердца. Главный из них — синусный узел — находится в области впадения
полых вен в правое предсердие. В нормальных условиях сокращение всех отделов
сердца обеспечивается импульсами, возникающими в главном водителе ритма. При
нарушении его функции управление сердечной деятельностью переключается на
нижерасположенный водитель ритма, лежащий в межпредсердной перегородке около
правого предсердия и называемый предсердно—желудочковым узлом. От него
отходят особые волокна — пучок Гиса. Последний делится на две ножки,
образующие при разветвлении волокна Пуркинье. Именно эти волокна и
передают возбуждение мускулатуре желудочков. Возбуждение сердечной мышцы характеризуется
возникновением электрических токов, которые распространяются по всему телу. При
анализе ЭКГ определяют высоту и направленность ее зубцов, а также длительность
интервалов между ними.
Сердце работает как нагнетательный насос.
Сокращаясь, оно проталкивает кровь в артерии. При расслаблении сердечной
мускулатуры давление в полостях сердца снижается, что способствует притоку к
нему крови. Сердечный цикл состоит из трех фаз: общей диастолы сердца,
во время которой расслаблены и предсердия, и желудочки; систолы предсердий,
когда желудочки расслаблены и наполняются кровью; систолы желудочков, когда
кровь под большим давлением выбрасывается правым желудочком в легочную артерию,
а левым — в аорту. Длительность сердечных циклов обусловлена частотой процессов
возбуждения, возникающих в главном водителе ритма сердца — синусном узле.
Количество крови, поступающее в аорту при каждом
сокращении сердца, называют систолическим объемом. У человека в
нормальном состоянии оно равно 60—70 мл. Эта величина зависит от количества
притекающей к сердцу крови и от силы сердечных сокращений. Количество крови,
выбрасываемое сердцем в течение 1 мин, называют минутным объемом крови.
Его величина зависит от частоты сердечных сокращений и систолического объема
крови. Минутный и систолический объемы крови являются важнейшими показателями
производительности сердца.
Большинство беспозвоночных животных
имеет незамкнутую кровеносную систему, в которой давление и скорость тока низки
и изменчивы. В таких системах ток жидкости больше зависит от сокращений
соматических мышц, что автоматически обеспечивает усиление кровообращения во
время движения. Дальнейшая эволюция кровеносной системы шла в трех
направлениях: происходила дифференцировка сократительных элементов сосудов в
специальный орган — «сердце», развивалась капиллярная сеть, превращая
лакунарную систему в систему замкнутую, кровяной поток разделялся на круг,
предназначенный для снабжения тканей (большой круг), и круг,
предназначенный для обновления газового состава крови (малый круг).
Полное разделение кровообращения на
большой и малый круг заканчивается в основном у рептилий. Строение сосудистой
системы и регуляция в ней давления у всех более высоко расположенных в
филогенетическом ряду животных такое же, как у млекопитающих.
Известно, что каждый орган тела
способен эффективно работать лишь при условии адекватного кровоснабжения. Кроме
того, повышение активности органа должно сопровождаться соответствующим
увеличением кровотока. Кровоток зависит от разности гидростатического давления между
артериями и венами по обе стороны органа и от гидростатического сопротивления
току крови. Количество крови, проходящее за единицу времени через всю
сосудистую систему, тем больше, чем больше эта разность и чем меньше
сопротивление сосудов току крови. Наибольшее сопротивление создается в
артериолах.
Принято различать объемную и линейную
скорости движения крови. Под объемной скоростью кровотока понимают
количество крови, которое протекает через всю кровеносную систему за 1 мин. Эта
величина соответствует минутному объему крови. Количество крови,
протекающее за 1 мин через какой—либо отдельный орган, называют местной
объемной скоростью кровотока. Линейная скорость кровотока — скорость
движения частиц крови вдоль сосуда при ламинарном потоке. Она прямо пропорциональна
объемной скорости кровотока и обратно пропорциональна площади поперечного
сечения сосуда. Наибольшая линейная скорость движения крови наблюдается в
аорте, наименьшая — в капиллярах. Линейная скорость движения отдельных частиц
крови не одинакова, она больше в центре сосуда и меньше у стенок.
Во время каждого сокращения сердца кровь
выбрасывается в артериальное русло, сопротивление сосудов которого создает
давление, называемое кровяным давлением. В разных участках сосудистой
системы величина его не одинакова. Наибольшее давление наблюдается в аорте и
крупных артериях. В мелких артериях, артериолах, капиллярах и венах оно
постепенно снижается. Самый высокий уровень давления регистрируется в момент
завершения систолы, он называется систолическим; самый низкий — диастолическим.
Эти перепады давления при систоле и диастоле сердца вызывают толчкообразные
колебания стенок кровеносных сосудов и прилегающих к ним тканей — пульс.
Пульсовые колебания, создаваемые разницей между систолическим и диастолическим
артериальным давлением, называют волнами I порядка; изменения давления,
связанные с дыханием, — волнами II порядка; изменения, зависящие от активности
сосудодвигательного центра, — волнами III порядка.
Изменения сердечного выброса и периферического сопротивления
способны весьма существенно влиять на артериальное давление. Для его
координации в организме существуют способы сенсорного контроля за уровнем
артериального давления и возможность передавать эту информацию туда, где она
может быть интегрирована с потребностями организма и преобразована в нужный
исполнительный сигнал, направленный к сердцу и сосудам. Уровень артериального
давления воспринимается чувствительными механорецепторами
(барорецепторами), расположенными в основном в стенке аорты и каротидном
синусе. ^Эти интероцепторы реагируют на растяжение стенки сосуда разной
частотой разрядов в зависимости от артериального давления. Разряды передаются
специальным сосудодвигательным центрам продолговатого мозга.
Сосудодвигательный
центр вызывает по преимуществу
изменение симпатической вазомоторной активности, а также регулирует
симпатическую иннервацию сердца. Он состоит из депрессорной и прессорной частей
(центров). Депрессорный центр способствует снижению артериального
давления, что постигается двумя путями. Во—первых, ослаблением
симпатической стимуляции сердца и, соответственно, уменьшением сердечного
выброса. Во—вторых, снижением активности симпатических сосудосуживающих
волокон, в результате чего возникает расширение сосудов и падение их
сопротивления.
Прямо
противоположное действие оказывает прессорный центр. Посредством
увеличения сердечного выброса и периферического сопротивления он повышает
артериальное давление. Существует и третий центр, кардиоингибирующее действие
которого опосредуется идущими к сердцу волокнами блуждающего нерва. Повышение
активности этих волокон приводит к уменьшению сердечного выброса и,
соответственно, снижению артериального давления.
Сосудодвигательные центры расположены не только в продолговатом мозгу, но и в вышележащих отделах, таких как гипоталамус. Стимуляция некоторых его ядер вызывает сужение сосудов и, как следствие, повышение кровяного давления. В управлении состоянием сосудов значительную роль играет кора больших полушарий. Раздражение отдельных ее участков сопровождается изменением просвета сосудов.
У беспозвоночных о регуляции давления и тока
циркулирующих жидкостей известно мало. Наибольшего развития эта регуляция
достигла у головоногих моллюсков, имеющих замкнутую кровеносную систему с
мощным сердцем, хорошо иннервированным тормозными и возбуждающими волокнами.
Работа сердца у них и, соответственно, уровень кровяного давления зависят в
основном от давления жидкости в сердце. При сильном растяжении оно сокращается
быстро, при слабом — останавливается. У рыб кровяное давление снижается в
основном в результате уменьшения сердечного выброса, который возникает с
повышением активности волокон блуждающего нерва. Повышение давления появляется
в результате симпатического сужения периферических сосудов. В этом отношении
они отличаются от млекопитающих, у которых сердечный выброс, равно как и
периферическое сопротивление, под влиянием автономной нервной системы могут
изменяться в любом направлении.
Функциональное состояние сосудистой системы зависит
наряду с нервной регуляцией и от гуморальных влияний. Наиболее сильное
воздействие оказывают адреналин, вазопрессин, ангиотензин II, некоторые ионы и
продукты тканевого метаболизма. Адреналин и вазопрессин суживают мелкие артерии
и снижают капиллярный кровоток некоторых органов. Ионы калия, молочная,
угольная кислоты, АТФ расширяют их. Аналогичный эффект оказывают также
ацетилхолин и гистамин.
Механизмы, регулирующие
уровень кровяного давления, крайне сложны и все еще до конца не поняты.
Ананин В. Ф. Биорегуляция человека. В 10 т. Т. 1: Биорегуляция сердца.
М., 1994.
Аничков С. В., Сапронов Н. С. Фармакология сердца и
сосудов. М., 1984.
Аринчин Н. И., Борисович Г.
Ф.
Микронасосная деятельность скелетных мышц при их растяжении. Минск,1986. Бобрик И. И., Шевченко Е. А., Черкасов В. Г.
Развитие кровеносных и лимфатических сосудов. Киев, 1991.
Булекбаева Л. Э. Сравнительная физиология лимфатической системы. Алма—Ата,
1985.
Гайтон А. Физиология кровообращения. Минутный объем сердца и его
регуляция. М., 1969.
Гарвей В. Анатомическое исследование о движении сердца и крови у
животных. Л., 1948.
Гоффман Б.. Крейнфилд П. Электрофизиология сердца. М., 1962.
Гуревич М. И., Бернштейн С. А. Основы гемодинамики. Киев,
1979.
Дворецкий Дж. П.. Ткаченко Б. И. Гемодинамика в легких. М.,
1987.
Джонсон П. Периферическое кровообращение. М., 1982.
Изаков В. Я., Иткин Г. П., Мархасин В. С. и др. Биомеханика сердечной
мышцы. М., 1981.
Каро К., Педли Т., Шротер Р., Сид У. Механика кровообращения. М.,
1981.
Конради Г. П. Регуляция сосудистого тонуса. Л.,1973.
Кульчицкий К. И., Соколов В. В., Марушенко Г. Н. Клапаны сердца. Киев, 1990.
Куприянов В. В., Миронов В. А., Миронов А. А., Гурина О. Ю. Ангиогенез: Образование,
рост и развитие кровеносных сосудов. М., 1993.
Методы исследования функционального состояния сердечно—сосудистой
системы у человека / Сост.
О. С. Глазачев и др. М., 1991.
Мчедлишвили Г. И. Микроциркуляция крови: Общие закономерности
регулирования и нарушений. Л., 1989.
Ноздрачев А. Д. Физиология вегетативной нервной системы. Л., 1983.
Ноздрачев А. Д., Поляков Е. Л. Анатомия лягушки. М., 1994.
Ноздрачев А. Д., Поляков Е. Л. Анатомия кошки. СПб., 1998.
Ноздрачев А. Д.. Поляков Е. Л., Лапицкий В. П.,
Осипов Б. С., Фомичев Н. И. Анатомия беспозвоночных: пиявка, прудовик,
дрозофила, таракан, рак. СПб., 1999. .
Ноздрачев А. Д., Чернышева М. П. Висцеральные рефлексы. Л.,
1989.
Ноздрачев А. Д., Чумасов Е. И. Периферическая нервная
система. СПб., 1999.
Ноздрачев А. Д., Янцев А. В. Автономная передача. СПб. —
1995.
Орлов В. Н. Руководство по электрокардиографии. М., 1999.
Орлов Р. С.. Борисов А. В., Борисова Р. П. Лимфатические сосуды:
структура и механизмы сократительной активности. Л., 1983.
Осадчий Л. И. Положение тела и регуляция кровообращения. Л., 1982.
Педли Т. Гемодинамика крупных кровеносных сосудов. М. 1983.
Рашмер Р. Динамика сердечно—сосудистой системы. М.1981
Рощевский М. П. Эволюционная электрокардиология. Л., 1972.
Руководство по внутренним болезням. Болезни органов кровообращения
/ Под ред. Е. И. Чазова. М.,1997.
Руководство по кардиологии. В 4 т. / Под ред. Е. И. Чазова.
М., 1982. Теплое С. И. Кровоснабжение и функция органов. Л., 1987.
Титомир Л. И., Кнеппо П. Математические моделирования биоэлектрического
генератора сердца.М., 1999.
Удельное М. Г. Физиология сердца. М., 1975.
Физиология кровообращения. Физиология сердца / Отв. ред. Е.
Б. Бабский. Л., 1980. Физиология кровообращения. Физиология сосудистой системы
/ Отв. ред. Б. И. Ткаченко. Л., 1984.
Физиология человека. В 3 т. / Под ред. Р. Шмидта, Г. Тевса.
М., 1996.
Физиология человека. В 2 т. / Под ред. В. М. Покровского, Г.
Ф. Коротько. М., 1997.
Фолков В., Нил Э. Кровообращение. М., 1976.
Швалев В. Н., Сосунов А. А., Гуски Г. Морфологические основы
иннервации сердца. М., 1992.
Шмаков Д. Н., Рощевский М. П. Активация миокарда.
Сыктывкар, 1997.
Шмидт—Ниельсен К. Физиология животных. Приспособление и среда. В 2 кн.
М., 1982.
Шуба М. Ф., Кочемасова Н. Г. Физиология сосудистых
гладких мышц. Киев, 1988.
Эккерт Р., Рэнделл Д.. Огастин Дж. Физиология животных.
Механизмы и адаптация. В 2 т. М., 1991.
Эман А.А. Биофизические основы измерения артериального давления. Л.,
1983.