8 ФИЗИОЛОГИЯ
ИММУННОЙ СИСТЕМЫ
ВЕХИ ИСТОРИИ
1798 — Э. Дженнер (Е. Jenner, Великобритания) сделал сообщение о возможности
предупреждения заболевания натуральной оспой путем прививки людям оспенного
материала от больных коров.
1883 — И. И. Мечников (Россия) создал первую экспериментально
обоснованную фагоцитарную теорию иммунитета.
1890 — Э. фон Беринг (Е. v. Behring, Германия)
предложил способ иммунизации антитоксическими сыворотками; в 1901 г. присуждена
первая Нобелевская премия по физиологии или медицине за работы по сывороточной
терапии при лечении дифтерии.
1913 — Ш. Рише (Ch. Richet, Франция) — Нобелевская премия за открытие
анафилаксии (1902).
1919 — Ж. Борде (J. Bordet, Бельгия) — Нобелевская премия за открытие антигенной
специфичности.
1960 — М. Бернет (М. Burnet, Австралия) и П. Медавар (Р. Medawar, Великобритания) — Нобелевская премия за открытие
искусственной иммунной толерантности.
1972 — Дж. Эдельман (G. Edelman, США) и Р.
Портер (R. Porter, Великобритания) — Нобелевская премия за установление
химического строения антител.
1980 — Б. Бенасерраф (В. Benacerraf, США), Ж. Доссе (J. Dausset, Франция) и Дж. Снелл (G. Snell, США) —
Нобелевская премия за открытие способа заменять дефектные гены и создавать
новые популяции иммунных клеток.
1984 — Н. Ерне (N. Jrne, Дания) — Нобелевская премия за создание новаторской
теории «сетей» в иммунологии.
1984 — Г. Келлер (G. Kohler, ФРГ) и С. Милстейн (С. Milstein, Великобритания—Аргентина) — Нобелевская премия за открытие
и разработку принципов выработки моноклональных антител с помощью гибридов.
1987 — С. Тонегава (S. Tonegawa, Япония) —
Нобелевская премия за открытие принципа образования антител (открытие генов
рецепторов Т—лимфоцитов).
1990 — Дж. Марри и Э. Томас (J. Murray, Е. Thomas, США) — Нобелевская премия за открытие в области
трансплантации органов и клеток при лечении заболеваний человека.
1996 — П. Догерти (Р. Doherty, США) и Р. Цинкернагель (R. Zinkernagel,
Швейцария) — Нобелевская премия за открытие специфичности клеточно—опосредованной
иммунной защиты.
1997 — С. Прузинер (S. Prusiner, США) —
Нобелевская премия за открытие прионов — новых биологических принципов
инфекций.
Иммунная система, наряду с другими регуляторными системами — нервной и
эндокринной, играет важную роль в поддержании постоянства внутренней среды организма
и обеспечении его адаптации к изменяющимся условиям внешней среды. В отличие от
нервной и эндокринной систем, контролирующих количественный гомеостаз, иммунная
система охраняет качественное постоянство генетически предетерминированного
клеточного и гуморального состава организма.
Иммунная
система обеспечивает: а) защиту организма от внедрения чужеродных клеток и от
возникших в организме модифицированных клеток (например, злокачественных); б)
уничтожение старых, дефектных и поврежденных собственных клеток, а также
клеточных элементов, не характерных для данной фазы развития организма; в)
нейтрализацию с последующей элиминацией (от лат. elimino, eliminatum — выносить
за порог, удалять) всех генетически чужеродных для данного организма
высокомолекулярных веществ биологического происхождения (белков, полисахаридов,
липополисахаридов и т. д.);
г)
продукцию разнообразных биологически активных молекул, от простейших до весьма
сложных, обладающих широким спектром эффектов и, в отличие от гормонов, поддерживающих
не гомеостатический баланс, а сложную ответную реакцию всего организма на
внедрение чужеродных клеток, вирусов, иммунное повреждение, а также воспаление,
репарацию и регенерацию (цитокинов, ростовых факторов, медиаторов воспаления и
т. д.); д) вовлечение для оптимизации реализуемых ею защитных реакций нервной и
эндокринной систем.
Основные компоненты иммунной
системы работают в тесной связи с многочисленными клеточными элементами и
гуморальными факторами, не принимающими непосредственного участия в иммунных
реакциях. Иммунокомпетентные клетки и продуцируемые ими факторы, помимо
защитной, могут выполнять в организме другие функции. Известно, что лимфоциты
принимают участие в кишечном пищеварении за счет большого запаса содержащейся в
них липазы, участвуют в образовании белков плазмы крови, осуществляют транспорт
ДНК к тканям. Иммунная система не имеет четких границ в смысле задействованных
в ней компонентов и для выполнения главной задачи — защиты организма — может
привлекать многие другие системы.
8.1.
КОМПОНЕНТЫ ИММУННОЙ СИСТЕМЫ
К основным
клеточным иммунным компонентам относятся все лейкоциты крови, представляющие
собой так называемые иммунокомпетентные клетки. Зрелые лейкоциты
объединяют пять популяций клеток:
лимфоциты,
моноциты, нейтрофилы, эозинофилы и базофилы. Иммунокомпетентные клетки можно
обнаружить практически в любой части организма, однако сконцентрированы они
преимущественно в местах своего образования
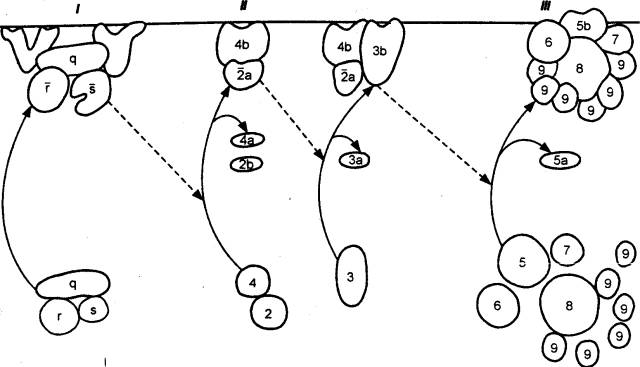
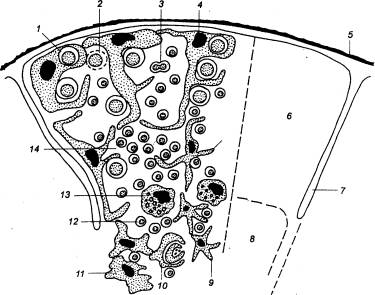
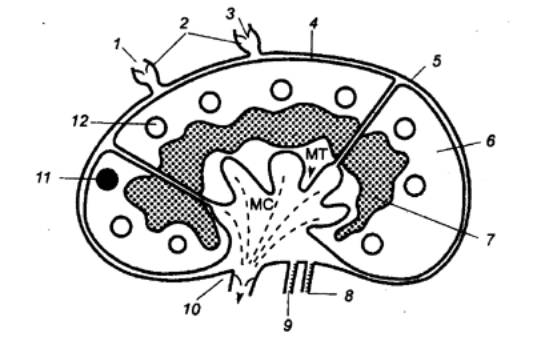
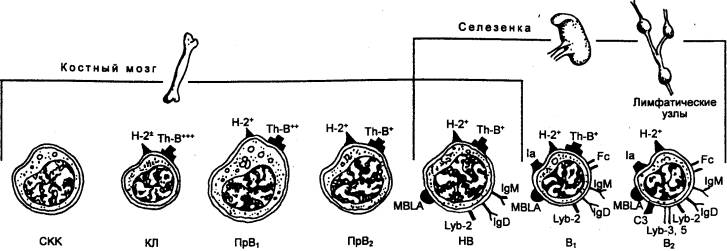
первичных и вторичных лимфоидных органах (рис. 8.1). Первичным местом
образования всех этих клеток является орган кроветворения — красный костный
мозг, в синусах которого образуются и проходят полный цикл дифференцировки
моноциты и все гранулоциты (нейтрофилы, эозинофилы, базофилы). Здесь же
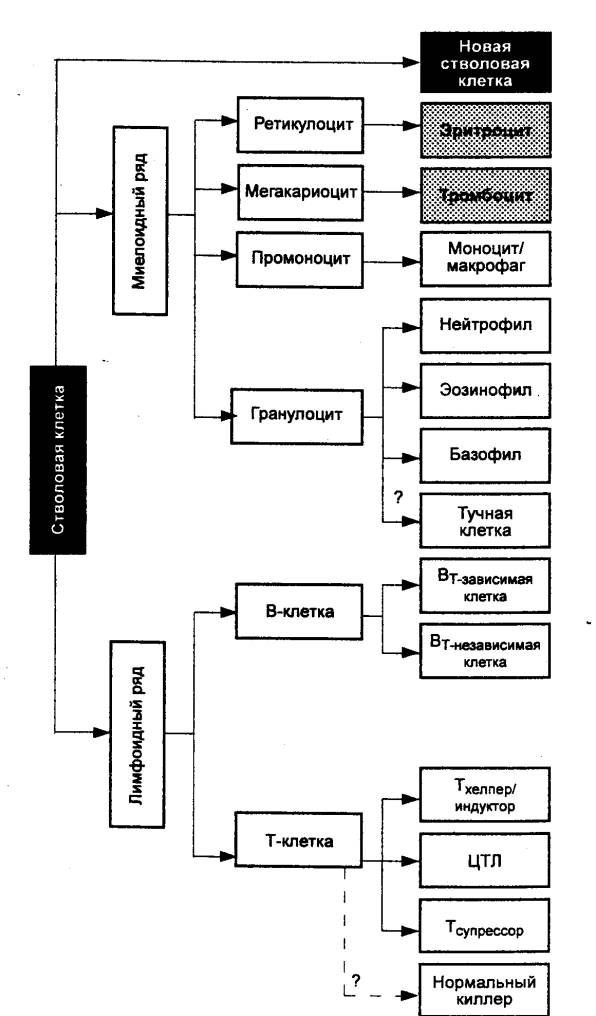
начинается дифференцировка лимфоцитов. Лейкоциты всех популяций происходят от
единой костномозговой полипотентной стволовой кроветворной клетки, пул
которой является самоподдерживающимся (рис. 8.2).
Различные направления
дифференцировки стволовых клеток определяются специфическим микроокружением их
в очагах костномозгового кроветворения и продукцией специфических
гемопоэтических факторов, в том числе колониестимулирующих, кейлонов,
простагландинов и других. Помимо указанных факторов, в систему контроля за
образованием и дифференцировкой иммунокомпетентных клеток в костном мозге
входит группа общеорганизменных регуляторных веществ, важнейшими из которых
являются гормоны и медиаторы нервной системы.
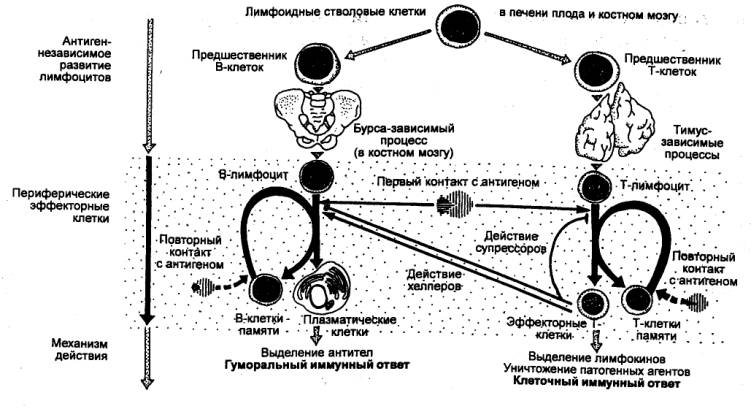
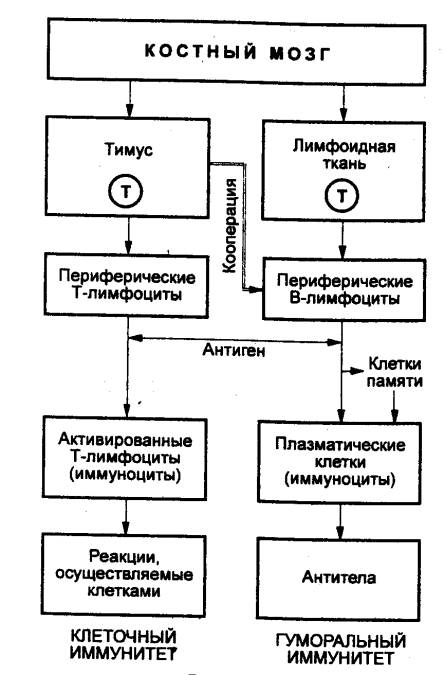
Лимфоциты в организме представлены
двумя большими субпопуляциями, которые различаются по гистогенезу и иммунным
функциям. Это Т—лимфоциты, обеспечивающие клеточный иммунитет, и В—лимфоциты,
ответственные за
осуществление антителообразования, т.
е. гуморального иммунитета. Если В—лимфоциты весь цикл дифференцировки до
зрелых В—клеток проходят в костном мозге, то Т—лимфоциты на стадии пре—Т—лимфоцитов
мигрируют из него по кровотоку в другой первичный лимфоидный орган — тимус, в
котором заканчивается их дифференцировка с образованием всех клеточных форм
зрелых Т—клеток.
Принципиально отличается от них
особая субпопуляция лимфоцитов — нормальные (естественные) киллеры (НК)
и К—клетки. НК являются цитотоксическими клетками, осуществляющими
разрушение клеток—мишеней (главным образом, опухолевых клеток и клеток,
зараженных вирусами) без предварительной иммунизации, т. е. в отсутствие
антител. К—клетки способны разрушать клетки—мишени, покрытые небольшим
количеством антител.
После созревания иммунокомпетентные
клетки, выходят в кровоток, по которому моноциты и гранулоциты мигрируют в
ткани, а лимфоциты направляются во вторичные лимфоидные органы, где происходит
антигензависимая фаза их дифференцировки. Кровеносная система — основная
магистраль транспорта и рециркуляции иммунных компонентов, в том числе
иммунокомпетентных клеток. В крови, как правило, не происходит никаких
иммунологических реакций. Кровоток только доставляет клетки к месту их
функционирования.
Гранулоциты
(нейтрофилы, эозинофилы, базофилы) после созревания в костном мозге выполняют
лишь эффекторную функцию, после однократного выполнения которой они гибнут. Моноциты
после созревания в костном мозгу оседают в тканях, где образовавшиеся из них
тканевые макрофаги также выполняют эффекторную функцию, но в течение
длительного периода и многократно. В отличие от всех других клеток, лимфоциты
после созревания их в костном мозгу (В—клетки) или тимусе (Т—клетки) поступают
во вторичные лимфоидные органы (рис. 8.3), где
|
|
|
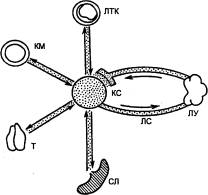
Рис. 8.1 Лимфомиелоидный
комплекс КМ — костный мозг; КС — кровеносные
сосуды; ЛТК — лимфоидная ткань кишки; ЛС — лимфатические сосуды; ЛУ —
лимфатические узлы; СЛ — селезенка; Т — вилочковая железа (тимус). |
|
|
|
|
Рис. 8.2 Полипотентная стволовая кроветворная клетка и ее потомки ЦТЛ — цитотоксический Т—лимфоцит (Т—киллер). |
|
|
|
|
Рис. 8.3 Схема
образования Т— и В—лимфоцитов и их участия в клеточном и гуморальном
иммунитете |
основной их функцией является размножение
в ответ на антигенный стимул с появлением короткоживущих специфических
эффекторных клеток и долгоживущих клеток памяти. 'Иммунологическая память —
способность организма отвечать на повторное введение антигена иммунной
реакцией, характеризующейся большей силой и более быстрым ответом, чем на
первую иммунизацию.
Вторичные лимфоидные органы разбросаны по всему организму,
чтобы обслуживать все ткани и участки поверхности. К вторичным лимфоидным
органам относятся селезенка, лимфатические узлы, органные скопления лимфоидной
ткани у слизистых оболочек — червеобразный отросток (аппендикс), пейеровы
бляшки, миндалины и другие образования глоточного лимфоидного кольца солитарные
(одиночные) .лимфоидные фолликулы стенок кишки и влагалища, а также диффузные скопления
лимфоидных клеток в субэпителиальных пространствах всех слизистых оболочек
организма и новообразованные очаги лимфоидной ткани в грануляционной ткани
вокруг хронических очагов воспаления.
Во вторичных
лимфоидных органах Т— и В—лимфоциты впервые контактируют с чужеродными для
организма антигенами. Такой контакт осуществляется преимущественно в лимфоидной
ткани, по месту поступления антигена. После контакта происходит размножение
клонов (от греч. klon — росток,
отпрыск) Т— и В—клеток,
специфичных к данному антигену, и дифференцировка большей части клеток этих
клонов в конечные эффекторные короткоживущие (Т—эффекторы из Т—лимфоцитов и
плазматические клетки из В—лимфоцитов). Часть Т— и В—лимфоцитов этих
специфических к антигену клонов размножается, не переходя в короткоживущие
эффекторные клоны, и превращается в клетки иммунологической памяти.
Последние частично мигрируют в другие вторичные лимфоидные органы, в результате
чего в них возникает повышенный уровень лимфоцитов, специфичных к антигену,
атаке которого организм подвергся хотя бы один раз. Благодаря этому создается
иммунологическая память на конкретный антиген во всей иммунной системе.
Поступление лимфоцитов
из кровотока во вторичные лимфоидные органы жестко контролируется. Существенная
часть зрелых Т— и В—лимфоцитов постоянно циркулирует в кровотоке между
лимфоидными органами (так называемые рециркулирующие лимфоциты). Под
рециркуляцией лимфоцитов понимают процесс миграции лимфоцитов из крови в органы
иммунной системы, периферические ткани и обратно в кровь (рис. 8.4). Лишь
небольшая часть лимфоцитов относится к нерециркулирующему пулу.
Функциональное назначение
рециркуляции лимфоцитов состоит в осуществлении постоянного «иммунного надзора»
тканей организма иммунокомпетентными лимфоцитами, в эффективном обнаружении
чужеродных и измененных собственных антигенов и снабжении органов
лимфоцитопоэза информацией о появлении антигенов в различных тканях. Различают
быструю рециркуляцию (осуществляется в течение нескольких часов) и медленную
(длится неделями). В ходе быстрой рециркуляции лимфоциты крови специфически
связываются со стенкой специализированных сосудов, расположенных в лимфоидных
органах, — посткапиллярных венул с высоким эндотелием — и далее мигрируют через
эти эндотелиальные клетки в лимфоидную ткань, затем в лимфатические сосуды и
через грудной лимфатический проток возвращаются в кровь. Этим путем мигрирует
около 90% лимфоцитов, имеющихся в лимфе грудного протока. При медленной
рециркуляции лимфоциты крови мигрируют через посткапиллярные венулы с плоским
эндотелием, характерные для неиммунных органов, в различные периферические
ткани, затем попадают в лимфатические сосуды, лимфатические узлы и через
лимфоток в грудной лимфатический проток снова в кровь. Таким путем
рециркулирует примерно 5—10% лимфоцитов, содержащихся в лимфе грудного протока.
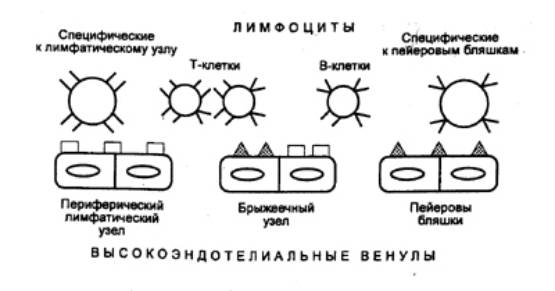
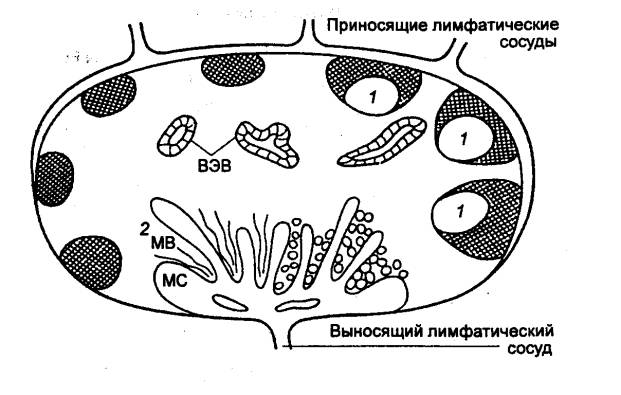
Специфическое связывание лимфоцитов
со стенками посткапиллярных венул с высоким эндотелием происходит благодаря
наличию на поверхности эндотелиальных клеток определенных молекул и
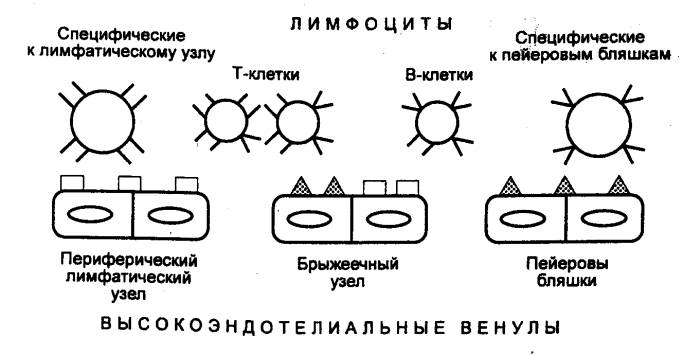
соответствующих им рецепторов на Т— и В—лимфоцитах (рис. 8.5). Этот механизм
обеспечивает избирательное накопление в лимфоузлах и других вторичных
лимфоидных органах лимфоцитов определенных популяций. В пейеровых бляшках
содержится около 70% В—лимфоцитов и 10—20% Т—лимфоцитов, в то же время в
периферических лимфоузлах, наоборот, около 70% Т— и 20% В—клеток. Многие Т— и В—лимфоциты,
активированные антигеном, покидают место, где они были активированы, а затем
после циркуляции в кровотоке возвращаются в те же или близкие к ним лимфоидные
органы. Такая закономерность лежит в основе местного иммунитета органов
и тканей. Среди рециркулирующих лимфоцитов большей
|
|
|
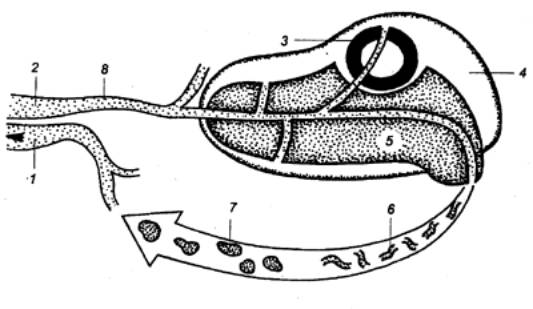
Рис. 8.4 Пути рециркуляции
лимфоцитов Белые стрелки — быстрая рециркуляция.
Черные стрелки — медленная рециркуляция. ВЛС — выносящий лимфатический сосуд;
ГП — грудной лимфатический проток; КС — кровеносный сосуд; ПКВ —
посткапиллярные венулы с высоким эндотелием; ПЛС — приносящий лимфатический сосуд, ЛС — лимфатический
сосуд. |
|
|
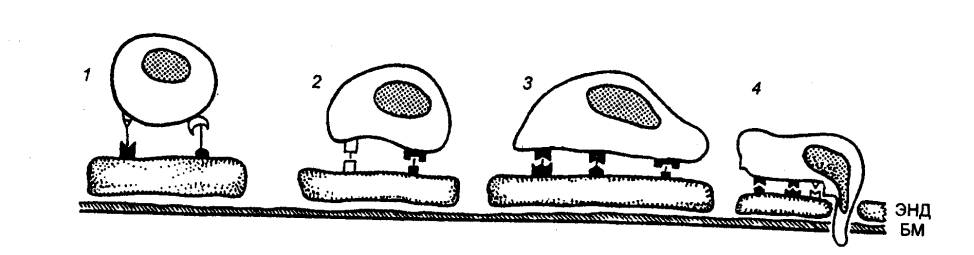
|
Рис. 8.5 Гипотетическая модель механизмов, обеспечивающих органную
специфичность миграции лимфоцитов Заселенность
определенных органов теми или иными субпопуляциями лимфоцитов регулируется процессами
избирательного узнавания посткапиллярных венул с высоким эндотелием. |
скоростью миграции обладают Т—лимфоциты и клетки
иммунологической памяти обоих типов.
Непосредственное участие в иммунной защите принимают также клетки
кожного и слизистого покровов, создающие механический барьер на пути
чужеродного антигена. В качестве механических факторов неспецифических
защитных механизмов можно рассматривать слущивание (десквамацию) клеток
поверхностных слоев многослойных эпителиев, выработку слизи, покрывающей
слизистые оболочки, биение ресничек, осуществляющее транспорт слизи по
поверхности эпителия (в респираторном тракте — мукоцилиарный транспорт).
Микробы удаляются с поверхности эпителиев также током слюны, слез мочи и других
жидкостей.
В осуществлении защиты организма от внедрения чужеродных клеток
участвуют клетки, синтезирующие разнообразные иммунологически активные
вещества (например, клетки сальных желез вырабатывают жирные кислоты клетки
потовых желез — молочную кислоту, низкое значение рН которой обеспечивает
антимикробное действие). Во многих секретах, продуцируемых клетками организма,
содержатся бактерицидные компоненты, такие как соляная кислота в желудочном
соке, спермин и цинк в сперме, лактопероксидаза в молоке, лизоцим в слезах,
носовых выделениях и слюне. Известен также механизм микробного антагонизма,
сущность которого состоит в том, что нормальная бактериальная флора человека
может угнетать рост многих потенциально патогенных микроорганизмов и грибов
вследствие конкуренции за необходимые питательные вещества или выработки таких
соединений, как колицины или кислоты. Например, патогенная флора влагалища
угнетается молочной кислотой, которая вырабатывается одним из видов бактерий—комменсалов.
Повреждение последних с помощью антибиотиков повышает риск инфицирования
паразитическими грибами и бактериями.
К гуморальным иммунным компонентам относятся самые разнообразные
иммунологически активные молекулы, от простых до весьма сложных, которые
продуцируются иммунокомпетентными и другими клетками и участвуют в защите
организма от чужеродного или своего дефектного. Среди них, прежде всего,
следует выделить вещества белковой природы — иммуноглобулины, цитокины, систему
компонентов комплемента, белки острой фазы, интерферон и другие. К иммунным
компонентам относятся ингибиторы ферментов, подавляющие ферментативную
активность бактерий, ингибиторы вирусов, многочисленные низкомолекулярные
вещества, являющиеся медиаторами иммунных реакций (гистамин, серотонин,
простагландины и другие). Огромное значение для эффективной защиты организма
имеют насыщенность тканей кислородом, рН среды, наличие Са2+ и Mg2+ и других
ионов, микроэлементы, витамины и др.
8. 2. МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОГО (ВРОЖДЕННОГО) ИММУНИТЕТА
Неспецифические (врожденные) защитные механизмы представляют
собой совокупность всех физиологических факторов, способных а) предотвратить
попадание в организм или б) нейтрализовать и разрушать проникшие в него
чужеродные вещества и частицы или образовавшиеся в нем собственные измененные
клетки. Эти механизмы не обладают специфичностью в отношении воздействующего
агента.
Помимо упоминавшихся механических и
химических факторов существует несколько других способов защиты: фагоцитоз
(«поедание» клетками), внеклеточное уничтожение зараженных вирусами и
опухолевых клеток с помощью цитотоксических факторов (клеточная
цитотоксичностъ) и разрушение чужеродных клеток с помощью растворимых
бактерицидных соединений.
Фагоцитоз представляет собой
филогенетически наиболее древнюю иммунную реакцию и является первой реакцией
иммунной системы на внедрение чужеродных антигенов, которые могут поступать в
организм в составе бактериальных клеток или вирусных частиц, а также в виде
высокомолекулярного белка или полисахарида. Макрофаги и моноциты —
древние клетки иммунной системы. Последние являются циркулирующими в
периферической крови предшественниками макрофагов, функции которых разнообразны
и не исчерпываются потребностями иммунной защиты организма.
Впервые на защитную
функцию макрофагов указал И. И. Мечников, открывший явление фагоцитоза и
получивший за это Нобелевскую премию 1908 г. В настоящее время известна другая
фундаментальная роль макрофагов — представление этими клетками антигенов
лимфоцитам. Без этой функции макрофагов невозможно специфическое
распознавание чужеродного антигена. Кроме того, макрофаги являются продуцентами
многочисленных медиаторов иммунных реакций (интерлейкины, простагландины), а
также белков системы комплемента.
Основой эволюционного
становления фагоцитоза как иммунологического феномена явилась пищеварительная
функция. Предковые одноклеточные организмы поглощали и переваривали чужеродные
вещества внешней среды с целью питания. Такой тип питания сохранился у
современных протозоа, губок и кишечнополостных. Источником питания, возможно,
служили не только неструктурированные вещества, но и прокариоты, среди которых
встречается много патогенных микроорганизмов. Несмотря на совершенствование в
филогенезе механизмов специфической иммунной защиты, фагоцитарная функция амебоцитов—макрофагов
сохранилась в эволюции от одноклеточных до высших многоклеточных, включая
млекопитающих.
Моноциты. Основой всей моноцитарно—фагоцитарной
системы (МФС) является популяция иммунокомпетентных клеток — моноциты. В
периферической крови человека в нормальных условиях содержится обычно 0,2—0,8 •
109 этих клеток в 1 л. После недолгого пребывания в крови моноциты
мигрируют в ткани, где формируют МФС. Моноциты присутствуют повсюду — в
соединительной ткани, вокруг базальных мембран мелких кровеносных сосудов,
высокое содержание их обнаруживается в легких (альвеолярные макрофаги) и печени
(клетки Купфера). Макрофаги выстилают синусоиды селезенки и медуллярные
|
|
|
Рис. 8.6 Основные фазы фагоцитоза
(1—8) и уничтожение бактерии |
синусы лимфатических узлов.
Моноцитарное происхождение имеют мезангиальные клетки почечных клубочков,
микроглиальные клетки мозга и остеокласты костной ткани. Моноциты, как правило,
мигрируют в ткани диффузно, хаотично. В случае появления клеток, несущих
чужеродную информацию, возникает хемотаксический сигнал, направляющий и
ускоряющий движение моноцитов из кровотока и окружающих тканей. Макрофаги и
некоторые другие клетки МФС живут около 2 месяцев, а некоторые субпопуляции —
многие годы. Полагают, что именно этими долгоживущими клетками определяется
пожизненная фиксация татуировки и «черное легкое» курильщиков. Внесосудистый
пул клеток МФС превышает пул моноцитов циркулирующих в крови, примерно в 25
раз. Наиболее богаты ими печень, легкие, селезенка. Во многих тканях (например,
в мышечных) плотность расположения макрофагов исключительно низка.
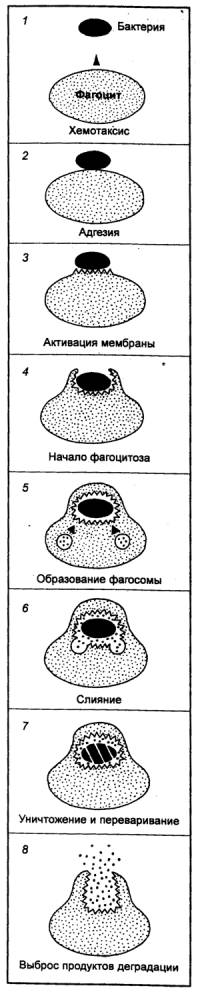
Механизм фагоцитоза однотипен и включает 8 последовательных
фаз (рис. 8.6): 1) хемотаксис (направленное движение фагоцита к объекту), 2)
адгезия (прикрепление к объекту), 3) активация мембраны (актин—миозиновой
системы фагоцита), 4) начало собственно фагоцитоза, связанное с образованием
вокруг поглощаемой частицы псевдоподий, 5) образование фагосомы (поглощаемая
частица оказывается заключенной в вакуоль благодаря надвиганию на нее
плазматической мембраны фагоцита подобно застежке—молнии, 6) слияние фагосомы с
лизосомами, 7) уничтожение и переваривание, 8) выброс продуктов деградации из
клетки.
Фагоцитозу часто предшествует процесс опсонизации (от греч. opsoniazo — снабжать пищей, питать) объекта (клетки, несущей чужеродную
информацию). Инициатором этого процесса является образование на поверхности клетки
комплекса антиген—антитело. Опсонизация обеспечивается присутствием небольшого
количества в организме молекул антител («нормальные антитела»). Антитела,
локализующиеся на поверхности чужеродной клетки, стимулируют активацию и
присоединение к ним белков системы комплемента. Образовавшийся комплекс
действует как активатор остальных стадий фагоцитоза, стимулирует прямо или
через посредство других клеток образование веществ, усиливающих эффект
опсонизации чужеродной клетки.
Хемотаксис. Чужеродные клетки (опсонизированные
или неопсонизированные) посылают в окружающую среду хемотаксические сигналы, в
направлении которых фагоцит начинает двигаться. В качестве хемотаксических
факторов рассматривается целый ряд веществ, в том числе продукты
метаболизма микроорганизмов. Считается, что на ранних этапах эволюции каждый из
этих факторов действовал самостоятельно. У высших организмов, в том числе у
человека, все они действуют в комплексе, последовательно включаясь и усиливая
друг друга. Пусковым фактором является комплекс антиген—антитело, определяющий
высокую специфичность суммарного хемотаксического сигнала. На этот сигнал
приходят первые фагоцитирующие элементы, которые, активируя другие
иммунокомпетентные клетки, стимулируют их к выработке медиаторов, усиливающих
хемотаксис. Далее хемотаксический потенциал усиливается за счет
новообразованных антител, усиления образования комплексов антиген—антитело, а
также ряда факторов, образующихся при разрушении макрофагами сосудов и тканей в
воспалительном очаге. Этот хемотаксический сигнал второго порядка (развитого
очага воспаления) обеспечивает поддержание в нем активной работы за счет
поступления новых порций иммунокомпетентных клеток. Достигнув очага воспаления,
макрофаг останавливается под влиянием фактора торможения миграции
лейкоцитов, вырабатываемого Т—лимфоцитами—хелперами. Исчезновение в очаге
воспаления чужеродных антигенов, начало процессов регенерации ведет к резкому
уменьшению хемотаксического стимула и появлению продуктов, представляющих собой
отрицательный хемотаксический сигнал. В результате этого новые фагоциты
перестают мигрировать в воспалительный очаг, а оставшиеся жизнеспособные
рассеиваются по всей ткани.
Адгезия. Акт
адгезии включает две фазы: распознавание чужеродного (специфический процесс) и
прикрепление, или собственно адгезию (неспецифический процесс). Адгезия
фагоцитирующей клетки к объекту фагоцитоза происходит крайне медленно в том
случае, если отсутствует предварительное специфическое распознавание чужеродных
клеток. У высших организмов адгезия практически всегда идет с включением
специфического компонента. Для активации этого процесса необходимо небольшое
количество иммуноглобулинов, которые постоянно присутствуют в организме как
нормальные антитела.
Захват
(собственно фагоцитоз). Важная роль в осуществлении этого этапа фагоцитоза
принадлежит специфическим компонентам иммунной реакции. Известно, что захват
неопсонизированных частиц идет медленно, причем часть из них вообще не
фагоцитируется. Наиболее сильными опсонинами являются иммуноглобулины. Специфичность
в осуществлении фагоцитоза появляется в ходе эволюции как надстройка,
физиологически связанная с уже имеющейся иммунной системой. В процессе
фагоцитоза плазматическая мембрана макрофага при помощи образованных ею
выступающих складок захватывает объект фагоцитоза и обволакивает его.
Образующаяся при этом небольшая вакуоль называется фагосомой. В
дальнейшем фагосома отрывается от поверхности мембраны и перемещается в
цитоплазму.
Киллинг
(убийство). В фагосоме захваченная чужеродная клетка гибнет. Для осуществления
киллинга макрофаг продуцирует и секретирует в фагосому реакционноспособные
производные кислорода.
Переваривание. Последний
этап фагоцитоза — переваривание захваченного и убитого материала. Для этого с
фагосомой, содержащей объект фагоцитоза, объединяются лизосомы, которые
содержат более 25 различных ферментов, в число которых входит большое
количество гидролитических энзимов. В фагосоме происходит активация всех этих
ферментов, так называемый метаболический взрыв, в результате которого
фагоцитированный объект переваривается. Часть молекул антигена при этом
разрушается не полностью, их антигенная активность может существенно
возрастать. Далее фагосома с остаточным антигеном выбрасывается на поверхность
клетки, высвобождая иммуногенный антиген, что имеет важное значение для
индукции лимфоцитами специфического иммунного ответа.
Нейтрофилы. Главный
барьер против микробных инфекций представляют нейтрофилы — популяция
лейкоцитов, иначе называемая микрофагами, или микрофагоцитами. Они имеют
много общего с другими форменными элементами крови гемопоэтического стволового
предшественника. В крови человека нейтрофилы доминируют среди остальных
лейкоцитов. Они представляют собой неделящиеся короткоживущие клетки с
сегментированным (более зрелые сегментоядерные нейтрофилы) и несегментированным
(менее зрелые палочкоядерные нейтрофилы) ядром и набором гранул, различающихся
по морфологии, гистогенезу, биохимическому составу, плотности и скорости
функциональной мобилизации. Примерно 70% нейтрофилов не циркулируют в крови, а
прикреплены к эндотелию сосудов. Главный резервуар пристеночных нейтрофилов —
микрососуды легких: число депонированных здесь клеток в несколько раз
превосходит количество циркулирующих нейтрофилов.
Срок
пребывания нейтрофилов в кровотоке составляет около 6,5 ч. Далее нейтрофилы,
проникая через эндотелий сосудов, попадают в ткани, где и заканчивают свое
существование в течение 3—5 сут, осуществляя свои эффекторные функции, очень
похожие на те, которые присущи макрофагам. Значительная часть нейтрофилов
приходит к эпителию слизистых оболочек и, проникая через него, заканчивает свой
жизненный цикл в слизистом надэпителиальном слое (срок жизни таких нейтрофилов
исчисляется часами).
У
нейтрофилов известны три типа гранул: первичные азурофильные гранулы,
содержащие миелопероксидазу, небольшое количество лизоцима и набор катионных
белков; вторичные «специфические» гранулы, содержащие лактоферрин, лизоцим и
белок, связывающий витамин B12; третичные
гранулы (мельчайшие гранулы, или С—частицы), содержащие кислые гидролазы, а
также практически всю желатиназную активность нейтрофила. Дегрануляция
нейтрофилов может быть истинной, когда гранулы целиком выталкиваются из клетки
(экзоцитоз), но чаще из гранул выделяются только растворимые компоненты и имеет
место вторичное запустевание гранул (так называемая секреторная дегрануляция).
Обширные запасы гликогена, который может быть использован при гликолизе,
позволяют нейтрофилам существовать в анаэробных условиях.
Основной функцией
нейтрофилов является уничтожение чужеродных клеток или веществ биополимерной
природы путем фагоцитоза. Эту функцию нейтрофилы осуществляют только после
выхода их из сосудистого пула. Процесс фагоцитоза, осуществляемого
нейтрофилами, состоит из тех же самых этапов, которые выше описаны для
макрофагов. В отличие от макрофагов, нейтрофилы могут фагоцитировать чужеродную
клетку или частицу только один раз, после чего они гибнут.
Хемотаксис нейтрофилов обусловлен в
основном продуктами жизнедеятельности бактерий или денатурированными белками
разрушенных клеток собственного организма, т. е. в определенной степени эта
стадия фагоцитоза является специфичной. Суммарный хемотаксический эффект
усиливается многочисленными факторами разнообразной природы, активирующимися в
начале разрушения чужеродного. Сам нейтрофил, будучи активированным в начале
фагоцитоза, также выделяет ряд хемотаксических факторов. Благодаря каскадному
усилению хемотаксического сигнала к месту разрушения объекта фагоцитоза
привлекается большое количество нейтрофилов.
Уничтожение чужеродных клеток
фагоцитами (макрофагами и нейтрофилами). Антигенная стимуляция резко меняет метаболический
профиль фагоцитирующих клеток. К наиболее выраженным сдвигам относится резкое
увеличение потребления глюкозы в реакциях гексозомонофосфатного шунта (ГМФШ),
генерирующего НАДФ • Н для восстановления молекулярного кислорода на мембранах
цитохрома b—245. Если в покоящемся нейтрофиле подобным образом
утилизируются лишь 1—2% глюкозы, то стимулированный нейтрофил способен окислить
до 30% глюкозы. Одновременно возрастает потребление кислорода и образование
оксидантов с мощным энергетическим потенциалом. Этот процесс
называют
респираторным взрывом.
В результате респираторного взрыва образуются мощные
бактерицидные агенты: супероксидный анион (О2—), перекись
водорода H202), синглетный кислород (1O2),
гидроксильные радикалы (ОН—). Сочетание перекиси водорода,
миелопероксидазы и ионов галогенов создает мощную систему галогенирования, приводящую
к появлению крайне агрессивных вторичных метаболитов: гипохлорной кислоты
(НОСl), хлорамина, продуктов перекисного окисления липидов (ПОЛ). Ключевым
считается супероксидный анион, с которого берет начало каскад активных форм
кислорода и сопряженных с ним феноменов. Избыток энергии реализуется путем
выделения тепла, повышенной химической активностью (отсюда высокая
биопидность), либо эмиссией квантов света (хемилюминесценция).
Кислороднезависимые механизмы. При дисмутации
супероксидного аниона потребляются ионы водорода и слегка повышается рН, это
создает оптимальные условия для функционирования семейства катионных белков.
Эти белки, имеющие высокую изоэлектрическую точку, разрушают бактериальную
стенку за счет протеиназного эффекта и за счет непосредственного присоединения
к поверхности микроорганизма. Низкие значения рН, устанавливающиеся после
слияния фагосомы с лизосомами, лизоцим и лактоферрин представляют собой
Кислороднезависимые бактерицидные и бактериостатические факторы, которые могут
действовать в анаэробных условиях. Убитые микроорганизмы расщепляются
гидролитическими ферментами, и продукты деградации высвобождаются из
фагоцитарной клетки.
Разные формы реактивности фагоцитов обеспечиваются и
проявляются нередко независимо друг от друга. При хроническом грануломатозе
макрофаги и нейтрофилы в связи с дефектом цитохромов b—245 не способны
образовывать активные метаболиты кислорода. Это сопровождается тем, что
бактерии фагоцитируются, но не уничтожаются в клетках. Кроме того, известно,
что многие микроорганизмы содержат в большом количестве каталазу и могут легко
инактивировать продуцируемую фагоцитами перекись водорода. Фагоциты, дефектные
по глюкозо—6—фосфатдегидрогеназе, не способны продуцировать активные метаболиты
кислорода и защищать организм от бактериальных инфекций. При синдроме «ленивых
лейкоцитов» нарушена реакция нейтрофилов на хемотаксические сигналы.
8.2.2. Внеклеточное уничтожение (цитотоксичность)
Макрофаги и нейтрофилы. Известно, что
фагоцитирующие клетки способны уничтожать микроорганизмы и остатки тканей не
только внутри, но и вне клетки. Фагоциты при этом не поглощают объект, а
взаимодействуют с ним с помощью рецепторов и убивают его. В элиминации
опухолевых клеток и клеток, зараженных вирусами, принимают участие не только
макрофаги, как это было принято думать, но и нейтрофилы.
Во время антигенной стимуляции фагоцитов резко возрастает поглощение
кислорода и в среде появляются его высокореактивные метаболиты. Последние
способны повреждать чужеродные клетки сами по себе и в комбинации с некоторыми
другими микробицидными факторами, например, с миелопероксидазой. Перекись
водорода вместе с миелопероксидазой и системой галогенирования является весьма
активным цитотоксическим агентом в отношении опухолевых клеток и клеток,
зараженных вирусами. Для осуществления цитотоксических эффектов фагоцитирующие
клетки должны быть активированы цитокинами или другими гуморальными факторами
неспецифической защиты организма.
Нормальные киллеры. В уничтожении зараженных вирусами и опухолевых клеток
участвуют особые элементы иммунной системы — нормальные киллеры (НК). НК— это
большие зернистые лимфоциты, которые образуются из полипотентной стволовой
кроветворной клетки в костном мозге. После недолгого созревания они появляются
в крови, а затем мигрируют в органы лимфоидной системы. Впервые эти клетки были
обнаружены в рассасывающихся аденокарциномах молочной железы у мышей. Было
показано, что НК обладают цитолитической активностью, направленной против широкого
спектра опухолевых клеток—мишеней. НК полностью лишены классической
иммунологической специфичности и могут уничтожать любые опухолевые клетки
независимо от их органного, генетического и видового происхождения. НК, в
отличие от В—лимфоцитов, не имеют встроенных в мембрану иммуноглобулиновых
молекул; они не содержат клеточных рецепторов и антигенных детерминант,
присущих Т—лимфоцитам.
НК узнают
определенные структуры высокомолекулярных гликопротеинов, которые
экспрессируются на мембране опухолевых или зараженных вирусами клеток.
Благодаря этому НК отличают такие клетки от нормальных. Узнавание клетки—мишени
и сближение с ней происходит за счет рецепторов НК. Для лизиса клеток—мишеней с
помощью НК необходимы тесные межклеточные контакты.
В результате тесного межклеточного
взаимодействия между клеткой—мишенью и НК последний активируется и выбрасывает
содержимое своих гранул в узкую межклеточную щель, возникающую при контакте
клеток. Возможно что главная роль в последующем киллинге клетки—мишени
принадлежит перфорину, или цитолизину, который может встраиваться
в мембрану клетки—мишени с образованием трансмембранной поры. В пользу такого
предположения говорят данные о том, что антитела к перфорину подавляют цитолиз
клеток—мишеней с помощью НК. Гранулы НК содержат сериновые протеиназы,
миелопероксидазу, перекись водорода, а также лимфотоксин, который путем
экзоцитоза проникает в клетку—мишень и вызывает повреждение ядра. Повреждения
клетки сопровождаются нарушением ее водно—солевого гомеостаза и приводят к ее
лизису. НК способны неоднократно осуществлять свое цитотоксическое действие.
Эозинофилы. Полиморфноядерные «двоюродные братья» нейтрофилой — эозинофилы
— содержат в отличие от последних гранулы, интенсивно окрашивающиеся кислыми
красителями. Эозинофилы обладают цитотоксическим действием на многие
паразитические формы, в том числе на крупных паразитических червей типа
гельминтов, которые не могут быть фагоцитированы.
(Эозинофилы
человека содержат примерно 200 гранул на клетку, большинство из которых, как
показали электронномикроскопические исследования имеют в диаметре 0,9—1,3 мкм.
Зрелые эозинофилы содержат также гранулы меньшего размера со средним диаметром
0,05—0,5 мкм. На поверхности эозинофилов имеются рецепторы к некоторым антителам, особенно IgG и IgE классов. Активация этих рецепторов
приводит к мощному усилению дыхания, сопровождающемуся выработкой значительных
количеств токсических метаболитов кислорода. При антигенной стимуляции
эозинофилы продуцируют довольно много перекиси водорода. Прикрепляясь к
паразиту, эозинофилы локально освобождают содержимое гранул и даже вводят его
непосредственно в цитоплазму клеток. В случае гельминтозов токсический эффект
наблюдается через 6—18 ч после фиксации эозинофилов на паразитическом черве.
Помимо активных метаболитов кислорода важную роль в осуществлении
цитотоксического действия эозинофилов, вероятно, играют катионные белки,
которые «протыкают» мембрану клетки—мишени подобно перфорину НК.
8.2.3. Разрушение чужеродных клеток
с помощью гуморальных механизмов
Система комплемента и ее активация. Комплементом называют сложный
комплекс белков и гликопротеинов (около 20), которые так же как и белки,
участвующие в процессах свертывания крови, фибринолиза и образования кининов,
формируют каскадные системы эффективной защиты организма от чужеродных клеток.
Для этой системы характерен быстрый, многократно усиленный ответ на первичный
антигенный сигнал за счет каскадного процесса. При этом продукт одной реакции
служит катализатором последующей. Первые данные о существовании системы
комплемента были получены в конце XIX в. при изучении механизмов защиты
организма от проникающих в него бактерий и уничтожения чужеродных клеток,
введенных в кровь. Эти исследования показали, что на проникновение
микроорганизмов и чужеродных клеток организм отвечает образованием антител,
способных агглютинировать эти клетки, не вызывая при этом их гибели. Добавление
к этой смеси свежей сыворотки вызывало гибель (цитолиз) объектов иммунизации.
Сделанное наблюдение послужило толчком для интенсивных исследований,
направленных на выяснение механизмов лизиса чужеродных клеток.
Ряд компонентов системы комплемента
обозначают символом «С» и цифрой, которая соответствует хронологии их открытия.
В наибольшей концентрации в сыворотке крови человека присутствует компонент СЗ
(1,2 мг/мл). Существует два пути активации комплемента: без участия
антител — альтернативный и с участием антител — классический.
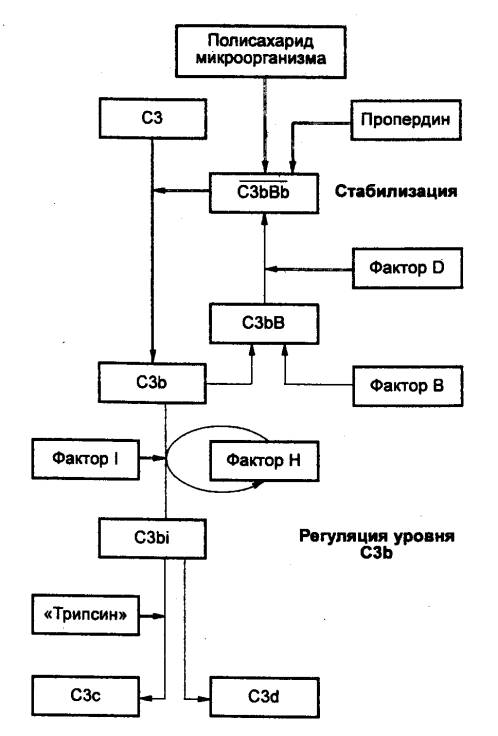
Альтернативный путь активации
комплемента. Первый
путь активации комплемента, вызываемый чужеродными клетками, с филогенетической точки зрения является
более древним. Основные этапы его представлены на рис. 8.7. Ключевую роль
в активации
|
|
|
Рис. 8.7 Альтернативный путь активации
комплемента, вызываемый микроорганизмами, и его регуляция факторами I и Н |
|
|
|
Рис. 8.8 Образование
мембраноатакующего комплекса при активации комплемента по альтернативному
пути с участием компонентов С5Б—С9 |
комплемента
таким способом играет СЗ, который, представляет собой гликопротеин, состоящий
из двух полипептидных цепей. При нормальных условиях внутренняя тиоэфирная
связь в СЗ медленно активируется в результате взаимодействия с водой и
следовыми количествами протеолитических ферментов плазмы крови, приводя к
образованию СЗb и СЗа
(фрагменты СЗ). В присутствии ионов Mg2+ СЗb может образовывать комплекс с другим компонентом
системы комплемента фактором В; затем последний фактор расщепляется одним из
ферментов плазмы крови — фактором D.
Образовавшийся комплекс СЗbВb (линия над обозначением указывает на наличие
ферментативной активности, при расщеплении компонентов системы комплемента
большему фрагменту присваивается символ «a», а меньшему — символ «а»)
представляет собой СЗ—конвертазу — фермент, расщепляющий СЗ на СЗa и СЗb.
Некоторые микроорганизмы могут
активировать СЗbВb—конвертазу с образованием большого количества продуктов
расщепления СЗ путем связывания фермента на углеводных участках своей
поверхностной мембраны и защиты ее тем самым от действия фактора Н. Затем
другой белок пропердин взаимодействует с конвертазой, повышая
стабильность ее связывания. Как только СЗ расщепляется с помощью конвертазы,
его внутренняя тиоэфирная связь активируется, и реакционноспособное производное
СЗb ковалентно связывается с. мембраной микроорганизма. Один активный центр
СЗbВb позволяет связаться с микроорганизмом большому количеству молекул СЗb.
Существует и механизм, сдерживающий этот процесс в нормальных условиях: в
присутствии факторов I и Н СЗb превращается в СЗbi, последний под влиянием
протеолитических ферментов расщепляется до конечных неактивных пептидов СЗс и C3d.
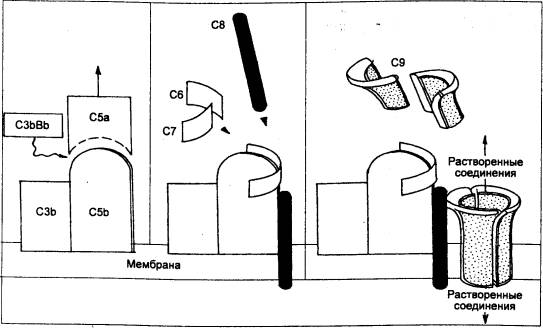
Следующий активируемый компонент —
С5, взаимодействуя с мембраносвязанным СЗb, становится субстратом для СЗbВb и
расщепляется с образованием короткого пептида С5а, причем фрагмент С5b остается
фиксированным на мембране. Затем С5b последовательно присоединяет С6, С7 и С8 с
образованием комплекса, способствующего ориентации на мембране молекул
последнего компонента С9. Это приводит к развертыванию молекул С9,
проникновению их внутрь билипидного слоя (рис. 8.8) и полимеризации в
кольцеобразный «мембраноатакующий комплекс» (МАК). Вклинившийся в мембрану
комплекс С5b—С7 позволяет С8 войти в непосредственный контакт с мембраной,
вызвать дезорганизацию ее регулярных структур и, наконец, привести к
образованию
|
|
|
Рис. 8.9 Функционально—активные
комплексы, образующиеся на поверхности чужеродной клетки при активации
комплемента по классическому пути I, II, III — центры
связывания. |
спиралевидных
трансмембранных каналов. Формирующийся трансмембранный канал полностью
проницаем для электролитов и воды. За счет высокого коллоидно—осмотического
давления внутри клетки в нее поступают ионы Na+ и воды, что и приводит к лизису чужеродной клетки или
микроорганизма.
Помимо способности лизировать клетки с чужеродной информацией комплемент
обладает также другими важными функциями: а) за счет присутствия на поверхности
фагоцитирующих клеток рецепторов к СЗb и СЗbi облегчается адгезия
микроорганизмов; б) образующиеся в процессе активации комплемента небольшие
пептиды СЗа и С5а («анафилатоксины») стимулируют хемотаксис нейтрофилов к месту
скопления объектов фагоцитоза, активируют кислородзависимые механизмы фагоцитоза
и цитотоксичности, вызывают выброс медиаторов воспаления из тучных клеток и
базофилов, расширение кровеносных капилляров и повышение их проницаемости; в)
протеиназы, появляющиеся при активации комплемента, несмотря на их субстратную
специфичность, способны активировать другие ферментные системы крови: систему
свертывания и систему кинино—образования; г) компоненты комплемента,
взаимодействуя с нерастворимыми комплексами антиген—антитело, уменьшают степень
их агрегации.
Классический путь активации комплемента. Инициация
классического пути происходит в тот момент, когда антитело, соединенное с
микробом или другой клеткой, несущей чужеродную информацию, связывает и
активирует первый компонент каскада Clq (рис.
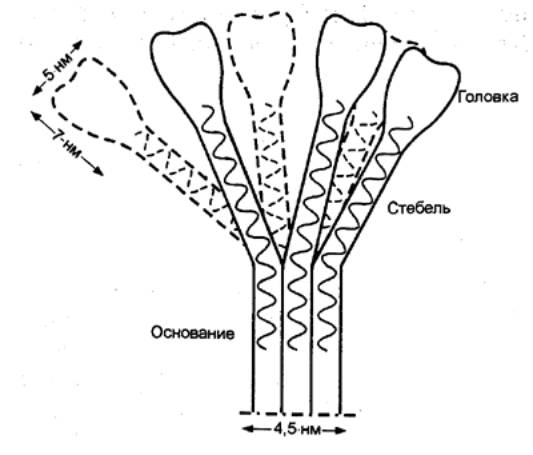
8.9). Эта молекула поливалентна в отношении связывания антител. Она состоит из
центрального коллагеноподобного стержня, разветвляющегося на шесть пептидных
цепочек, каждая из которых оканчивается связывающей антитело субъединицей. По
данным электронной микроскопии вся молекула напоминает тюльпан (рис. 8.10). Его
шесть лепестков образованы С—концевыми глобулярными участками полипептидных
цепей, коллагеноподобные участки скручены в каждой субъединице в трехспиральную
структуру. Все вместе они образуют структуру, подобную стеблю, за счет
объединения в районе N—концевого участка дисульфидными связями. Глобулярные
участки отвечают за взаимодействие с антителами, а коллагеноподобный участок —
за связывание с двумя другими субъединицами С1. Для объединения трех субъединиц
в единый комплекс необходимы ионы Са2+. Комплекс активируется,
приобретает протеолитические свойства и участвует в формировании центров
связывания других компонентов каскада. Завершается процесс образованием
|
|
|
Рис. 8.10 Структура
Clq фрагмента компонента С1 системы комплемента |
МАК.
Специфические к антигену антитела могут дополнять и усиливать способность
механизмов естественного иммунитета инициировать острые воспалительные реакции.
Меньшая часть комплемента в организме активируется по альтернативному пути,
который может осуществляться в отсутствие антител. Этот неспецифический
путь активации комплемента важен при уничтожении фагоцитами стареющих или
поврежденных клеток организма, когда атака начинается с неспецифической сорбции
иммуноглобулинов и комплемента на поврежденной клеточной мембране. Тем не
менее, классический путь активации комплемента в организме человека и других
млекопитающих является превалирующим.
Белки острой фазы. Концентрация
некоторых белков плазмы крови, имеющих общее название «белки острой фазы» резко
увеличивается в ответ на инфекцию или повреждение тканей. К этим белкам
относятся С—реактивный белок (СРБ), сывороточный амилоидный А—белок, (α1—антитрипсин,
α2—макроглобулин,
фибриноген, церулоплазмин, компонент комплемента С9 и фактор В.
В процессе инфекции продукты
жизнедеятельности микробов (например, эндотоксины) стимулируют выработку
интерлейкина—1 (ИЛ—1), который представляет собой эндогенный пироген. ИЛ—1 не только
повышает температуру тела, но и, воздействуя на печень, резко усиливает
продукцию гепатоцитами СРБ. Концентрация последнего в плазме крови может
увеличиваться в 1000 раз.
СРБ состоит из пяти идентичных
нековалентно связанных полипептидных цепей, образующих замкнутый пентамер.
Важное свойство этого белка — способность связываться в присутствии ионов Са2+
с некоторыми микроорганизмами, в состав мембран которых входит фосфорилхолин.
Образовавшийся комплекс активирует систему комплемента по классическому пути.
Это приводит к связыванию СЗb с
поверхностью микроба, в результате последний опсонизируется и подготавливается
к фагоцитозу. Кроме того, СРБ усиливает подвижность лейкоцитов, повышает
функциональную активность лимфоцитов и облегчает взаимодействия антител с
антигенами.
Интерфероны. У
млекопитающих, так же как у других позвоночных животных, обнаружен ряд
антивирусных агентов широкого спектра действия _ интерфероны (ИФН). ИФН по
своей химической природе являются белками и гликопротеинами.
Закономерности продукции и действия
ИФН складываются из четко следующих друг за другом этапов и представляют собой
своеобразную цепную реакцию в ответ на сигнал тревоги, будь то вирусные
инфекции или стрессы. Открыты основные компоненты системы ИФН: удалось
определить локализацию генов, ответственных за его образование, а также
выделить мРНК, несущие программу синтеза ИФН. ИФН оказался в числе первых
клеточных белков, синтезированных вне организма с помощью генной инженерии.
Идентифицированы различные типы ИФН; гены каждого из них клонированы.
Существует
более 20 ИФН—α, которые
продуцируются преимущественно макрофагами и В—лимфоцитами. Продуцентами ИФН—β являются фибробласты и некоторые другие клетки
соединительной ткани. ИФН—γ несколько короче, чем другие ИФН. ИФН—γ продуцируется
Т—лимфоцитами в ответ на митогенную стимуляцию. Процесс этот двухфазный и
зависит от участия вспомогательных клеток, в основном моноцитов и макрофагов.
При вирусной инфекции клетки синтезируют ИФН и освобождают его в
межклеточное пространство, где он связывается со специфическими рецепторами
соседних незараженных клеток. Полагают, что в клетке, подвергшейся воздействию
ИФН, дерепрессируются по меньшей мере два гена и начинается синтез двух
ферментов. Первый — протеинкиназа А — фосфорилирует рибосомальный белок и
фактор инициации, необходимый для синтеза белка, тем самым снижая трансляцию
мРНК. Второй фермент катализирует образование короткого полимера адениловой
кислоты, активирующего латентную эндонуклеазу, что приводит к деградации иРНК
вируса и хозяина. Конечный результат действия ИФН состоит в образовании барьера
из неинфицированных клеток вокруг очага вирусной инфекции, чтобы ограничить ее
распространение. Полагают, что ИФН играют важную роль именно в борьбе с
вирусами, а не в предотвращении вирусных инфекций.
В крови
здорового человека содержится примерно 4 МЕ/мл ИФН, наиболее низкие уровни этих
биологически активных веществ наблюдаются у детей до 3—х лет и у лиц старше 60
лет. Уровень ИФН может влиять и на начальные этапы эмбрионального развития —
период имплантации (предотвращает имплантацию оплодотворенной яйцеклетки и
начало ее дробления). Низкий уровень синтеза и освобождения ИФН связывают с
особенностями сыворотки крови новорожденных — сниженной антиокислительной
активностью и преобладанием факторов, повышающих выход катепсина D из лизосом. При внесении в систему клеток
новорожденных ингибитора протеаз или препаратов с антиоксидантным действием
продукция ИФН возрастает.
Лейкоциты
доноров с I (0), III (В) и IV
(АВ) группами крови, как правило, хорошо продуцируют ИФН. У доноров с группой
крови II (А) почти в 40% случаев выявлена дефектность системы ИФН, выражающаяся
в резко сниженной способности продуцировать этот белок в ответ на вирусную
инфекцию. Возможно, именно с этим связано то, что лица с группой крови II (А)
более предрасположены к острым респираторным инфекциям и среди них чаще
встречаются больные с различными онкологическими заболеваниями.
Изучение влияния стресса на
животных выявило прямую корреляцию между изменением антивирусной активности
крови и способностью лимфоцитов синтезировать ИФН с интенсивностью стрессорных
воздействий. Показано, что в течение первых суток после стресса резко снижается
способность спленоцитов (моноцит, образующийся в ретикулярной ткани селезенки)
синтезировать ИФН—α и ИФН—γ
с параллельным падением уровня ИФН в крови и снижением активности НК. Лишь на 8—й
день после стресса отмечается нормализация продукции ИФН. У спортсменов при
предельных тренировочных нагрузках, имеющих характер стрессорных воздействий,
происходит выраженное угнетение системы ИФН. Вскоре после этого количество
циркулирующего ИФН достоверно повышается при одновременном снижении в 5—10 раз
синтеза ИФН. При последующем отдыхе выявлена тенденция к нормализации уровня
ИФН.
При
изучении факторов, обусловливающих понижение общей резистентности организма
(охлаждение, голодание, ионизирующие излучения, действие иммунодепрессантов,
стероидных гормонов и др.), было установлено, что все они заметно угнетают
выработку ИФН.
Секреция ИФН из клеток—продуцентов находится под контролем некоторых
пептидных гормонов, глюкокортикоидов и простагландинов. Сам ИФН способен и
прямо имитировать эндокринные эффекты подавляющего большинства гормонов. Так,
ИФН индуцирует, подобно АКТГ, синтез стероидных гормонов в культуре клеток коры
надпочечников, а подобно меланотропину, стимулирует синтез меланина в культуре
клеток меланомы. Гормоноподобное действие ИФН на клетки—мишени выражается в
активации их специфических функций, выполнение которых предопределено
характером тканевой дифференцировки. Такое действие, возможно, обусловливает
антипролиферативный эффект ИФН, поскольку дифференцировка клеток обычно
сопровождается снижением их способности делиться.
Учитывая филогенетическую древность системы ИФН, предполагают, что эволюция
ИФН и некоторых пептидных гормонов шла из единого предшественника, и ИФН
является своего рода протогормоном, т. е. несет в себе функции, развившиеся
впоследствии в эндокринные. Следовательно, систему ИФН можно представить в роли
филогенетического предшественника ряда гормонов, из которых каждый развивался
по мере усложнения межтканевых взаимоотношений в направлении реализации
конкретной эндокринной функции. Вместе с тем эти гормоны сохранили ряд свойств,
характерных для ИФН — его противовирусное действие.
Известно, что ИФН могут оказывать влияние на такие функции ЦНС, как
опиоидная рецепция, сон и др. Введение рекомбинантного человеческого ИФН—аз
алкоголизированным крысам нормализует рецепцию опиоидов у животных. Введение
этого же препарата кроликам усиливает медленную фазу сна, повышает температуру
мозга, изменяет характер энцефалограммы. Механизмы взаимодействия системы ИФН и
нейроэндокринной системы имеют комплексный и неоднозначный характер. Таким
образом, ИФН, являясь модуляторами иммунных реакций, выполняют важные
регуляторные функции в общем комплексе контрольно—регуляторного механизма,
направленного на поддержание гомеостаза организма.
Лизоцим. Лизоцим (мурамилпептидаза) представляет собой
термостабильный фермент с молекулярной массой 14,6 кДа. Он содержится в слезах,
слизи носа, слюне, желудочном и кишечном соках, а также сыворотке крови.
Продуцируется макрофагами и клетками эпителия различных слизистых оболочек
(клетками Панета — энтероцитами с ацидофильными гранулами). Лизоцим обладает
прямой бактерицидной активностью в отношении грамположительных (окрашенных по
методу Грама) бактерий (стафилококков, стрептококков) и в меньшей степени в
отношении грамотрицательных бактерий. Будучи способным разрывать гликозидные
связи между N—ацетилглюкозамином и N—ацетилмурамовой кислотой, лизоцим
разрушает клеточную стенку бактерий, что приводит к лизису микроорганизмов. В
случае инфекции грамотрицательными микроорганизмами лизоцим действует совместно
с системой комплемента.
Фибронектин. Фибронектин — белок (молекулярная масса около 550
кДа), который содержится в плазме крови и тканевых жидкостях. Он является
важным компонентом системы неспецифической защиты организма. Этот белок
продуцируется макрофагами, тучными клетками и фибробластами. Обнаружены пять
различных функциональных доменов, которые в одной или более комбинациях
связываются с коллагеном, фибрином, Clq и
некоторыми микроорганизмами (стафилококки, стрептококки). Эти домены существуют
как глобулярные области, отделенные короткими сегментами полипептидной цепи, и
обеспечивают различные биологические свойства фибронектина.
Рецепторы к фибронектину имеются
практически на всех клетках человека. Связывание лигандов с «плавающим»
носителем рецепторов приводит к конформационным изменениям белка, который
подвергается быстрому действию протеазы.
Фибронектин участвует в клеточной
адгезии, распластывании и движении клеток, а также влияет на различные типы
фагоцитарных реакций. Фибронектин обладает хемотаксической активностью для
фибробластов, что может иметь важное значение в процессе восстановления
поврежденных тканей.
8.2.4. Роль острой воспалительной реакции в механизмах неспецифической резистентности организма
Основой эффекторной функции иммунной
системы является воспалительная реакция, которая локализуется в месте
вторжения чужеродного или появления своего недоброкачественного начала. В
результате формируется очаг воспаления.
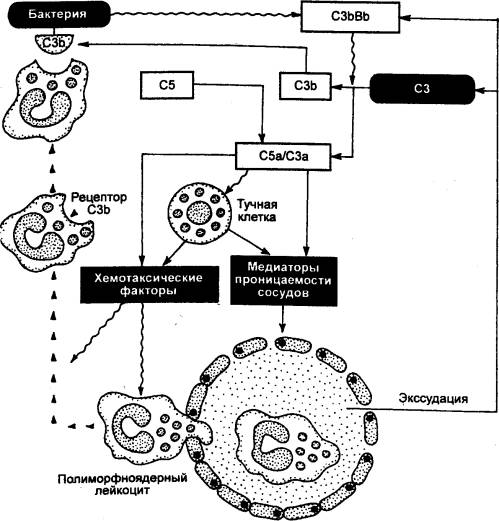
Рассмотрим защитную
стратегию при острой воспалительной реакции, вызванной запуском альтернативного
пути активации комплемента (рис. 8.11). На поверхности микробной клетки или
другого объекта, несущего чужеродную информацию, происходит активация СЗ—конвертазы
(альтернативного или классического пути), которая расщепляет большие количества
СЗ. При этом большие количества СЗb связываются с поверхностью антигена
(например, микроорганизма), а фрагмент СЗа появляется в среде в свободном виде.
Это активирует следующий этап, в результате чего образуются С5а и МАК.
Встраивание МАК в клеточную стенку микроорганизма или мембрану клетки, несущей
чужеродную информацию, приводит к лизису этих клеток. Как отмечалось выше,
|
|
|
Рис. 8.11 Основные механизмы.
формирования внешних симптомов острой воспалительной реакции, вызванной
запуском альтернативного пути активации комплемента СЗ — компонент системы
комплимента; СЗЬ — фрагмент СЗ, образовавшийся в результате взаимодействия
тиоэфирной связи с водой и ферментами плазмы крови; СЗbВb — СЗ—конвертаза,
расщепляющая СЗ на СЗа и СЗb; С5 —
активирующий компонент; С5 — короткий пептид, образованный при расщеплении СЗbВb. |
СЗа и С5а являются мощными
хемотаксическими факторами и медиаторами проницаемости сосудов. Это ведет к
расширению капилляров, экссудации белков плазмы крови в окружающие ткани, а
также к концентрации в очаге воспаления полиморфноядерных лейкоцитов (прежде
всего, нейтрофилов).
Базофилы и тучные клетки. Кроме того, СЗа и С5а связываются
со специфическими рецепторами на поверхности тучных клеток и базофилов. После образования
в красном костном мозге и недолгой циркуляции в крови базофилы и тучные клетки
мигрируют в ткани, где первые после выполнения своей главной функции довольно
быстро погибают, вторые (часто после дополнительной дифференцировки)
превращаются в долгоживущие оседлые клетки. Тучных клеток и базофилов особенно
много в коже, легких, пищеварительном тракте которые непосредственно
соприкасаются с окружающей средой.
Образование тучных клеток и базофилов увеличивается под
влиянием колониестимулирующих факторов, продуцируемых моноцитами и макрофагами.
Эти клетки активируются продуктами Т—лимфоцитов. Так, ИЛ—3, продуцируемый Т—лимфоцитами
с фенотипической характеристикой хелперов, является одним из главных факторов,
поддерживающих рост и жизнеспособность предшественников тучных клеток. В его
отсутствии тормозится дифференцировка тучных клеток и базофилов, связанная с
формированием гранул. ИЛ—4, продуцируемый не только Т—лимфоцитами, но и самими
тучными клетками, стимулирует пролиферацию предшественников тучных клеток и
базофилов, а для некоторых линий тучных клеток служит аутокринным ростовым
фактором.
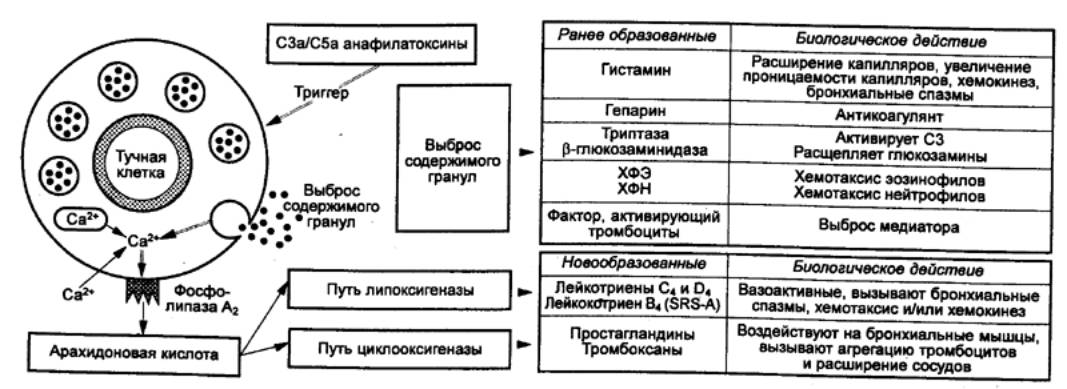
Активация тучной клетки (базофила)
приводит к высвобождению медиаторов воспаления двумя различными путями (рис.
8.12): 1) выброс ранее образованных медиаторов из гранул, который происходит
через 15—20 с после появления чужеродной клетки; 2) выброс новосинтезированных
медиаторов в результате усиления процессов фосфолипидного обмена и увеличения
образования арахидоновой кислоты, имеющих место в более поздние сроки после
активации тучной клетки. Функциональная активность тучных клеток возрастает с
увеличением температуры, она подавляется при отсутствии в среде Са2+
и подъеме концентрации в крови глюкокортикоидных гормонов.
|
|
|
Рис.
8.12 Активация тучной клетки,
приводящая к высвобождению медиаторов по двум. путям: 1) выброс ранее
образованных медиаторов; 2) выброс новообразованных в результате метаболизма
арахидоновой кислоты медиаторов ХФН— хемотаксический
фактор нейтрофилов; ХФЭ — хемотаксический фактор эозинофилов. |
Основные
биологически активные вещества, входящие в состав гранул, и их биологические
эффекты представлены на рис. 8.12. Это гистамин (двухосновный
вазоактивный амин, образующийся при декарбоксилировании аминокислоты гистидина,
индуцирует сокращение гладких мышц трахеи, бронхов, кишки, повышает
проницаемость сосудов, кожи и других органов, вызывает кожный зуд, оказывает
влияние на различные функции и миграцию лейкоцитов), серотонин
(оказывающий такое же влияние на гладкую мускулатуру и проницаемость сосудов,
как гистамин, демонстрирует многочисленные эффекты на деятельность
иммунокомпетентных клеток), гепарин.
Большое количество биологически
активных веществ, которые могут рассматриваться как продуцируемые тучными
клетками и базофилами медиаторы воспаления, представляет собой продукты
метаболизма арахидоновой кислоты. Арахидоновая кислота (рис. 8.13)
содержит в своем составе четыре двойных
|
|
|
Рис. 8.13 Структура арахидоновой кислоты |
связи в 5—,
8—, 11—и 14—м положениях (считая от С—конца), что делает ее удобным
предшественником во многих биохимических превращениях. Биологически важные
продукты метаболизма арахидоновой кислоты по липоксигеназному пути — лейкотриены
(ЛТ), ЛТ—В4, ЛТ—С4 и ЛТ—D4 — вызывают расширение (ЛТ—В4) или сужение
(ЛТ—С4) подкожных кровеносных сосудов, оказывают влияние на гладкие мышцы, на
артериальное давление, ЦНС и процесс миграции иммунокомпетентных клеток. При
метаболизме арахидоновой кислоты по циклооксигеназному пути образуются
простагландины (преимущественно ПГ—D2), влияющие на тонус кровеносных сосудов и
сокращение гладких мышц, а также на иммунную систему (подавляют пролиферацию Т—
и В—лимфоцитов, хемотаксис лейкоцитов, цитотоксичность НК и других клеток,
высвобождение медиаторов воспаления).
Расширение
капилляров (гиперемия), экссудация белков плазмы крови и жидкостей из—за
изменений гидростатического и осмотического давления (отек) и накопление
нейтрофилов носят общее название «острой воспалительной реакции».
Накапливающиеся в воспалительном очаге эозинофилы выделяют биологически
активные вещества, большинство из которых является антимедиаторами по отношению
к веществам, секретируемым тучными клетками или базофилами. Благодаря этому уменьшается
интенсивность протекания экссудативной фазы воспалительного процесса.
Способность инактивировать медиаторы тучных клеток и базофилов позволяет
эозинофилам предотвращать обширное повреждающее действие воспалительной реакции
на собственные ткани организма.
В настоящее
время имеются работы, свидетельствующие о том, что эозинофилы могут оказывать и
повреждающее действие на ткани. Известно, что эозинофилы секретируют два
нейротоксических белка, которые могут самостоятельно или вместе с другими
продуктами этих клеток повреждать периферические нервы и формировать
гиперреактивность гладкой мускулатуры некоторых структур, таких как бронхи.
8.3. МЕХАНИЗМЫ СПЕЦИФИЧЕСКОГО
ПРИОБРЕТЕННОГО ИММУНИТЕТА
Иммунная система
включает в себя не только перечисленные выше малоспецифические в своей основе
компоненты, но и эволюционно новые элементы, определяющие высокую специфичность
иммунных реакций. Специфичность иммунной реакции определяется лимфоцитами и
продуцируемыми ими специфическими иммуноглобулинами. Содержание лимфоцитов в
крови человека в среднем составляет 1—4 • 109 клеток в 1 л крови.
Имеются два основных типа лимфоцитов, обладающих разными гистогенезом и
конечной эффекторной функцией: Т—лимфоциты, обеспечивающие клеточный
иммунитет, и В—лимфоциты, ответственные за антителообразование. В
отличие от других иммунокомпетентных клеток малые лимфоциты, циркулирующие в
кровотоке, способны к интенсивной пролиферации и дифференцировке в ответ на
антигенный стимул. Лимфоциты, циркулирующие в крови, являются в основном
зрелыми клетками, дифференцированными на субпопуляции: Т—хелперы (помощники), Т—супрессоры,
В—лимфоциты и др. В ответ на антигенное раздражение лимфоциты могут, оседая в
лимфоидной ткани, активно размножаться и дифференцироваться в конечные
эффекторные клетки (в плазматические клетки из В—лимфоцитов и цитотоксические
— из Т—лимфоцитов).
После исчезновения антигена гибнут
клетки специфических клонов, однако часть таких специфических лимфоцитов,
представляющих собой длительно живущие клетки, остается. Эти лимфоциты
обусловливают иммунологическую память к данному антигену, обеспечивая при
вторичном появлении его в организме более интенсивное по скорости размножение с
образованием большого числа специфических клеток. Существование приобретенной
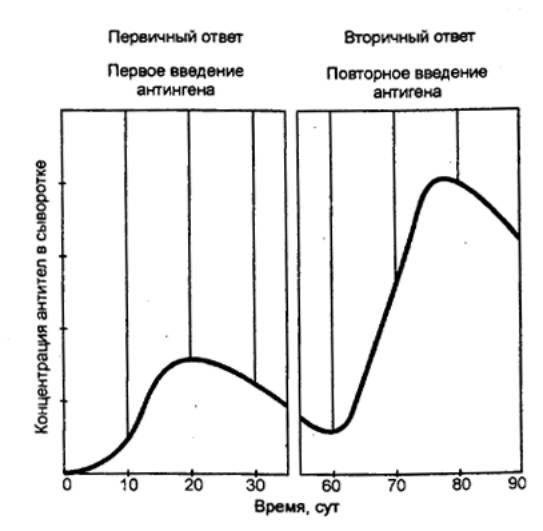
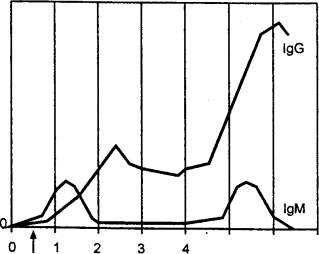
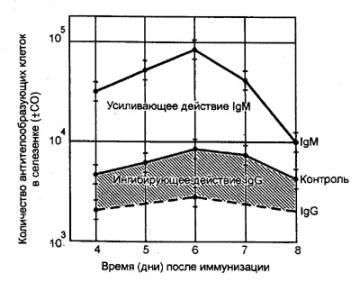
иммунологической памяти подтверждается следующим примером (рис. 8.14).
После первичного введения кролику
столбнячного анатоксина (бактериальный экзотоксин, потерявший токсичность)
проходит несколько дней, прежде чем в крови будут обнаружены антитела, затем
количество их возрастает до максимума и далее падает. При вторичном введении
препарата динамика иммунного ответа резко меняется: наблюдается более быстрая и
интенсивная продукция антител. Этот вторичный ответ является результатом
«настройки» или примирования лимфоцитами, которые могут пролиферировать
значительно быстрее под влиянием антигена.
|
|
|
Рис. 8.14 Первичный
и вторичный иммунный ответ на введение столбнячного анатоксина Ответ при повторном контакте с антигеном наступает быстрее
и протекает с большей интенсивностью. |
Основное
свойство приобретенного иммунитета — его специфичность — обусловлено
способностью распознающих участков молекул антител различать антигены. Антитела,
реагирующие с анатоксином, не связываются, например, с гемагглютинином вируса
гриппа, и, соответственно, антитела к вирусу гриппа не взаимодействуют со
столбнячным анатоксином. Эта способность узнавать единственный антиген и
выделять его среди других имеет фундаментальное биологическое значение
для распознавания «своего» и «чужого». Неспособность отличить «свое» от «не
своего» может привести к синтезу антител, взаимодействующих с компонентами
собственного организма (аутоантитела), а это заканчивается возникновением
тяжелых патологических процессов. М. Бернет и Ф. Феннер предположили, что
организм человека имеет механизм, различающий «свое» и «не свое». По их мнению,
этот механизм состоит в том, что циркулирующие компоненты организма, попадающие
в развивающуюся лимфоидную систему в пренатальном периоде, «запоминаются» как
«свои». Затем по отношению к ним возникает постоянная неспособность к иммунному
ответу, или толерантность. Это означает, что после завершения созревания
иммунной системы неспособность реагировать на «свои» компоненты становится
нормой.
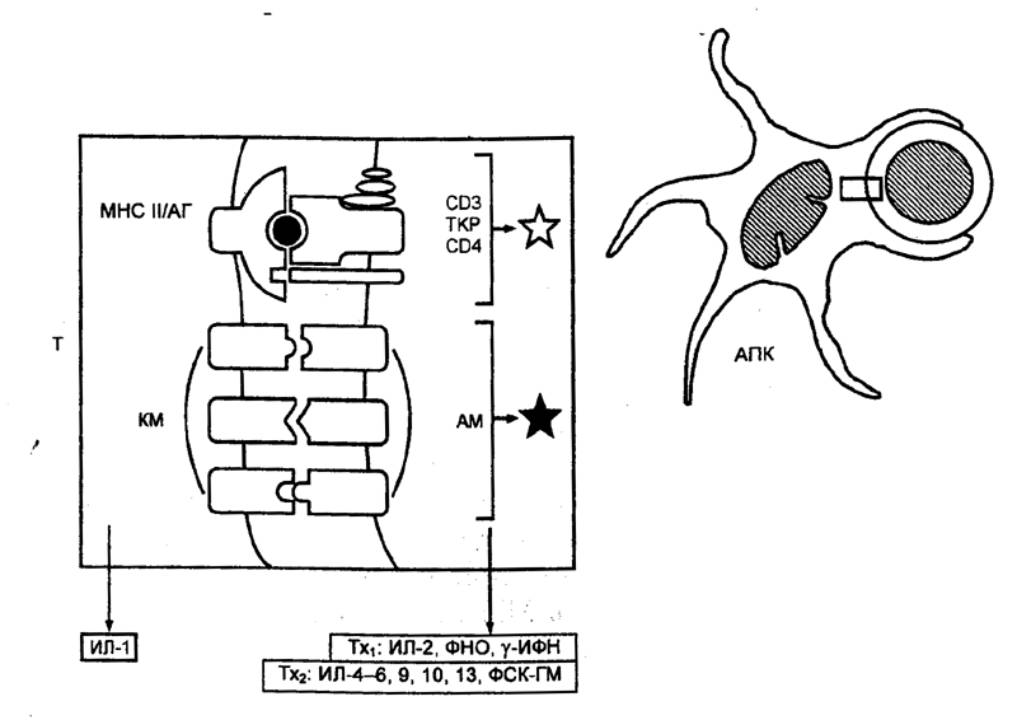
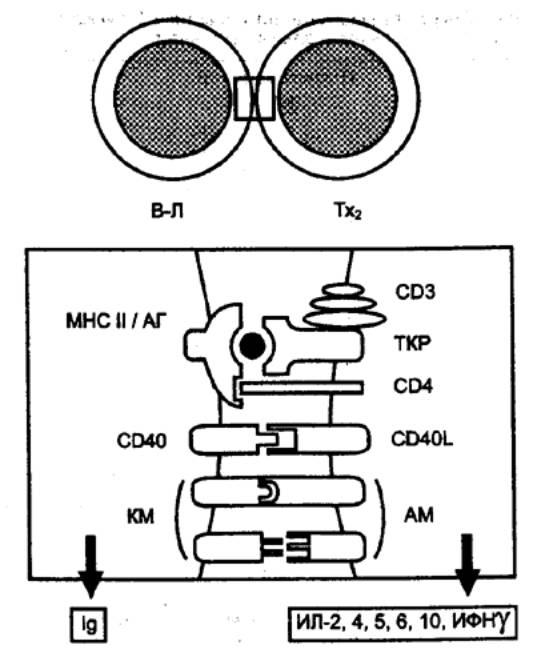
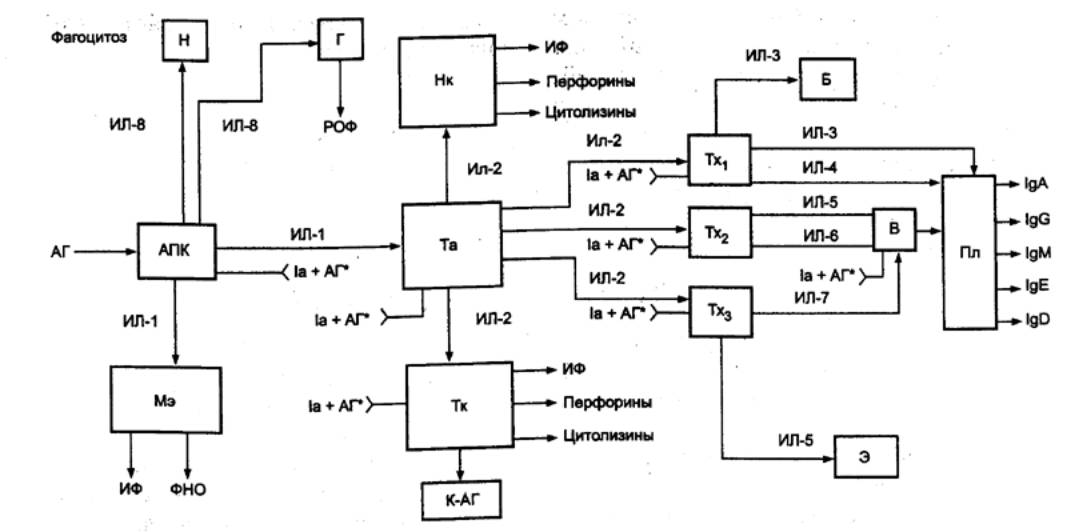
8.3.1. Характеристика клеток,
участвующих в реакциях специфического иммунитета
Единая
общепринятая классификация клеток, обеспечивающих реакции специфического иммунитета,
отсутствует. На основании функциональных особенностей выделяют несколько типов
клеток:
антигенпредставляющие
(презентирующие) клетки (АПК), захватывающие антигены, перерабатывающие их и
представляющие соответствующие антигенные детерминанты другим
иммунокомпетентным клеткам, (к АПК относятся дендритные АПК, моноциты и
макрофаги, а также В—лимфоциты);
эффекторные клетки,
непосредственно осуществляющие реакции специфического иммунитета (к эффекторным
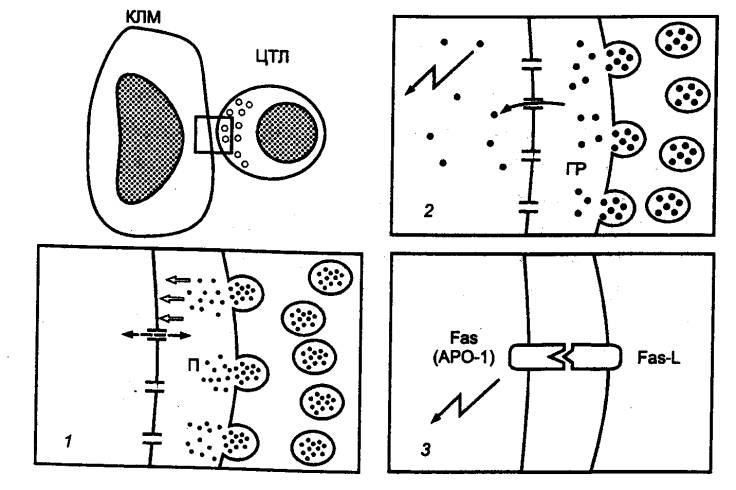
иммунокомпетентным клеткам относятся цитотоксические T—лимфоциты — ЦТЛ — и
плазматические клетки);
регуляторные клетки,
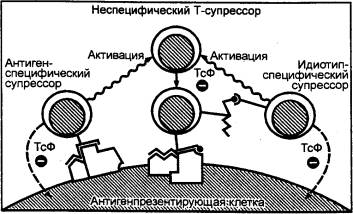
обеспечивающие активацию или угнетение отдельных звеньев иммунных реакций
(активаторы — индукторы T—хелперов, индукторы T—супрессоров, T—хелперы 1, T—хелперы
2, макрофаги; ингибиторы — T—супрессоры; Т—контрсупрессоры делают T—хелперы
нечувствительными к Т—супрессорам);
клетки памяти, хранящие
информацию о взаимодействии с конкретным антигеном и тем самым способствующие
более активному развитию иммунного ответа при повторном его воздействии.
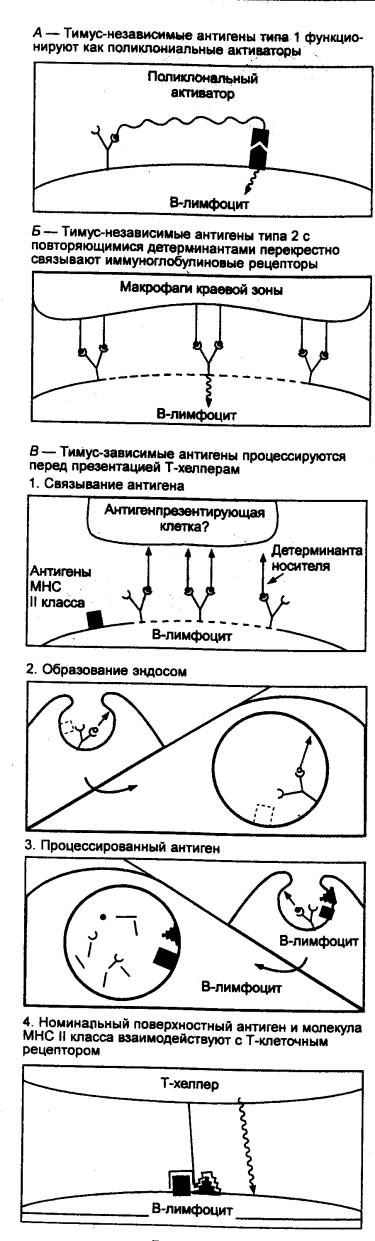
Антигенпредставляющие клетки (АПК)
располагаются на главных путях поступления антигенов в организм (в коже и в
слизистых оболочках), откуда, захватив антигены, они мигрируют в периферические
органы иммунной системы, где представляют антигены лимфоцитам. Ранее АПК
полностью отождествляли с макрофагами. Эффективность представления антигенов
макрофагами значительно ниже, чем специализированными на этой функции
дендритными АПК. Последние, в свою очередь, по сравнению с макрофагами обладают
значительно более низкой фагоцитарной и цитотоксической активностью. Функции
АПК включают: 1) захват нативного (неизмененного) антигенного материала путем
фагоцитоза, пиноцитоза или рецепторно—опосредованного эндоцитоза; 2) частичный
протеолиз (процессинг) эндогенного материала в эндосомах в течение 3060 мин при
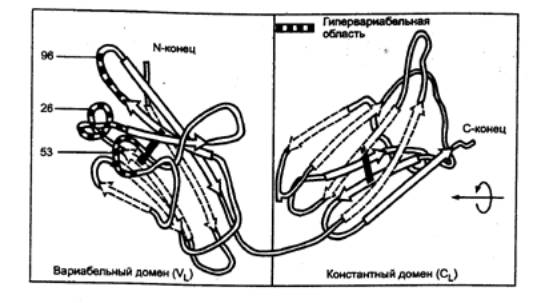
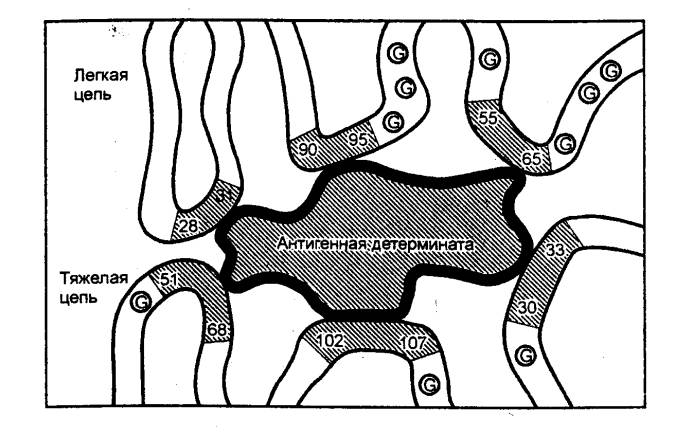
низких рН с высвобождением эпитопов антигенов (эпитоп — часть антигена,
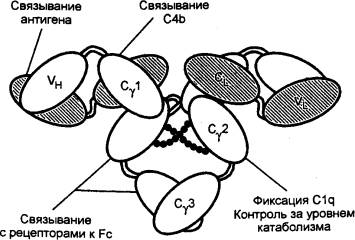
взаимодействующая с паратопом, т. е. гипервариабельной частью антитела),
которые могут быть прерывистыми и непрерывными; 3) синтез гликопротеиновых
молекул главного комплекса гистосовместимости, или МНС (англ. Major Histocompatibility Complex), называемого у человека также системой HLA (англ. Human
Leukocyte Antigens — антигены лейкоцитов человека), а
также связывание синтезированных молекул МНС с эпитопами антигенов; 4)
транспорт комплексов молекулы МНС/эпитоп антигена на поверхность АПК, где они
представляются распознающим их лимфоцитам;
5)
экспрессию на поверхности клетки наряду с комплексом МНС/антиген ряда
добавочных (костимулирующих) молекул, усиливающих процесс взаимодействия с
лимфоцитами; 6) секрецию растворимых медиаторов (преимущественно ИЛ1), которые
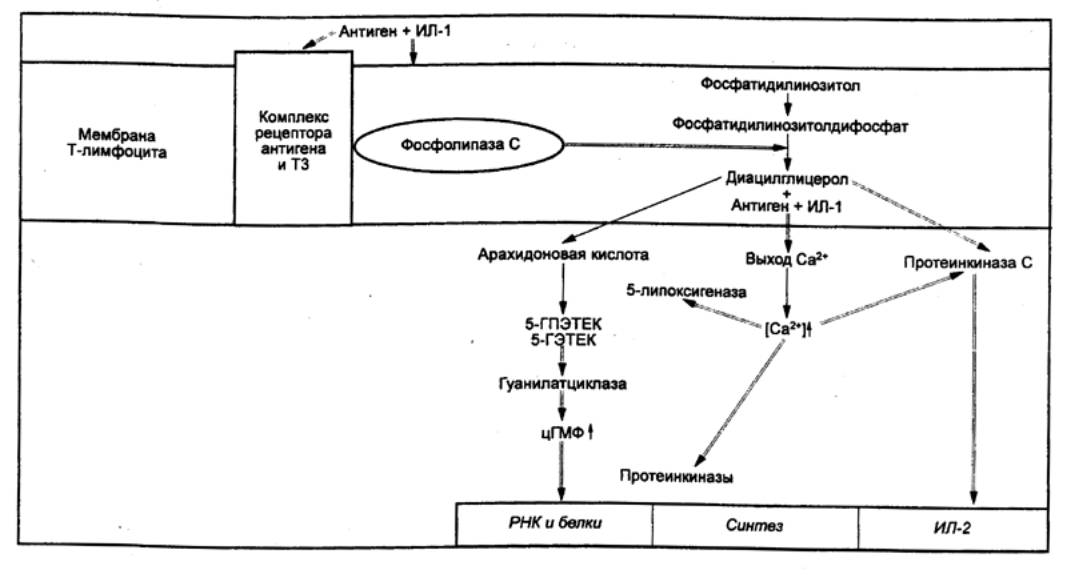
вызывают активацию лимфоцитов.
|
|
|
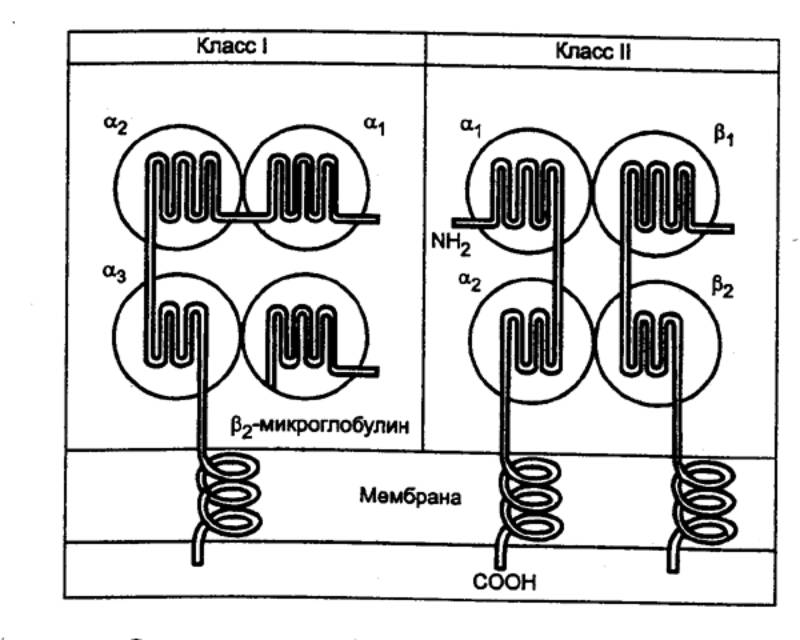
Рис. 8.15 Структура продуктов главного комплекса гистосовместимости
классов I и II. Пояснения в тексте |
Синтез
молекул главного комплекса гистосовместимости, процессинг и представление
антигенов. Структура молекул МНС I и II классов представлена на рис. 8.15. Молекулы МНС I класса
являются мембранными гликопротеинами, состоящими из одной полипептидной α—цепи, с молекулярной массой 45 кДа. Роль β—субъединицы выполняет нековалентно связанная с α—цепью молекула β2—микроглобулина с молекулярной массой 12 кДа. Ген МНС
расположен в хромосоме 6 человека и 17 мыши. Структурный ген молекулы β2—микроглобулина
локализуется вне МНС, в другой хромосоме. Установлено, что αцепь состоит из трех внеклеточных доменов α—1, α—2 и α—3), гидрофобного трансмембранного участка и короткой
цитоплазматической части. Существует множество аллельных вариантов гена,
кодирующего αцепь
молекулы I класса, тогда как аллельный полиморфизм у β2—микроглобулина проявляется в слабой степени.
Молекулы МНС II класса также являются мембранными гликопротеинами
и состоят из гомологичных полипептидных цепей с молекулярной массой
соответственно около 35 кДа (α—цепь) и 29
кДа (β—цепь). Так же как и у
молекул МНС I класса, для антигенов II класса существует множество аллельных
вариантов.
Продукты
генов МНС III класса — три компонента системы комплемента:
С2, С4 и фактор В.
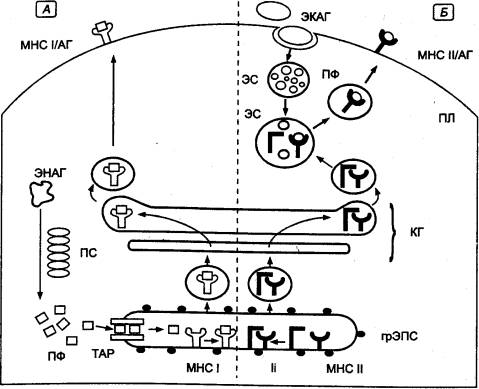
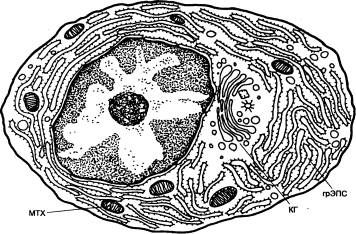
Молекулы МНС I класса синтезируются
в гранулярной эндоплазматической сети (грЭПС) (рис. 8.16), где они образуют
комплексы с антигенами, представляющими собой эндогенно синтезированные
молекулы (вирусные белки в инфицированных клетках или белки опухолевых клеток).
Эти антигены подвергаются предварительному расщеплению в особом
протеолитическом АТФ—зависимом крупном белковом комплексе — протеосоме.
Образующиеся при этом короткие пептидные фрагменты транспортируются в просвет грЭПС
с помощью специальных переносчиков в мембране — ТАР—белков (англ. Transporter for Antigen
Presentation —
переносчик для представления антигена), где связываются с молекулами МНС I
класса. Образовавшиеся комплексы транспортируются через комплекс Гольджи и
экспрессируются на поверхности АПК. Молекулы МНС I класса обнаруживаются на
поверхности всех клеток и тромбоцитов, благодаря чему распознающие их
цитотоксические лимфоциты имеют возможность уничтожения любых зараженных или
опухолевых клеток.
Молекулы МНС II класса также
образуются в грЭПС (см. рис. 8.16.), где они формируют комплекс с так
называемой инвариантной пептидной цепью (II).
|
|
|
Рис. 8.16 Схема синтеза
молекул главного комплекса гистосовместимости I и II классов, процессинга и представления
антигенов А — молекулы
главного комплекса гистосовместимости I класса; Б — молекулы главного комплекса гистосовместимости II класса. АГ — антиген; грЭПС —
гранулярная (шероховатая) эндоплазматическая сеть; КГ — комплекс Гольджи; МНС
— главный комплекс гистосовместимости; МНС/АГ —
комплекс молекул главного комплекса гистосовместимости с антигенными
пептидами; ПЛ — плазмалемма; ПС —
протеосома; ПФ — пептидные фрагменты; ТАР — белок—переносчик для
представления антигена; ЭКАГ — экзогенный антиген; ЭНАГ — эндогенный антиген; ЭС — эндосома; И — инвариантные цепи. |
Гликопротеины
МНС II класса экспрессируются на «профессиональных» АПК (макрофагах, дендритных
АПК и В—лимфоцитах), что обеспечивает их взаимодействие с Т—лимфоцитами.
Известно, что способность молекул МНС образовывать комплексы с антигенными
пептидами различается у отдельных людей, что может оказывать влияние на
особенности их иммунных реакций, в частности, на устойчивость к инфекциям.
АПК, захватившие антиген, мигрируют из тканей в лимфатические капилляры,
а оттуда — в Т—зависимые зоны регионарных лимфатических узлов, где они
окончательно созревают и приобретают способность к представлению антигенов
лимфоцитам. Только небольшая часть антигенов может связываться с мигрирующими
дендритными клетками. Часть антигена, проникшего в ткани, вероятнее всего,
окажется в дренирующем лимфатическом узле. Антигены, захваченные в верхних
дыхательных путях или кишке, попадают в лимфоидные ткани, ассоциированные со
слизистыми оболочками (MALT, англ. Mucosal Associated Lymphoid Tissue). Антиген,
проникший в кровь, попадает в селезенку. Макрофаги в печени и легких могут
фагоцитировать антигены, но это, как правило, не приводит к иммунному ответу. В
лимфоидных тканях антигены могут поглощаться и разрушаться макрофагами.
Некоторые антигены специфически связываются с антиген—распознающими рецепторами
В—лимфоцита, образовавшийся комплекс далее поглощается с помощью механизма
рецепторно—опосредованного эндоцитоза, подвергается процессингу и
экспрессируется на поверхности В—лимфоцитов в виде пептидов, связанных с
молекулами МНС II класса.
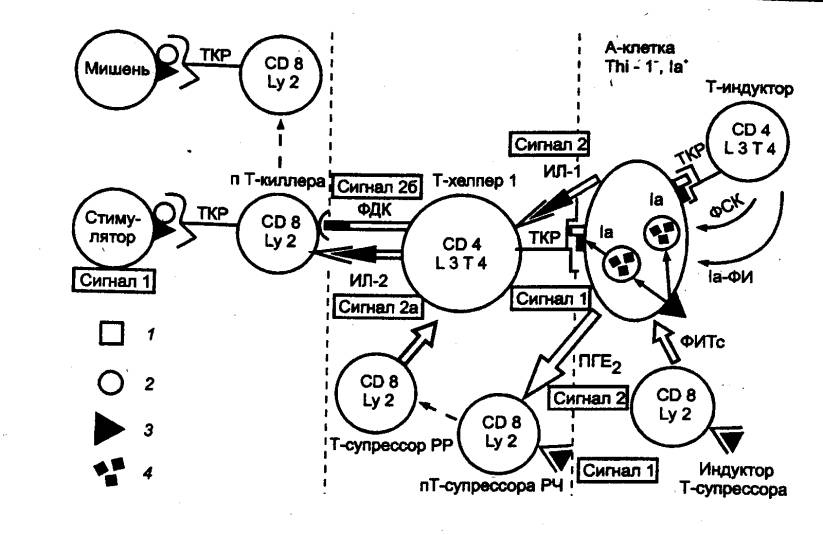
При встрече
с Т—лимфоцитом, обладающим рецепторами к соответствующему антигену, АПК
контактно взаимодействует с ним, активируя его и инициируя развитие иммунной
реакции. Характер этой реакции зависит от природы молекул МНС, связанных с
антигеном. Антигены, образующие комплекс с молекулами МНС I класса,
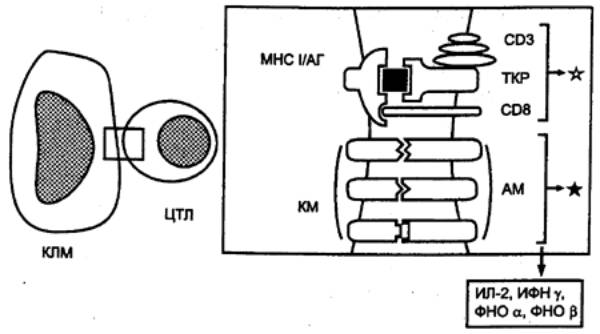
распознаются у человека лимфоцитами с поверхностными маркерами CD8+, а
антигены, связанные с белками МНС, II класса — лимфоцитами с фенотипом CD4+.
Полноценное
функционирование АПК способствует эффективному и своевременному распознаванию
микробных, вирусных и опухолевых антигенов, что препятствует развитию инфекций
и новообразований. Последние часто протекают на фоне сниженной активности АПК,
поэтому стимуляция деятельности этих клеток рассматривается как перспективный
метод иммунотерапии таких заболеваний.
T—лимфоциты,
их цитофизиология и участие в иммунных реакциях. В
периферической крови человека Т—лимфоциты составляют в среднем 1030% всех
лейкоцитов и более 50% всех лимфоцитов. В отличие от В—лимфоцитов они обладают
высокой способностью к рециркуляции, поэтому их содержание в грудном
лимфатическом протоке чрезвычайно велико (около 90%). T—лимфоциты выполняют
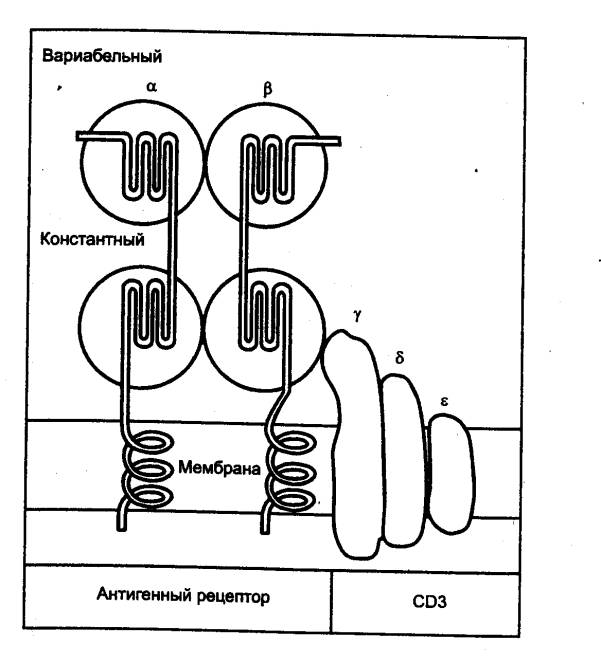
следующие функции: 1) с помощью имеющихся на их поверхности Т—клеточных
рецепторов (ТКР) обеспечивают специфическое распознавание антигенных
детерминант (эпитопов); 2) специализированные сенсибилизированные T—лимфоциты—киллеры
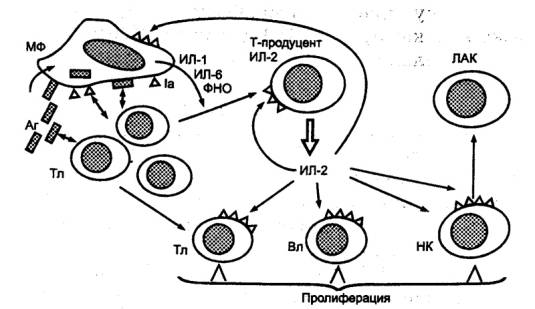
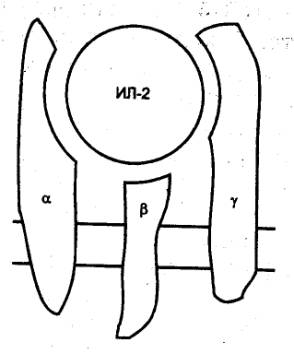
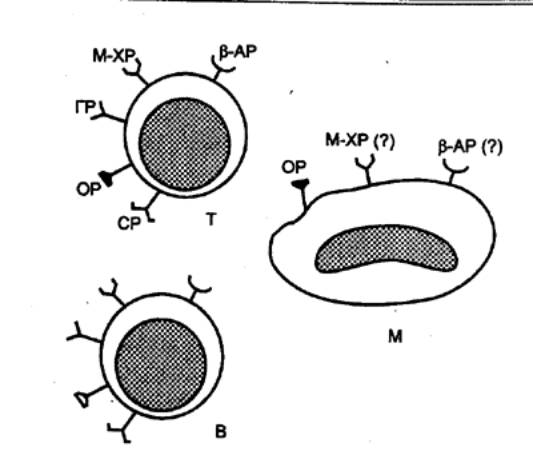
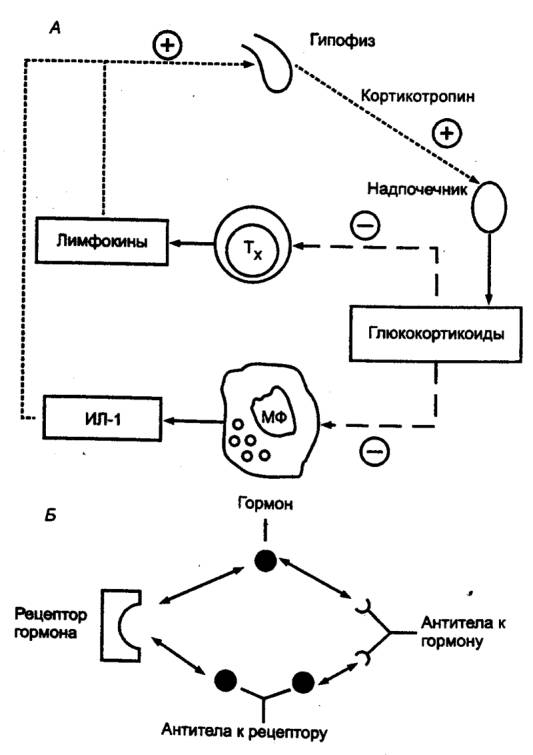
— ЦТЛ осуществляют элиминацию антигенов; 3) специальные субпопуляции Т—лимфоцитов обеспечивают регуляцию иммунного ответа,
активируя или угнетая иммунные реакции; 4) осуществляют регуляцию гемопоэза
путем выделения соответствующих гемопоэтических факторов;
5)
участвуют в регуляции пролиферации нелимфоидных клеток путем секреции
соответствующих цитокинов; 6) играют важную роль в поддержании структурного
гомеостаза организма благодаря продуцируемым цитокинам, которые оказывают
влияния на нервную и эндокринную системы.
Образование Т—лимфоцитов —
процесс более сложный и многоступенчатый по сравнению с образованием других
иммунокомпетентных клеток. Он включает две фазы: антигеннезависимую и
антигензависимую.
Антиген—независимая
фаза образования T—клеток осуществляется последовательно в двух
органах: в костном мозге и в вилочковой железе (тимусе). Антиген—зависимая фаза
дифференцировки этих клеток проходит во вторичных лимфоидных органах, где
преимущественно размножаются клоны тех клеток которые имеют специфические
рецепторы к внедрившемуся антигену. При этом резкое увеличение специфического
клона Т—лимфоцитов наблюдается на 45
сут (первичный иммунный ответ) или на 34 сут (вторичный иммунный ответ) после
внедрения в организм чужеродного материала.
В костном мозге из полипотентной
стволовой кроветворной клетки образуется пул стволовых лимфоидных клеток, а из
него — пул предшественников T—клеток (преT—клетки). Костномозговые преT—клетки
имеют поверхностный маркер SP1 (антиген
мозга), могут появляться на поверхности так называемые дифференцировочные
антигены, присущие практически всем Т—лимфоцитам. Поверхностные функциональные
маркеры в соответствии с принятой международной номенклатурой обозначаются
аббревиатурой CD (от англ. Cluster of Differentiation — группа дифференцировки)
с добавлением цифровых и буквенных символов. Появляющиеся на пре—Т—клетках
человека дифференцировочные антигены обозначаются как CD2 и CD3. Для этих
клеток характерно высокое содержание терминальной
дезоксинуклеотидилтрансферазы (ТДТ) — фермента, обеспечивающего встраивание
дополнительных нуклеотидных последовательностей в сегменты ДНК, кодирующие
вариабельные участки со стороны N—конца будущей белковой молекулы одной из
полипептидных цепей Т—клеточный антигенраспознающий рецептор (ТКР). Интенсификация
этого встраивания увеличивает структурное разнообразие ТКР на последующих
этапах развития Т—лимфоцитов . Пре—T—клетки, привлекаемые специальными
хемотаксическими факторами, через кровоток попадают в вилочковую железу.
Вилочковая
железа (тимус) представляет собой окруженный капсулой лимфоидный
орган, который располагается за грудиной в переднем средостении.
Этот
лимфоэпителиоидный орган представляет собой эволюционное приобретение
позвоночных животных. У всех беспозвоночных он отсутствует, даже в зачаточной
форме. Возникновение этого органа у позвоночных животных рассматривается как
ключевое событие в эволюции иммунитета и может быть отнесено к ароморфозу, так
как повысило эффективность работы всей системы специфической иммунной защиты. В
тимусе происходит формирование основных функционально активных субпопуляций T—клеток,
заселяющих периферию зрелыми эффекторными и регуляторными клетками,
принимающими непосредственное участие в иммунном реагировании.
Тимус
является первым лимфоидным органом, возникающем в процессе эмбриогенеза у
млекопитающих и птиц. У млекопитающих орган представлен двумя долями, каждая из
которых подразделяется на более мелкие дольки, частично отделенные друг от
друга выростами капсулы, называемыми трабекулами. Периферическую часть дольки
занимает кора, центральную часть — мозговое вещество (рис. 8.17). Важную роль в
функционировании тимуса играет строма, состоящая, главным образом, из
эпителиальных клеток. Эпителиальные клетки тимуса синтезируют ряд пептидных
гормонов, из которых четыре изучены достаточно хорошо. К ним относятся тимулин,
α— и β—тимозин, тимопоэтин, активным центром последнего является
пентапептид ТР5. Указанные пептидные гормоны участвуют в многоэтапной
дифференцировке лимфоцитов в тимусе. T—лимфоциты, находящиеся в тимусе, имеют
общую антигенную детерминанту, отличающую их от T—клеток в других органах и
тканях. В связи с этим их принято называть тимоцитами.
Специализированные
крупные эпителиальные клетки наружного коркового слоя, так называемые «клетки—кормилицы»,
контактируют с большим количеством лимфоцитов, среди которых много
активированных клеток—лимфобластов. Дендритные эпителиальные клетки внутренней
части коркового вещества имеют разветвленные отростки с большим количеством
молекул МНС II класса на поверхности. Эти клетки, соединенные Своими
отростками, образуют сеть, сквозь которую тимоциты должны пройти при переходе
из коркового вещества в мозговое. При этом тимоциты должны также пройти через
барьер, образованный макрофагами на границе двух слоев. В мозговом веществе
тимуса имеются
|
|
|
Рис. 8.17 Клеточное строение
дольки тимуса 1 —
лимфобласт, 2 — гибнущая
клетка, 3 — делящийся лимфоцит, 4 —
дендритная эпителиальная клетка коркового вещества, 5 — капсула, 6 — корковое вещество, 7 — септа, 8 — мозговое вещество, 9 — интердигитатная клетка, 10 — тельце вилочковой железы
(Гассаля), 11— эпителиальная
клетка, 12— рыхлые скопления
малых лимфоцитов мозгового вещества, 3 — макрофаг, 14 — плотные агрегаты малых лимфоцитов коркового вещества. |
эпителиальные
клетки с более широкими отростками, чем в корковом веществе. На поверхности
последних экспрессированы антигены МНС не только II класса но и I класса. В этой зоне тимуса обнаруживаются
также интердигитатные клетки костномозгового происхождения и макрофаги.
Все перечисленные клетки взаимодействуют с делящимися лимфобластами средних
размеров.
Пре—T—клетки,
имеющие поверхностный маркер SP1 (антиген
мозга), концентрируются в субкапсулярной зоне. Здесь под влиянием гормонов
тимуса и, возможно, цитокинов (например, ИЛ7) происходят первые события,
связанные с реорганизацией генома пре—T—клеток. Основные направления
внутритимусной дифференцировки тимоцитов представлены на рис. 8.18.
Кортикальные тимоциты начинают экспрессировать специфичные для коркового слоя
маркеры (CD1 у
человека, TL у мышей),
постоянные маркеры Т—лимфоцитов (CD2 и CD5 у
человека, Thyl у мышей) и
маркеры, специфичные для популяции хелперов/индукторов и
цитотоксических/супрессорных лимфоцитов (CD4 и CD8).
Постепенно почти все клетки начинают экспрессировать ТКР, образованный двумя
полипептидными цепями, соединенными с CD3 (рис.
8.19). Тимоциты перемещаются из коркового вещества в мозговое, где происходит
разделение клеток—носителей CD4 и CD8 с параллельной дифференцировкой лимфоцитов
на T—хелперы и цитотоксические (супрессорные) T—лимфоциты.
Экспрессируемые αβТКР+
выступают в качестве структур клеточной поверхности, посредством которых
реализуется внутритимусный процесс позитивной и негативной селекции
соответствующих Т—клонов— одного из наиболее
|
|
|
Рис. 8.18 Внутритимусная
дифференцировка T—клеток CD4 — маркер T—хелперов/индукторов; CDS — маркер Т—киллеров/супрессоров; ТКР — Т—клеточный
антигенраспознающий рецептор; IL2R — рецептор к IL2; α, β — полипептидные цепи ТКР; Н2К —
антиген главного комплекса гистосовместимости I класса у мышей. |
|
|
|
Рис. 8.19 Т—клеточный рецептор — трансмембранный гетеродимер из двух
полипептидных цепей α
и β, каждая из которых содержит вариабельный и константный домены
Рецептор прочно связан с маркерной молекулой —дифференцирующим
антигеном, появляющимся на пре—Т—клетках человека (CD3), которая состоит из трех цепей: γ (гамма),
δ (дельта), ε (эпсилон). |
|
|
|
Рис. 8.20 Дифференцированные
маркеры Т—лимфоцитов человека и мыши
в процессе развития этих клеток в тимусе TdT —
терминальная дезоксинуклеотидилтрансфераза; Тр — Т—клеточный α,β —рецептор, соединенный с
ТЗ; ЭБ — эритроциты барана. Эквивалентные маркеры человека и мыши: Tl/LyI, T4/L3T4, T8/Ly2, T6/TL. |
важных
событий в дифференцировке тимоцитов. ТКР распознают экзогенный чужеродный антиген,
экспрессированный на поверхности АПК, только в комплексе с молекулами МНС I и
II класса. ТКР обладают способностью к двойному распознаванию — чужеродного
антигена и собственного антигена МНС. Распознавание «своего» является тем
событием, которое определяет положительный отбор «нужных» организму клонов
тимоцитов. При этом тимоциты с ТКР, не способными к самораспознаванию, гибнут.
Структура участка ТКР, взаимодействующая с антигенами МНС, должна быть такой,
чтобы его аффинность к собственным антигенам не была слишком высокой. Клоны с
высокоаффинными антигенраспознающими участками уничтожаются.
Позитивная
и негативная селекция тимоцитов, осуществляющаяся во внутреннем слое коры
тимуса, создает условия для дальнейшей дифференцировки отобранных клонов на
функционально активные субпопуляции (рис. 8.20). Если позитивная селекция
направлена на распознавание антигенов МНС I класса, в мозговом веществе
происходит формирование CD4+CD8+TKP+клoнoв. В
тех случаях, когда ТКР тимоцитов распознают антигены МНС II класса, происходит
формирование CD4+CD8—TKP+клoнoв.
Таким
образом в медуллярной зоне завершается внутритимусная дифференцировка
тимоцитов, приводящая к формированию субпопуляций с хелперной/индукторной (CD4+CD8)
и киллерной/супрессорной (CD4—CD8+) функциями. Выселяющиеся
из медуллярной зоны тимоциты имеют также рецепторы к ИЛ2 и могут продуцировать
этот цитокин. Они мигрируют в кровь, а затем в периферические лимфоидные или
лимфомиелоидные органы (лимфатические узлы, пейеровы бляшки кишки, миндалины,
селезенку), локализуясь в их Т—областях (рис. 8.21, 8.22). При этом T—лимфоциты
покидают кровеносные сосуды в особых участках через посткапиллярные венулы с
высоким эндотелием. Эти клетки через лимфу могут вновь попадать в кровь.
Лимфоциты из
|
|
|
Рис. 8.21
Строение лимфатического узла МС — медуллярные синусы; МТ — медуллярные тяжи. 1 — поток лимфы, 2 — афферентные сосуды, 3 — клапан,
4 — краевой синус, 5 —
соединительнотканная капсула, 6 —
кортикальная область (В—клеточная), 7 — паракортикальная область (Т—клеточная),
8 — артерия лимфоузла, 9 — вена лимфоузла, 10 — ворота органа, 11 — первичный лимфоидный фолликул,
12 — вторичный фолликул с
мантией из малых В—лимфоцитов и зародышевым центром. |
|
|
|
Рис. 8.22
Строение селезенки 1 — вена, 2 — артерия, 3 — фолликул с
зародышевым центром, 4 —
краевая зона (В—клеточная), 5 — Т—клеточная область, 6 — селезеночные тяжи, 7
— венозные синусоиды, 8 — артериола. |
|
|
|
Рис. 8.23 Циркуляция
лимфоцитов в лимфоидной ткани, ассоциированной со слизистыми оболочками Антигенреактивные клетки перемещаются из пейеровых бляшек
(возможно, из легкого и других
скоплений диффузной лимфоидной ткани в слизистых оболочках) и заселяют
собственную пластинку слизистой оболочки кишки и другие слизистые поверхности
(волнистые линии). Аг — антиген; IgA —
иммуноглобулин А |
|
|
|
|
|
Рис.
8.24 Миграция Т—лимфоцитов через
высокий эндотелий посткапиллярных венул БМ—
базальная мембрана; ЭНД— эндотелиальная клетка. Лимфоцитарная адгезия к
эндотелию включает так называемый адгезивный каскад — последовательную быструю смену различных адгезивных
молекул от момента прикрепления Т—клеток до их выхода в окружающую ткань. 1— образование слабых контактов Т—лимфоцитов с эндотелием (нестабильное
взаимодействие); 2— выделение триггерных сигналов, активирующих функцию Т—клеточных
интегринов; 3— возникновение
сильной адгезии Т— клеток к эндотелию; 4— миграция Т— лимфоцитов к
межэндотелиальным контактам и их проникновение в окружающие ткани. |
сосудистого русла
направляются и в ткани органов, не относящихся к иммунной системе, мигрируя через
стенку мелких кровеносных сосудов (посткапиллярных венул) с обычным (плоским)
эндотелием. До встречи с антигенами такие лимфоциты называют «наивными» (не
имевшими «опыта» взаимодействия с антигеном).
Антигензависимая
фаза развития Т—лимфоцитов
происходит во вторичных лимфоидных органах и тканях (лимфатических
узлах, селезенке, пейеровых бляшках и др.). Известно, что T—лимфоциты способны
взаимодействовать только с антигеном, представленным им особыми АПК, в которых
антиген ранее был подвергнут процессингу. T—клетки поступают в ткани и
лимфатические узлы по афферентным лимфатическим сосудам, проникая через стенки
посткапиллярных венул с так называемым высоким эндотелием (рис. 8.23).
Эфферентные
лимфатические сосуды, отходящие от последнего узла каждой цепочки лимфатических
узлов, соединяются, образуя грудной проток, по которому лимфоциты возвращаются
обратно в кровь (грудной проток у человека открывается в левую подключичную
вену). В селезенку T—лимфоциты поступают из артериол, а покидают ее по
селезеночной вене. Миграция Т—лимфоцитов
в лимфоидную ткань называется хомингом (от англ. homing — возвращающийся домой). регуляция
хоминга T—клеток обеспечивается благодаря следующим принципам: 1) каждая линия
иммунных клеток обладает собственными механизмами миграции; 2) покоящиеся
клетки мигрируют в лимфатические узлы, а T—клетки памяти мигрируют первично в
нелимфоидную ткань; 3) клетки памяти мигрируют преимущественно в ткани, где они
ранее были стимулированы антигеном; 4) воспаление вызывает скопление Т—лимфоцитов и уменьшает селективность, которая управляет
нормальным хомингом. В основе хомингового движения лежит специфическое
взаимодействие адгезивных молекул на Т—клетках и эндотелии, которое
обеспечивает региональную специфичность Т—клеточных субпопуляций (рис. 8.24).
В
результате взаимодействия с антигеном T—лимфоциты активируются, пролиферируют
(экспансия клона), секретируют разнообразные цитокины (лимфокины), вновь
поступают в кровь, а из нее — повторно в ткани (процесс рециркуляции), где они
осуществляют свои защитные функции. Часть лимфоцитов превращается в
долгоживущие T—клетки памяти, которые сохраняют в течение всего времени своего
существования усиленную экспрессию ТКР и ряда других маркеров. Последнее
обстоятельство определяет высокую чувствительность этих клеток к повторному
действию антигена. Рециркулирующие T—лимфоциты живут 46 месяцев, а T—клетки
памяти сохраняются преимущественно в лимфоидных органах в течение многих лет.
Специфика
участия Т—лимфоцитов в различных
защитных реакциях обусловлена их принадлежностью к одной из функциональных
групп (табл. 8.1). Функциональные группы Т—лимфоцитов объединяют: 1) клетки—помощники (индукторы T—хелперов — ИТх,
индукторы T—супрессоров — ИТс, T—хелперы 1 — Tx1, T—хелперы 2 — Tx2),
вызывающие активацию Т или В—клеток, 2) клетки—эффекторы — ЦТЛ, непосредственно
осуществляющие защитные реакции, 3) клетки—регуляторы (T—супрессоры — Тc, Т—контрсупрессоры
— Ткс), влияющие на межклеточные взаимодействия, 4) клетки памяти, сохраняющие
иммунологическую «память» о первичном контакте с антигеном (Тп).
Взаимодействие
Т—лимфоцитов с антигенами и их участие
в иммунных реакциях. Для активации покоящихся Т—лимфоцитов необходимы два сигнала (рис. 8.25). Роль
первого может выполнять антиген, связанный с молекулами
Таблица 8.1
Субклассы Т—лимфоцитов, их функции
и маркеры мембраны
|
Субклоны
Т—клеток |
Функции |
Факторы Т—субклассов |
Маркеры |
|
Помощники(активаторы) |
|||
|
Индукторы
Т—хелперов |
Экспрессия
Ia молекулы на макрофагах и других
А—клетках. Секреция ИЛ—1 макрофагами |
ФАМ, 1а—ФИ,
γ—ИФН, ФСК—ГМ |
CD4+(CD8—),
CD29 |
|
Индукторы
Т—супрессоров |
Активация
дифференцировки предшественников Т—супрессоров |
ФИТс |
CD4+(CD8—),
2H4(CD45R, Lew18) |
|
Т—хелперы
1 |
Дифференцировка
ЦТЛ, ГЗТ, активация Т—хелперов 2 |
ИЛ—2, ИЛ—3,
γ—ИФН,
ФНО, ЛТ |
CD4+(СD8—), CD45, 4В4, СВ44(ГПФ—1) |
|
Т—хелперы
2 |
Пролиферация
и активация B—клеток,
синтез антител, подавление Т—хелперов 1 |
ИЛ—4, ИЛ—5,
ИЛ—6 |
CD4+(CD8—),
4В4, CD28 |
|
Эффекторы |
|||
|
ЦТЛ |
Лизис
клеток (трансплантата, опухоли, инфицированных вирусами, бактериальными и
другими белками) |
Сериновая
протеаза in vivo |
CD8+(CD4—), CD28 |
|
Перфорин in, vitro |
То же |
||
|
Регуляторы |
|||
|
Т—супрессоры |
Подавление
функций Т—хелперов 1 и 2, В—клеток |
ТсФ |
CD8+(CD4—), CD11,C1,C4,I—J1(CD28—) |
|
Т—контрсупрессоры |
Подавление
функции Т—супрессоров: развитие резистентности Т—хелперов к эффекту Т—супрессоров |
ТксФ |
(CD4—,CD8—), I—J3,
рецептор к Vicia
villosa |
Примечание. ФАМ — фактор активации
макрофагов; Iа—ФИ —
фактор индукции Ia—молекулы;
ИФН — интерферон; ФСК—ГМ — фактор
стимуляции роста колоний гранулоцитов и макрофагов;
ФИТс— фактор индукторов Т—супрессоров;
ИЛ— интерлейкин; ЦТЛ— цитотоксический Т—лимфоцит; ГЗТ — гиперчувствительность
замедленного типа; ФНО — фактор некроза опухолей;
ЛТ —
лимфотоксин; ГПФ — гликопротеин фагоцитов; ТсФ — фактор Т—супрессоров; ТксФ —
фактор Т—контрсупрессоров.
|
|
|
Рис.
8.25 Распознавание антигенов и
активация Т—хелпера (Тх) при его взаимодействии с антигенпредставляющей
клеткой (АПК) Главный активационный сигнал, обозначенный светлой звездочкой
обеспечивается распознаванием посредством ТКР и CD4 на мембране Тх эпитопа
антигена в комплексе с молекулами главного комплекса гистосовместимости II
класса на поверхности дендритной АПК Добавочный активационный сигнал,
обозначенный черной звездочкой обеспечивается взаимодействием костимулирующих
молекул на поверхности АПК с адгезионными молекулами на плазмалемме Т—лимфоцитов
. При активации Тх выделяют ряд цитокинов, состав которых различается у T—хелперов
I порядка (Тх») и T—хелперов II порядка (Тх,) AM адгезионные молекулы; CD3, CD4 поверхностные функциональные маркеры; МНС II/АГ комплекс
молекул главного комплекса гистосовместимости класса II и антигена; ТКР Т—клеточный рецептор |
|
|
|
Рис. 8.26 Биохимические механизмы активации Т—лимфоцитов 5—ГПЭТЕК
— 5—гидропероксиейкозотетраеновая кислота; 5—ГЭТЕК — 5—гидроксиэйкозотетраеновая
кислота; цГМФ — циклический 3',5'—гуанозинмонофосфат. |
МНС класса
II на поверхности АПК. Этот комплекс распознается с помощью ТКР и CD4 или CDSкомпонента на мембране Т—лимфоцита. Тройное
взаимодействие между антигеном, гликопротеином МНС и рецептором Т—лимфоцита
генерирует сигнал, передаваемый Т—клетке через комплекс ТКР с CD3. Одновременно это взаимодействие обеспечивает
воздействие на Т—лимфоцит высокой локальной концентрации ИЛ1 (или других
цитокинов), продуцируемого АПК. В процессе активации T—лимфоциты увеличиваются
в размере, переходят в состояние бласт—трансформации.
Биохимические
механизмы активации T—клеток сложны (рис. 8.26). Среди процессов,
стимулируемых антигеном и ИЛ1, вероятно, наиболее важна активация фосфолипазы
С, расщепляющей Фосфатидилинозитолдифосфат на два медиатора — диацилглицерол и
инозитолтрифосфат. Увеличение концентрации Са2+ в клетке активирует
различные ферментативные системы, что в конце концов приводит к стимуляции
синтеза РНК, белка и ИЛ2. Увеличение концентрации Са2+ в клетке
обусловлено либо открытием кальциевых каналов в плазматической мембране, либо,
что более вероятно, мобилизацией внутриклеточных запасов Са2+ под
влиянием инозитолтрифосфата.
Важным
условием активации Т—лимфоцитов
является способность определенных субпопуляций этих клеток
взаимодействовать лишь с собственными клетками, экспрессирующими молекулы МНС, свойственные
данному организму (рис. 8.27). Эта способность T—клеток носит название рестрикции (от лат. restrictio — ограничение) по МНС.
Молекулы CD4 и CD8 служат
дополнительными рецепторами (корецепторами) молекул МНС II и I классов
соответственно. Благодаря потребности в комбинированном активационном сигнале
предотвращаются возможные реакции на антиген, который не подвергся необходимому
процессингу и представлению, и на собственные антигены. Различные цитокины,
такие как ИФН и ИЛ4, способны повышать плотность распределения молекул МНС II
класса, регулируя таким образом функции АПК. Другие цитокины, подобно ИЛ6 и
ФНО, увеличивают плотность распределения антигенов МНС I класса.
|
|
|
Рис. 8.27 Первичное распознавание антигена Т—хелперами,
Т—супрессорами и Т—киллерами 1 — молекула МНС I класса; 2 — молекула МНС II класса (1а); 3 —
антиген интактный; 4 — антиген процессированный
(пептид). ФДК — фактор дифференцировки киллеров; п — предшественник; РР — радиорезистентный;
ТсФ — фактор Т—супрессора; ПГЕ2 — простагландин Е2; ФСК — фактор стимуляции
роста колоний (стимулирует секрецию ИЛ2); 1аФИ — фактор индукции la молекулы
(МНС II класса); ФИТс — фактор индуктора Т—супрессора; ТКР — Т—клеточный рецептор. Пояснения в тексте. |
Индукторы
T—хелперов
(ИТх) начинают функционировать спустя 1620 ч после появления чужеродного
материала. Реагируя на процессированный анти ген и молекулы МНС II класса, ИТх
быстро секретируют факторы, которые способствуют экспрессии молекул МНС II
класса (la молекулы) на поверхности макрофагов, а также синтезу ИЛ1 теми же
макрофагами.
T—хелперы (Тх) играют важную роль в
деятельности иммунной системы — распознавании антигена, запуске реакций
клеточного и гуморального иммунитета, регуляции взаимодействий Т—лимфоцитов друг с другом и между Т— и В—лимфоцитами,
продукции лимфокинов. Главная их функция — стимулирующее (хелперное) влияние на
эффекторные клетки. Они экспрессируют на своей поверхности ТКР и антигенную
детерминанту — молекулу CD4
Распознавание комплекса
молекулы МНС II класса и антигена который находится на поверхности АПК
(дендритная АПК, макрофаг, интердигитатная
клетка, В—лимфоцит),
осуществляется посредством ТКР и CD4 на мембране Tх (см. рис. 8.258.27).
Подклассы Тх — Tx1 и Тх2,
различаются характером цитокинов (лимфокинов), секретируемых при активации,
экспрессией некоторых костимулирующих адгезивных молекул, а также
функциональной ролью в различных звеньях иммунитета. Поддержание соотношения
между подклассами Тх представляется весьма важным для течения и исхода
инфекционных и аутоиммунных заболевании. взаимодействия между «наивными» Т—клетками
и их подклассами представлено на рис. 8.28. Клетки каждого подкласса усиливают
дифференциоовку «наивных» T—клеток в свой подкласс Тх. За дифференцировку
Tx1
отвечают преимущественно за реакции клеточного иммунитета и воспаления, а
также, частично, за некоторые реакции гуморального иммунитета (связанные с
деятельностью фагоцитов). Тх2 стимулируют реакции гуморального
иммунитета, а также участвуют в ряде регуляторных механизмов. Они продуцируют
ИЛ4, ИЛ5, ИЛ6, ИЛ9, ИЛ10, ИЛ13, ФСКГМ (колониестимулирующий фактор для клеток
гранулоцитарно—моноцитарного ряда) Указанные лимфокины вызывают активацию В—лимфоцитов,
усиливается их пролиферация и диффepeнциpoвкa в плaзмaтичecкиe клетки,
вырабатывающие IgM, IgA, IgG (не связывающие комплемент), а также IgE (что
способствует развитию аллергических реакций),
Относительное содержание Тх в
крови в норме у здорового человека составляет около 2/3 циркулирующих Т—лимфоцитов
. Снижение содержания Тх
|
|
|
Рис. 8.28 Развитие T—хелперов
и взаимодействие их подклассов Тхо — предшественник Т—лимфоцитов («наивная» Т—клетка); Tx1 — Т—лимфоцит первого порядка; Тх2 — Т—лимфоцит
второго порядка. Цитокины, выделяемые Тх каждого подкласса, усиливают
образование клеток своего подкласса (стрелки со знаком «+») и угнетают
развитие и активность клеток другого подкласса (стрелки со знаком «»). |
имеет место
при различных врожденных и приобретенных иммунодефицитных состояниях. Оно может
возникать при проникновении в клетки вируса иммунодефицита человека (ВИЧ) путем
прикрепления к молекулам CD4 и, следовательно,
является признаком синдрома приобретенного иммунодефицита (СПИД). Именно внутри
Тх образуется более 99% из 1010 вирусных частиц, появляющихся
ежедневно в организме ВИЧ—инфицированного больного. Причины возникновения
дефицита Тх остаются пока невыясненными. Предполагают, что дефицит Тх может
возникать в результате разрушения Тх вирусом или цитотоксическими лимфоцитами.
Потеря большого количества Тх приводит к иммунной недостаточности,
проявляющейся в развитии тяжелых инфекций, опухолей, неврологических
расстройств.
Индукторы T—супрессоров (ИТс), как
полагают, играют важную роль в активации дифференцировки T—супрессоров (Тс), т.
е. вносят вклад в подавление иммунного ответа. Эти клетки имеют такой же
фенотип, что и Тх, т. е. CD4+(CD8), однако несут на своей
поверхности антигенные детерминанты, характерные только для данного субкласса Т—лимфоцитов
. ИТс, будучи активированы нативным антигеном, продуцируют фактор ИТс (ФИТс).
Последний, воздействуя на макрофаги и другие АПК, стимулирует синтез и выделение
ими простагландина Е2, который, в свою очередь, активирует Тс (см. рис.
8.27, 8.28).
T—супрессоры (Тс), на
поверхности которых имеются ТКР и молекулы CD8, распознают эпитопы антигенов в комбинации с продуктами системы
МНС I класса (см. рис. 8.27). Клетками—мишенями Тс являются В—лимфоциты, Тх и
ЦТЛ. Функция Тс заключается в угнетении активности иммунных реакций путем
непосредственного контактного воздействия на указанные клетки или секреции
угнетающих (супрессорных) факторов (ТсФ). Тс подавляют развитие аутоиммунных
реакций. Возникновение иммунодефицита при жизнедеятельности организма в
экстремальных условиях (облучение УФ—лучами, обширные ожоги и травмы, опухоли,
вирусные и бактериальные инфекции) обусловлено, прежде всего, активацией Тс.
Тс, прямо контактируя с мембраной Тх, подавляют секрецию цитокинов Тх и
экспрессию рецепторов к ИЛ1, ИЛ2, а также иных структур на мембране Тх и
угнетают нарастание уровня Са2+ в цитоплазме Тх.
Функция Те
может быть полезной и необходимой. В организме эмбриона, новорожденного
животного и человека активированные Тс, блокируя пролиферацию Тх—клеток и
генерацию ЦТЛ, способствуют развитию толерантности к собственным белкам и
блокируют иммунный ответ лимфоцитов матери, проникших в организм
новорожденного, на аллоантигены самого новорожденного. В дальнейшем Тс угнетают
аутоиммунные процессы и подавляют развитие аллергии с помощью ингибирования
синтеза иммуноглобулина класса Е. Высказывалось мнение, согласно которому роль
Тс могут играть Tx1 и Тх2, которые вырабатывают ряд
цитокинов, способных угнетать активность лимфоцитов
и макрофагов.
Цитотоксические T—лимфоциты (ЦТЛ), или Т—киллеры
(Тк), посредством ТКР и молекулы CD8 распознают эпитопы антигенов в комплексе с
молекулами
|
|
|
Рис.
8.29 Распознавание антигенов на
поверхности клетки—мишени и активация цитотоксических Т—лимфоцитов (ЦТЛ) Главный активационный сигнал (светлая звездочка)
обеспечивается распознаванием Т—клеточным рецептором (ТКР) и CDS на мембране ЦТЛ эпитопа антигена в комплексе с
молекулами главного комплекса гистосовместимости I класса (МНС 1/АГ) на
поверхности клетки—мишени (КЛМ). Дополнительный активационный сигнал (черная
звездочка) обеспечивается взаимодействием костимулирующих молекул (КМ) на
поверхности КЛМ с адгезионными молекулами (AM) на поверхности ЦТЛ. При активации ЦТЛ выделяет ряд
цитокинов. |
|
|
|
Рис. 8:30 Контактное действие
цитотоксического Т—лимфоцита (ЦТЛ) на клетку—мишень (КЛМ) 1 — ЦТЛ секретирует
в межклеточную щель белки—перфорины (П), которые встраиваются в плазмалемму
КЛМ (белые стрелки) и образуют в ней трансмембранные поры, вызывающие
нарушение осмотического равновесия КЛМ (пунктирная стрелка) и ее гибель; 2 — апоптоз КЛМ (стрелка в виде
«молнии») индуцируется в результате введения (черная стрелка) в ее цитоплазму
через ранее образованные поры в плазмалемме сериновых протеиназ—гранзимов
(ГР), синтезируемых и выделяемых ЦТЛ; 3 — индукция апоптоза КЛМ (стрелка в
виде «молнии») в результате взаимодействия Fas—лиганда (FasL) на поверхности ЦТЛ с антигеном Fas (APO1) на
плазмалемме КЛМ. |
МНС I класса (рис. 8.29).
Распознавание антигенов и активация ЦТЛ происходит под влиянием двух основных
сигналов: 1) взаимодействие TKPCD8 на Тк с комплексом МНС I
класса/эпитоп антигена на клетке—мишени; 2) воздействия цитокинов, выделяемых
Тх, макрофагами и АПК. Активированные ЦТЛ продуцируют ИФН—γ и ИЛ2,
стимулируют представление антигенов, активируют клетки, участвующие в
воспалении, и уничтожают клетки—мишени, зараженные вирусами, грибами и
некоторыми бактериями, очищая от них организм.
При встрече с различными
клетками ЦТЛ обследуют их поверхность в поисках антигенного эпитопа. При
обнаружении клетки—мишени зрелый Тк связывается с ней и оказывает на нее
летальное цитотоксическое воздействие. После этого воздействия, иначе
называемого «смертельным ударом», или «смертельным поцелуем», осуществляемого
исключительно прицельно и не повреждающего соседние клетки, Тк отсоединяется от
гибнущей клетки—мишени и через некоторое время готов лизировать следующую
жертву. Активность Тк находится под контролем Тх и Тс, причем Тх действуют
непосредственно на Тк а Тс — опосредованно через угнетение функциональной
активности Тх. Механизмы контактного цитотоксического действия Тк на клетку—мишень
связаны с ее разрушением снаружи и изнутри (рис. 8.30). Различают 3 вида таких
механизмов контактного цитотоксического действия Тк: а) образование пор в
плазмалемме клеток—мишеней; б) индукция апоптоза клеток—мишеней ферментами
введенными в их цитоплазму через поры в плазмалемме; в) индукция апоптоза
клеток—мишенеи, опосредованная поверхностными рецепторами на их плазмалемме
ЦТЛ, вступивший в контакт с клеткой—мишенью,
в присутствии ионов Са2+ направленно (векторно) секретирует в
межклеточное пространство особые белки перфорины, накопленные в
цитоплазматических гранулах. Мономеры белков встраиваются в качестве
трансмембранных белков в плазмалемму клеток—мишеней, а в дальнейшем они
полимеризуются с образованием трансмембранных пор (рис. 8.31). Размер пор
достигает 520 нм (внутренний диаметр наиболее крупных равен 10 нм). Поры,
возникающие в плазмалемме клетки—мишени после контакта с ЦТЛ, подобны тем,
которые образуются при воздействии МАК—компонентов комплемента. Формирование
пор в плазмалемме приводит к нарушению осмотического равновесия клетки—мишени,
ее набуханию и гибели. Образующиеся поры, очевидно, могут служить для
проведения в клетку—мишень веществ, разрушающих клетки—мишени изнутри.
Тк синтезируют и накапливают в гранулах
ряд ферментов, из которых наиболее важной представляется группа сериновых
протеиназ — гранзимов. Будучи выделенными в узкое межклеточное
пространство путем Са2+—зависимого экзоцитоза, гранулы Тк могут
освобождать эти ферменты, которые через трансмембранные поры проникают в
цитоплазму клеток—мишеней и запускают программу апоптоза, вызывающую гибель
клеток.
Т—контрсупрессоры (Ткс) —
специальная категория Т—лимфоцитов , которые продуцируют свой фактор (ТксФ) и
могут угнетать функциональную активность Тс (см. рис. 8.27). После
взаимодействия ТксФ с Тх последние приобретают резистентность к Тс и их
факторам, т. е. секреция ИЛ2 не подавляется.
Физиологическая роль Ткс выявляется
к концу 1й недели жизни ребенка после завершения Тс своей главной функции — обеспечения
сохранности жизни новорожденного. Ткс, подавляя функцию Тс, способствуют
развитию иммунных реакций на раннем этапе жизни. В последующем отсутствие
регуляции аутоиммунитета Тс приводит к развитию аутоиммунных заболеваний типа
энцефаломиелита, красной волчанки, миастении, ревматоидного артрита.
T—клетки ГЗТ (Тгзт)
являются эффекторными клетками иммунных реакций гиперчувствительности
замедленного типа. Они обладают поверхностным антигеном CD4 и экспрессируют ТКР совместно с молекулами МНС II
класса. Тгзт распознают чужеродные антигены, преимущественно продуцируемые
внутриклеточными микроорганизмами. В последние годы накоплены данные,
свидетельствующие о том, что роль Тгзт фактически исполняют Tx1,
обеспечивающие течение указанных реакций. Тгзт, в отличие от Тк, сами не
обладают непосредственным цитотоксическим действием, однако обеспечивают
защитные реакции клеточного иммунитета, вовлекая в них клетки других типов.
Проявлением реакций ГЗТ служат очаги хронического воспаления, состоящие
|
|
|
Рис. 8.31 Образование пор в плазмалемме клетки—мишени
при атаке цитотоксического Т—лимфоцита 1 — мономеры
перфорина (МП) выделяются ЦТЛ в пространство между ним и клеткой—мишенью; 2 — МП связываются с фосфолипидными
головками плазмалеммы (ПЛ) клетки—мишени; 3 — МП претерпевают конформационные
изменения и внедряются в липидный бислой; 4—5— полимеризация МП с образованием поры (П) — агрегата МП
цилиндрической формы, с просветом в центре. Все процессы, начиная со связывания
МП с ПЛ и заканчивая образованием П, являются Са2+—зависимыми. |
преимущественно
из макрофагов и лимфоцитов, часто формирующих характерные компактные структуры
— гранулемы.
Функции
субклассов Т—лимфоцитов в иммунитете и в
первичном распознавании антигена представлены на схеме (см. рис. 8.27). Деление
Т—лимфоцитов на субпопуляции с
хелперной и супрессорной/киллерной функциями, а также способность этих клеток к
продукции регуляторных цитокинов обнаружены у представителей всех классов
позвоночных животных.
|
|
|
Рис. 8.32 Сравнение
клеточного и гуморального иммунитетов |
В—лимфоциты
и плазматические клетки. Гуморальный иммунный ответ в виде продукции антител зависит
от функционирования В—системы специфической иммунной защиты. Центральным
органом системы является костный мозг у млекопитающих или фабрициева сумка
(бурса) у птиц (рис. 8.32). Клеточный состав системы представлен В—лимфоцитами
различной Степени зрелости вплоть до заключительной клеточной формы —
продуцирующих антитела плазматических клеток. В состав В—системы в качестве
важного компонента входят эффекторные молекулы — иммуноглобулины
различных
изотипов, индуцируемый синтез которых есть результат взаимодействия В—клетки с
антигеном при участии вспомогательных клеточных популяций (Тх, макрофагов и
др.). Функции В—лимфоцитов можно определить следующим образом: 1) распознавание
антигенов иммуноглобулиновыми рецепторами; 2) обеспечение реакций гуморального
иммунитета; 3) образование плазмоцитов — клеток, вырабатывающих антитела.
В—лимфоциты, в отличие от T—клеток,
обладают слабой способностью к рециркуляции. В связи с этим В—клетки
практически отсутствуют в лимфе грудного протока, в крови же их количество составляет
не более 30%. Среди В—лимфоцитов преобладают короткоживущие, хотя встречаются и
долгоживущие формы. Характерной особенностью В—лимфоцита является наличие на
его поверхности иммуноглобулинового рецептора, а также рецептора к СЗ—компоненту
комплемента. Кроме того, на поверхности В—лимфоцитов имеются характерные
антигенные маркеры: CD19, CD20, CD22, а также
CD21 — на зрелых В—клетках и CD23 — на плазматических клетках.
Образование В—лимфоцитов и их
активация находятся под контролем нейроэндокринной системы. На поверхности этих
клеток имеется большое число рецепторов к различным гормонам и медиаторам.
Глюкокортикоидные гормоны в больших дозах подавляют антителообразование, в
малых — стимулируют его. В отличие от Т—лимфоцитов В—клетки не способны трансформироваться и пролиферировать под
влиянием таких лектинов растительного происхождения, как фитогемагглютинин и
конканавалин А.
В то время как первые признаки Т—системы
обнаруживаются у беспозвоночных животных и даже у примитивных многоклеточных
(губки, кишечнополостные), В—система специфического иммунитета исторически
развивалась в пределах типа позвоночных животных. Анализ способности к
антителопродукции в филогенетическом ряду указывает на постепенное усиление
этой иммунологической функции от менее организованных позвоночных животных к их
более совершенным формам. У круглоротых продукцию антител к бактериальным
антигенам удается вызвать с трудом, при этом иммунологическая память о
первичном контакте с антигеном не формируется. У костистых рыб гуморальная
форма иммунного реагирования имеет более выраженный характер, вполне
сопоставимый с ответом млекопитающих. В ряде случаев иммунный ответ у рыб
характеризуется созданием иммунологической памяти, хотя и в слабой форме.
Ряд прогрессивных черт в отношении
иммунной реактивности отмечен у бесхвостых амфибий — животных, впервые вышедших
на сушу. Переход от водного к наземному образу жизни помимо
морфофункционального прогресса в целом, очевидно, потребовал совершенствования
системы иммунной защиты. Последнее, вероятно, инициировалось неизбежными
контактами с новыми группами наземных патогенных микроорганизмов. У амфибий
появляется функционирующий в качестве источника В—клеток костный мозг,
возникает достаточно эффективная иммунологическая память, формируются механизмы
повышения аффинности антител по мере развития иммунного процесса и
приобретаются дополнительные изотипы иммуноглобулинов. Эти прогрессивные черты
развития гуморального иммунного ответа эволюционно закрепляются у
пресмыкающихся и птиц, достигая особого совершенства у млекопитающих.
Этапы антигеннезависимой
дифференцировки В—клеток. Предшественники В—лимфоцитов обнаружены в островках
гемопоэтической ткани эмбриональной печени на 89й неделе зародыша. Затем
образование В—клеток в печени постепенно прекращается и в последующем
происходит только в костном мозгу. От полипотентной стволовой кроветворной
клетки формируется коммитированный предшественник лимфопоэза, общий для Т и В—клеточного
пути развития. Особенностью данного клона клеток, отличающего его от других
клеток костного мозга, является наличие специфического поверхностного маркера
(антиген ThB у мышей и CD10 у человека). От предшественника лимфоцитов
возникает родоначальная форма В—клеточного пути развития или предшественник В—клеток
I типа. Незрелые В—клетки являются прямыми потомками предшественников В—лимфоцитов
II типа и представлены в костном мозгу и на периферии, главным образом, в
селезенке и в небольшом количестве в лимфатических узлах. Основные этапы
антигеннезависимой дифференцировки В—лимфоцитов представлены на рис. 8.33.
|
|
|
Рис. 8.33 Этапы,
антигеннезависимой дифференцировки В—лимфоцитов СКК — стволовая кроветворная
клетка; КЛ — коммитированный лимфоцит, общий для Т и В—клеточного путей
развития; ПpBI — предшественник
В—клеток I типа; ПрВII — предшественник В—клеток II типа; НВ — незрелые В—лимфопиты; BI — В—лимфоциты
I типа; ВII — В—лимфопиты
II типа. Пояснения в тексте. |
|
|
|
Рис.
8.34 Зрелые В—клетки экспрессируют набор
разнообразных связанных с мембраной молекул преимущественно гликопротеиновой
природы ВЭБ —
рецепторы вируса Эшптейна—Барра; Ф — фосфорилирующие ферменты; Г —
гликозидазы; И — рецепторы инсулина; Д — рецепторы других гормонов; С —
рецепторы антигенспецифических факторов Т—клеток; Н — рецепторы
антигеннеспецифических факторов Т—клеток. |
На завершающем этапе
дифференцировки В—клеток в костном мозгу на поверхности незрелых В—лимфоцитов
появляются специфический маркер этих клеток (у мышей — мышиный В—лимфоцитарный
антиген), дифференцировочные маркеры В—клеток (у мышей Lyb2), а также иммуноглобулины двух изотипов IgM и IgD. Незрелые
В—лимфоциты уже способны к распознаванию антигена, однако взаимодействие клетки
с антигеном не обеспечивает трансформации лимфоцита в антителопродуценты.
Интенсивность синтеза поверхностных молекул иммуноглобулинов невелика по
сравнению с более зрелыми клеточными формами. Этап становления зрелых клеток
начинается с образования В—клеток I типа, представляющих собой промежуточную
стадию развития между В—клетками и наиболее зрелыми В—клетками II типа. В
отличие от незрелых В—лимфоцитов, В—лимфоциты первого типа начинают
экспрессировать антигены II класса МНС (Ia—белки) и рецептор для Fc фрагмента иммуноглобулина.
Антигеннезависимое развитие В—клеток завершается формированием В—клеточных форм
II типа.
На этой стадии рецепторный и
антигенный комплекс клеточной поверхности выражен с наибольшей полнотой: помимо
первого дифференцировочного антигена (Lyb2 у мышей) появляются следующие (Lyb3, 5), начинается экспрессия рецептора к СЗ—компоненту
комплемента, усиливается выраженность антигенов МНС I класса (рис. 8.34). В
ходе пролиферации и дифференцировки В—клеток в костном мозгу в отсутствие
антигенной стимуляции происходит реаранжировка части генома, ответственной за
антигенную специфичность этих клеток. В результате образуются клетки с огромным
(порядка 109 вариантов) спектром антигенраспознающих рецепторов.
Из костного
мозга «наивные» В—лимфоциты попадают в кровь, неся на своей поверхности
молекулы иммуноглобулинов, которые представляют собой специфические
антигенраспознающие рецепторы (до 104—105 на клетку) а
также характерные маркеры CD19, CD20, CD21, CD22 и CD23. В—лимфоциты
экспрессируют на плазмалемме молекулы МНС I и II классов, рецепторы к СЗ—компоненту
комплемента и Fc участкам молекул иммуноглобулинов.
Механизмы взаимодействия В—лимфоцитов
с антигенами.
Из крови где В—лимфоциты составляют 10—20% циркулирующих лимфоцитов, они
направляются в периферические иммунные органы и заселяют их В—зависимые
области. Скопления В—лимфоцитов представляют собой основные структуры
кортикальной зоны лимфатического узла. В узле, находящемся в состоянии покоя,
они имеют сферическую форму и называются первичными фолликулами. после
стимуляции антигеном В—лимфоциты образуют вторичные фолликулы, в которых корона
(мантия) концентрически упакованных покоящихся малых В—лимфоцитов окружает
бледно окрашенный зародышевый центр
|
|
|
Рис. 8.35 Сравнение
структуры лимфатического узла неиммунизированной (слева) и иммунизированной
(справа) мыши (схема). В результате иммунизации выявлены
следующие особенности: 1 —
зародышевые центры (светлые кружки) представляют собой кластеры делящихся и
дифференцирующихся В—клеточных бластов, отвечающих на локализованный там же
антиген и обеспечивающих проникновение малых В—лимфоцитов в окружающие
серповидные области первичных фолликулов; 2 — расширение мякотных
тяжей мозгового вещества (MB) за счет
плазматических клеток. ВЭВ — посткапиллярные венулы с высоким эндотелием; МС
— синусы мозгового слоя. |
(рис.
8.35). Последний содержит крупные интенсивно пролиферирующие лимфобласты,
макрофаги и специализированные АПК.
В В—зависимой зоне в результате взаимодействия с антигеном (и Тх)
происходит активация и пролиферация В—лимфоцитов. Это завершается созреванием и
дифференцировкой активированных В—лимфоцитов в плазматические клетки,
продуцирующие антитела, и В—клетки памяти. Антитела могут продуцироваться и
самими активированными В—лимфоцитами, тем не менее главным источником антител
являются плазматические клетки.
Часть активированных В—лимфоцитов с током лимфы возвращается в кровь, а
из нее в различные органы (в том числе и в очаги воспаления), где они
превращаются в плазматические клетки. Значительное количество активированных В—лимфоцитов
направляется в слизистые оболочки, особенно те, которые явились входными
воротами для данного антигена. Основу местной иммунной системы слизистых
оболочек составляет MALT. Здесь
активированные В—лимфоциты дифференцируются в плазматические клетки, в том
числе вырабатывающие секреторные IgA, которые
обеспечивают местный гуморальный иммунитет слизистых оболочек, защищающий их от
колонизации микроорганизмами и от возможного внедрения микробов в ткани (см.
рис. 8.23).
Активация В—лимфоцитов является одним из ключевых этапов
в развитии иммунного ответа гуморального типа. Признаками активации служат
увеличение размеров клетки (бласттрансформация), гиперэкспрессия антигенов МНС
II класса (Ia—антигенов), деполяризация мембраны лимфоцитов, увеличение
концентрации в цитоплазме свободных ионов Са2+ и появление на
мембране новых, так называемых активационных антигенов. Для активации В—лимфоцитов
необходимо получение ими двух сигналов. Первый переводит клетку из состояния
покоя в G1—фазу клеточного цикла. Роль его выполняет антиген, связывающийся со
специфическим иммуноглобулиновым рецептором на поверхности В—лимфоцита, либо с
его аналогом на Т—лимфоците. В обычных физиологических условиях этот этап
активации иммунологически специфичен. Второй этап состоит в контактном
взаимодействии В—лимфоцита с Тх, секретирующим ряд лимфокинов.
Различают три типа антигенов, участвующих в активации В—лимфоцитов (рис.
8.36): тимуснезависимые антигены типа 1 (бактериальные липополисахариды);
тимуснезависимые антигены типа 2 (полисахарид пневмококков, полимеры D—аминокислот,
поливинилпирролидон); тимусзависимые антигены (ряд антигенов, которые в
отсутствие Т—лимфоцитов лишены
иммуногенности).
Тимуснезависимые антигены типа 1 при достаточно высокой
концентрации способны к поликлональной активации значительной части популяции В—лимфоцитов.
При низкой концентрации подобных антигенов, не приводящей
|
|
|
Рис. 8.36 Распознавание
В—клетками трех типов антигенов Волнистая стрелка — активирующий
сигнал; прерывистая черта — перекрестное связывание рецепторов. |
к
поликлональной активации, те В—лимфоциты, у которых иммуноглобулиновые рецепторы
специфичны по отношению к данным антигенам, будут пассивно фиксировать их на
своей поверхности. За счет собственной митогенной активности эти антигены будут
стимулировать пролиферацию клеток.
Тимуснезависимые антигены типа 2 — линейные
антигены, имеющие часто повторяющуюся, определенным образом организованную
детерминанту. Для таких антигенов характерна низкая скорость распада в
организме. Они длительно персистируют (от лат. persistio — постоянно пребывать, оставаться) на
поверхности специализированных макрофагов краевого синуса лимфатического узла и
маргинальной зоны селезенки. Тимуснезависимые антигены обоих типов вызывают
преимущественный синтез IgM, а
индуцируемый ими иммунный ответ практически не сопровождается формированием
клеток памяти.
Большинство
антигенов являются тимусзависимыми: у животных, подвергнутых
неонатальной тимэктомии и имеющих мало T—клеток, они либо не вызывают синтеза
антител, либо этот синтез очень слаб. В отсутствии Т—лимфоцитов такие антигены лишены иммуногенности: они могут
быть одновалентными в отношении специфичности каждой детерминанты, подвергаться
быстрой деградации фагоцитирующими клетками, но, как правило, не обладают
собственной митогенной активностью. Тимусзависимые антигены неспособны
активировать В—лимфоциты в отсутствие второго сигнала, обусловленного Тх, что
послужило основанием к наименованию последних.
Антигенраспознающие
рецепторы В—лимфоцита специфически связывают антиген, который далее поглощается
с помощью механизма рецепторно—опосредованного эндоцитоза, подвергается
процессингу и экспрессируется на поверхности В—лимфоцита в виде пептидов,
связанных с молекулами МНС II класса (рис. 8.36, 8.37).
Тх, ранее
активированный антигеном в ходе взаимодействия с АПК, распознает комплекс
молекулы МНС II класса антиген на поверхности В—лимфоцита. При этом в Тх
происходит внутренняя перестройка, отчасти сходная с наблюдаемой в Тк при
контакте с клеткой—мишенью, — ориентация его органелл в направлении В—клетки.
Благодаря этому, очевидно, Тх способен осуществлять направленную секрецию
интерлейкинов (главным образом, ИЛ2, ИЛ4, ИЛ5, ИЛ6, ИЛ10) и ИФН на поверхность
В—лимфоцита.
Первичный гуморальный иммунный ответ развивается при первой встрече с
антигеном и вызывает выработку небольшого количества антител, которое спустя некоторое
время существенно уменьшается. Вторичный гуморальный иммунный ответ возникает
при повторном попадании в организм антигена и характеризуется быстрым развитием
и продукцией большого количества антител. Он обеспечивается В— и Т—лимфоцитами
памяти, образующимися при первом воздействии антигена.
В—клетка памяти (Вп) — долгоживущая клетка, обеспечивающая быструю
пролиферацию и дифференцировку В—лимфоцитов в плазмоциты при повторном контакте
с антигенами. В отличие от зрелых лимфоцитов, которые живут в периферических
иммунных органах всего несколько суток и погибают, если не встречаются со своим
специфическим антигеном, Вп могут жить в течение нескольких месяцев и даже лет,
не делясь и участвуя в рециркуляции.
Существует пять принципиально различных механизмов активации В—клеток.
Все они реализуются через фосфатидилинозитоловый каскад. Рецепторы, через
которые происходит активация В—лимфоцитов, ассоциированы с G—белком.
Существование в В—клетках двух типов G—белков (Gs и G1) и наличие
тесной функциональной взаимосвязи между ними дают возможность приложить
диссоциационную модель к В—лимфоцитам (рис. 8.38). Согласно этой модели,
субъединица а Gi—белка взаимодействует с фосфолипазой С и активирует ее.
Последнее приводит к стимуляции В—лимфоцита. Освобождающиеся при этом
субъединицы β и γ связываются с субъединицей αs.
Gi—белок не
только служит в качестве агента, сопрягающего антигенраспознающий рецептор с
фосфолипазой С, но представляет собой точку ветвления в регуляции многих эффекторных
систем. В частности, с помощью G—белков происходит интеграция на уровне
клеточной мембраны фосфатидилинозитольной системы, а также аденилатциклазной,
циклооксигеназной и ряда других систем. На рис. 8.38, показана интеграция
мембраноцитоплазматических
|
|
|
Рис. 8.37 Взаимодействие В—лимфоцита (ВЛ) с Т—хелпером
второго порядка (Tx2) Антиген (АГ) поглощается ВЛ, подвергается процессингу и
экспрессируется на его поверхности в комплексе с молекулами МНС П класса (МНС
II/AT). Этот комплекс распознается Тх2 с помощью Т—клеточного
рецептора (ТКР) и CD4. Тх2
секретирует ряд интерлейкинов, которые активируют ВЛ, стимулируя его
пролиферацию и дифференцировку в плазматическую клетку, продуцирующую
иммуноглобулины (Ig). Активации
ВЛ способствует контактное взаимодействие рецептора CD40 на его плазмалемме с лигандом CD40L на
поверхности активированного Tx2.
Эффективность активации ВЛ повышается взаимодействием костимулирующих молекул
(КМ) на поверхности ВЛ с адгезионными молекулами (AM) на плазмалемме Tx2. |
|
|
|
Рис. 8.38 Интеграция мембраноцитоплазматических
контролирующих деятельность В—лимфоцитов сигналов с помощью системы Gбелков Gi — ингибирующий G—белок; Gs — стимулирующей G—белок; IgM — иммуноглобулиновый
рецептор; ФЛС — фосфолипаза С; ИФа — инозитолтрифосфат; ДАТ — диацилглицерол; ГТФ — гуанозинтрифосфат; АТФ — аденозинтрифосфат; цАМФ —
циклический аденозинмонофосфат. Пояснения в тексте. |
сигналов с помощью
G—белков, в которой участвуют иммуноглобулиновый рецептор, взаимодействующий с
антигеном, и β—адренорецептор, взаимодействующий со своим лигандом.
Плазматические клетки (плазмоциты). Это неподвижные или слабо
подвижные, короткоживущие (23 сут, по другим сведениям — до 1030 сут) клетки,
представляющие собой конечный этап развития В—лимфоцитов. В ходе
дифференцировки из В—лимфоцитов они утрачивают рецепторы к СЗ—компоненту
комплемента, мембранные иммуноглобулины и молекулы МНС, а также маркеры CD19 и CD21.
Плазматические клетки имеют сравнительно мелкие размеры (диаметр 920
мкм, в среднем — 14 мкм), круглую или овальную форму (рис. 8.39). Ядро —
округлое, расположено эксцентрично, содержит крупные глыбки хроматина, которые
располагаются в виде радиальных тяжей («спиц колеса»). В отличие от других
клеток, интенсивно вырабатывающих белки, продукты синтетической деятельности
плазмоцитов, иммуноглобулины, не накапливаются в цитоплазме в секреторных
гранулах, а по мере образования транспортируются мелкими пузырьками к
плазмалемме, где непрерывно выделяются с помощью экзоцитоза.
В обычных условиях плазматические клетки не циркулируют в крови. Они
располагаются в лимфатических узлах (преимущественно в мозговых тяжах и
зародышевых центрах), в белой пульпе селезенки, в красном костном мозге
(составляя 12% его клеток). Значительное количество плазмоцитов находится в
рыхлой волокнистой соединительной ткани, в особенности, образующей собственную
пластинку слизистых оболочек и строму различных желез— например, слезных,
слюнных, молочных, где преобладают клетки, продуцирующие IgA.
Функция плазматических клеток состоит в обеспечении гуморального
иммунитета путем выработки антител. За 1 с каждый плазмоцит синтезирует до нескольких
тысяч молекул иммуноглобулинов (более 10 млн в час). Продуцируемые
иммуноглобулины относятся к пяти классам, причем плазмоциты способны
переключаться с выработки иммуноглобулинов одного класса на другой.
Переключение классов продуцируемых иммуноглобулинов (переключение изотипов)
происходит в развивающихся плазмоцитах примерно с суточным интервалом — с IgM на IgG или IgA
(без изменения их антигенсвязывающего участка).
|
|
|
Рис. 8.39 Ультраструктурная организация
плазматической клетки КГ — комплекс Гольджи; МТХ — митохондрии; грЭПС —
гранулированная (шероховатая) эндоплазматическая сеть. |
8.3.2. Иммуноглобулины, структура и
роль в реализации специфического иммунного ответа
Иммуноглобулины.
Иммуноглобулины (Ig)
представляют собой группу сывороточных белков, обладающих рядом общих свойств и
играющих важную роль в реализации иммунного ответа высших позвоночных (табл.
8.2). По общему мнению исследователей, занимающихся изучением эволюционного
иммуногенеза, способность к синтезу антител является привилегией позвоночных
животных. У представителя иглокожих (морская звезда Asterias rubens), эволюционно предшествовавших позвоночным, найдены
антителоподобные продукты. Однако прямая филогенетическая связь между
антителоподобным белком иглокожих и иммуноглобулинами позвоночных не
установлена.
Молекула иммуноглобулина состоит из
двух тяжелых (Н) и двух легких (L) цепей,
соединенных между собой дисульфидными связями (рис. 8.40). Н и L—цепи одной
молекулы полностью идентичны.
|
|
|
Рис. 8.40 Структурная
организация молекулы IgG,
показывающая, как антиген связывается между вариабельными участками легкой и
тяжелой цепи 1 —
константные участки, где последовательность аминокислот одинакова во всех
молекулах данного типа, 2 —
антигенный связывающий участок, 3 — вариабельные участки, где
последовательность аминокислот различна в разных молекулах, 4 — легкая цепь, 5 — тяжелая цепь, 6 — шарнирная область, 7—
дисульфидная связь. Остальные пояснения в тексте. |
Молекулы
антител отличаются исключительным разнообразием, связанным, в первую очередь, с
вариабельными областями, расположенными в N—концевых участках легких и тяжелых
цепей молекулы иммуноглобулина. Остальные участки относительно неизменны. Это
позволяет выделить в молекуле иммуноглобулина вариабельные и константные
области тяжелых и легких цепей. Отдельные участки вариабельных областей (так
называемые гипервариабельные участки) отличаются особым разнообразием. В
зависимости от строения константных и вариабельных областей Иммуноглобулины
могут быть разделены на изотипы, аллотипы и идиотипы.
Изотипы отражают
разнообразие иммуноглобулинов на уровне биологического вида. При иммунизации
животных одного вида сывороткой крови особи
Таблица 8.2
Классы иммуноглобулинов и их
биологическая активность
|
Иммуноглобулин |
Тяжелая цепь |
Активность |
|
IgM |
μ(мю) |
Первый класс антител, появляющийся в сыворотке после
введения антигена; начинает первичный иммунный ответ |
|
IgG |
γ (гамма); 1, 2, 3, 4 |
Основной класс антител в сыворотке; начинает
вторичный иммунный ответ |
|
IgA |
α (альфа);
1, 2 |
Основной класс антител, выделяемых с такими
секретами, как слюна, слезная жидкость, бронхиальная и кишечная слизь;
составляет первую линию обороны организма против бактериальных и вирусных
антигенов |
|
IgD |
δ (дельта) |
Почти не секретируются; связаны с мембранами.
Функция неизвестна |
|
IgE |
ε(эпсилон) |
Возможно, участвуют в аллергических реакциях. Другие
функции неизвестны. |
|
|
|
Рис. 8.41 Структура глобулярные вариабельного (VL) и константного (СL) доменов легкой цепи. Одна
поверхность домена состоит из четырех цепей (пунктирные стрелки), образующих
антипараллельную β—складчатую структуру. Другая поверхность домена
образована тремя цепями (сплошные стрелки). Черная полоса — межцепочечная
дисульфидная связь. Гипервариабельные области в трех отдельных петлях,
находящихся в непосредственной близости друг от друга, вносят вклад в
образование антигенсвязывающего центра. Цифрами обозначены номера некоторых
аминокислотных остатков в каждой из
комплементарных детерминант. |
другого
вида образуются антитела, распознающие изотипические специфичности молекулы
иммуноглобулина. Каждый класс иммуноглобулинов имеет свою изотипическую
специфичность, против которой могут быть получены специфические антитела,
например, кроличьи антитела против IgG мыши. Характеристика основных классов
иммуноглобулинов представлена в табл. 8.2.
Наличие аллотипов
обусловлено генетическим разнообразием внутри вида и касается особенностей
строения константных областей молекул иммуноглобулинов у отдельных лиц или
семей. Это разнообразие имеет такую же природу, как и различия людей по группам
крови системы АВО.
Идиотипы
представляют собой участки вариабельной части молекулы иммуноглобулина, которые
сами являются антигенными детерминантами. Антитела, полученные против таких
антигенных детерминант (антиидиотипические антитела), способны различать
антитела разной специфичности. С помощью антиидиотипических сывороток можно
обнаружить одну и ту же вариабельную область на разных тяжелых цепях и в разных
клетках.
Пространственная
структура молекулы иммуноглобулина обеспечивается дисульфидными связями внутри
цепей. Гипервариабельные области легких и тяжелых цепей совместно образуют
антигенсвязывающий центр, «отвечая», таким образом, за специфичность антитела
(рис. 8.41, 8.42). По химической природе иммуноглобулины являются
гликопротеинами: к двум тяжелым цепям через боковые цепи остатков аспарагина
присоединяются углеводные группы.
Антитела,
принадлежащие к разным классам, отличаются друг от друга во многих отношениях
по периоду полураспада, распределению в организме, способности фиксировать
комплемент и связываться с поверхностными Fc—рецепторами иммунокомпетентных
клеток. Поскольку иммуноглобулины всех классов содержат одни и те же κ и
λ легкие цепи, а также одинаковые вариабельные домены тяжелых и легких
цепей, указанные выше различия должны быть обусловлены константными областями
тяжелых цепей. На рис. 8.43 представлена модель молекулы IgG, на которой видно
пространственное расположение и взаимодействие доменов молекулы, а также
взаимосвязи между отдельными структурами и их биологическими функциями.
IgG — основной класс иммуноглобулинов, находящихся в
сыворотке крови (80% всех иммуноглобулинов) и тканевых жидкостях. Имеет
мономерное строение. Вырабатывается в большом количестве при вторичном иммунном
ответе. Антитела этого класса способны активировать систему комплемента и
связываться с рецепторами на нейтрофилах и макрофагах. IgG является главным
опсонизирующим иммуноглобулином при фагоцитозе. Поскольку IgG способен
|
|
|
Рис. 8.42 Двухмерное
изображение антигенсвязывающего центра иммуноглобулиновой молекулы,
представляющего собой полость, образованную пептидными петлями, содержащими
гипервариабельные участки (обозначены серым цветом) легких и тяжелых цепей G — остатки глицина. Цифры — номера
аминокислотных остатков. G отличаются постоянным месторасположением вне
зависимости от специфичности или видовой принадлежности Ig. Они позволяют пептидным цепям образовывать
антипараллельную β—складчатую структуру, которая обеспечивает сближение
гипервариабельных областей. Каждый антигенсвязывающий центр при участии
разных гипервариабельных областей способен образовывать комплекс с рядом
разнообразных антигенных детерминант. |
преодолевать
плацентарный барьер, ему принадлежит главная роль в защите от инфекций в
течение первых недель жизни. Иммунитет новорожденных усиливается также
благодаря проникновению IgG в кровь через слизистую оболочку кишки после
поступления туда молозива, содержащего большие количества этого
иммуноглобулина. Содержание IgG в крови зависит от антигенной стимуляции:
уровень его чрезвычайно низкий у животных, содержащихся в стерильных условиях.
Он быстро повышается при помещении животного в нормальные условия.
IgM составляет примерно 6% иммуноглобулинов сыворотки крови.
Молекула образована комплексом из пяти связанных мономерных субъединиц
(пентамер). Синтез IgM начинается до рождения. Это первые антитела,
продуцируемые развивающимися В—лимфоцитами. Кроме того, они первыми появляются
в мембраносвязанной мономерной форме на поверхности В—лимфоцитов. Полагают, что
IgM в филогенезе иммунного ответа позвоночных появился раньше, чем IgG.
Антитела этого класса выделяются в кровь на ранних стадиях первичного иммунного
ответа (рис. 8.44). Связывание антигена с IgM вызывает присоединение Clq
компонента комплемента и его активацию, что приводит к гибели микроорганизмов.
Антитела этого класса играют ведущую роль в выведении микроорганизмов из
кровотока. Если у новорожденных в крови обнаруживается
|
|
|
|
Рис. 8.43
Расположение, взаимодействие и биологические свойства доменов в
молекуле IgG, vh —
вариабельный домен тяжелой цепи; vl —
вариабельный домен легкой цепи. Сγ1, Сγ2 и СγЗ — домены
константной области тяжелой цепи. Пояснения в тексте. |
|
|
|
||
|
Рис.
8.44 Динамика образования IgM и IgG
при первичном и вторичном иммунном ответе на введение антигена По оси абсцисс — время после первой иммунизации, недели. По
оси ординат — концентрация антител в сыворотке, относительные единицы.
Вторичный ответ выражается в усилении продукции антител класса IgG. |
||
высокий
уровень IgM, то это
обычно указывает на внутриутробное заражение плода. У Млекопитающих, птиц и пресмыкающихся
IgM является пентамером, у земноводных — гексамером, а у большинства костистых
рыб — тетрамером. При этом в аминокислотном составе константных участков легких
и тяжелых цепей IgM различных классов позвоночных не выявлено существенных
различий.
IgA существует в двух формах: в сыворотке крови и в секретах
экзокринных желез. Сывороточный IgA составляет примерно 13% общего содержания
иммуноглобулинов в крови. Представлены димерные (преобладают), а также три и
тетрамерные формы. IgA в крови обладает способностью связывать и активировать
комплемент. Секреторный IgA (sIgA) — основной класс антител в секретах экзокринных
желез и на поверхности слизистых оболочек. Он представлен двумя мономерными
субъединицами, связанными с особым гликопротеином — секреторным компонентом.
Последний вырабатывается клетками железистого эпителия и обеспечивает
связывание и транспорт IgA в секреты экзокринных желез. Секреторный IgA
блокирует прикрепление (адгезию) микроорганизмов к поверхности слизистых
оболочек и ее заселение ими. sIgA может также играть роль опсонина. Высокие
уровни секреторного IgA в молоке матери защищают слизистые оболочки
пищеварительного тракта младенца от кишечных инфекций. При сопоставлении
различных секретов оказалось, что максимальный уровень sIgA обнаружен в слезах,
а наибольшие концентрации секреторного компонента — в слезных железах
(причем у мужчин больше, чем у женщин).
IgD составляет
менее 1% общего содержания иммуноглобулинов в сыворотке крови. Антитела этого
класса имеют мономерное строение. Они содержат большое количество углеводов
(918%). Этот иммуноглобулин отличается чрезвычайно высокой чувствительностью к
протеолизу и небольшим периодом полураспада в плазме крови (около 2,8 сут).
Последнее, возможно, обусловлено большой протяженностью шарнирной области
молекулы. Почти весь IgD вместе с IgM находится на поверхности лимфоцитов
крови. Полагают что эти антигенные рецепторы могут взаимодействовать между
собой, контролируя активацию и супрессию лимфоцитов. Известно, что
чувствительность IgD к протеолизу возрастает после связывания с антигеном.
Плазматические клетки, секретирующие IgD, были найдены в миндалинах. Они
редко встречаются в селезенке, лимфатических узлах и лимфоидных тканях кишки.
Иммуноглобулины этого класса являются главной мембранной фракцией на
поверхности В—лимфоцитов, выделенных из крови больных хроническими лейкозами.
На основании этих наблюдений была выдвинута гипотеза о том, что молекулы IgD
являются рецепторами лимфоцитов и, возможно участвуют в индукции
иммунологической толерантности.
IgE
присутствует в крови в следовых количествах, составляя лишь 0— 002% всех
иммуноглобулинов в сыворотке крови. Подобно IgG и IgD, имеет мономерное строение. Вырабатывается
преимущественно плазмоцитами в слизистых оболочках пищеварительного тракта и
респираторных путей. Содержание углеводов в молекуле IgE составляет 12%. При
подкожной инъекции человеку этот иммуноглобулин задерживается в коже на
длительное время, связываясь с тучными клетками. В последующем взаимодействие
антигена с такой сенсибилизированной тучной клеткой приводит к ее дегрануляции
с высвобождением вазоактивных аминов. Этот процесс обусловливает симптомы
сенной лихорадки и бронхиальной астмы при контакте с антигеном (например, с
пыльцой цветущих растений) у людей, страдающих аллергией.
Основной
физиологической функцией IgE является,
очевидно, защита слизистых оболочек организма путем локальной активации
факторов плазмы крови и эффекторных клеток благодаря индукции острой
воспалительной реакции. Болезнетворные микробы, способные прорвать линию
обороны, образованную IgA, будут
связываться со специфическими IgE на поверхности тучных клеток, в результате
чего последние получат сигнал к высвобождению вазоактивных аминов и
хемотаксических факторов, а это в свою очередь вызовет приток циркулирующих в
крови IgG, комплемента, нейтрофилов и
эозинофилов. Возможно, локальная выработка IgE способствует защите от
гельминтов, так как этот иммуноглобулин стимулирует цитотоксическое действие
эозинофилов и макрофагов.
Уровни иммуноглобулинов, характерные
для взрослого человека, обеспечивающие полноценную иммунную защиту организма,
достигаются лишь в подростковом возрасте.
Врожденная или приобретенная α—гаммаглобулинемия
— иммунодефицитное состояние, связанное с нарушением образования
плазмоцитов, которые отсутствуют или имеются в незначительном количестве. При
этом содержание иммуноглобулинов в крови, тканевых жидкостях и секретах резко
снижается. Описаны заболевания, обусловленные избирательным нарушением
дифференцировки клеток, продуцирующих IgA (реже — IgM, IgG), или
выработкой аномальных иммуноглобулинов. Такие дефекты гуморального иммунитета
предрасполагают к развитию рецидивирующих инфекций, тяжесть которых
определяется степенью и характером угнетения реакций гуморального иммунитета. В
некоторых случаях имеет место развитие дефектов клеточного иммунитета.
Механизмы, обеспечивающие
разнообразие антител. При анализе строения иммуноглобулинов следует
различать два понятия — гетерогенность и вариабельность. Гетерогенность
определяет те свойства иммуноглобулинов, которые обусловлены константной частью
молекулы, вариабельность — индивидуальная характеристика антител,
относящихся к одному и тому же классу. Последняя проявляется в специфической
антигенсвязывающей активности, обусловленной изменениями последовательности
аминокислотных остатков в N—концевой части молекулы. В организме синтезируются
миллионы различных антител, способных распознать практически любой антиген,
который может проникнуть в организм.
Гены, кодирующие молекулу антитела,
подразделяются на три кластера, которые расположены в трех различных
хромосомах. Гены каждого кластера кодируют κ (каппа), λ {ламбда) и
тяжелые (Н) цепи. В синтезе λ—цепи принимает участие всего один V—ген
(рис. 8.45). Как и другие белки, λ—цепь кодируется отдельными сегментами
ДНК, разделенными промежуточными нуклеотидными последовательностями — интронами.
Интроны удаляются либо при транслокации ДНК, либо путем вырезания
соответствующих последовательностей из про—мРНК. Продукт трансляции мРНК
содержит лидерную последовательность, необходимую для прохождения его через
эндоплазматический ретикулум; пептид, кодируемый Vλ (аминокислотные
остатки 198); пептид, кодируемый соединительным J—сегментом (остальные 11
аминокислот вариабельной области); пептид, кодируемый сегментом Сλ
(константная область).
Гены, кодирующие к и тяжелые цепи,
устроены аналогично, хотя и несколько сложнее (рис. 8.46). Около 200 генов Ук
объединены в 5 групп, каждая из которых содержит похожие гены. Хотя гены каждой
группы допускают определенное разнообразие структуры каркаса и
гипервариабельных участков, они Обладают значительно большим сходством между
собой, чем с генами Vκ других
групп.
|
|
|
Рис.
8.45 Генетический контроль
образования λ—цепи мыши В В—лимфоците участок, кодирующий вариабельную область,
формируется в результате соединения сегмента Vλ, и соединительного сегмента J.
Этот процесс облегчается тем, что последовательности нуклеотидов интрона,
расположенные с 3'—конца сегмента Vλ,
спариваются с последовательностями, расположенными на 5'—конце J—сегмента.
Окончательное соединение сегментов происходит, когда промежуточная
последовательность удаляется путем сплайсинга из транскрибированной мРНК |
|
|
|
Рис. 8.46 Гены, кодирующие к— и тяжелые (Н) цепи иммуноглобулина G мыши Существует около 200 Vκ— и VH—генов, образующих
подсемейства или группы, имеющие сходные нуклеотидные последовательности
Механизм рекомбинаций обеспечивает объединение сегментов V, D и J, которые
совместно кодируют вариабельную область антител, образуемых определенной В—клеткой. |
Одной из возможностей увеличения
вариабельности антител являются рекомбинации, в результате которых в местах
соединения сегментов V D и J возникают разнообразные последовательности
нуклеотидов. Разнообразие антител достигается также за счет встраивания
нуклеотидов с 5'—конца D и J—сегментов. Из—за ошибки встраивания может
происходить потеря или прибавление оснований в месте стыковки «нового» 5'VH—гена с соответствующим концевым
участком сегмента D.
Эволюция иммуноглобулинов. Все гены, кодирующие молекулы,
которые относятся к суперсемейству иммуноглобулинов, происходят от одного
общего предка. Продуктами этих генов—предшественников была система молекул
клеточной адгезии. Эволюция привела к образованию гена, кодирующего домен типа β2—микроглобулина.
Все
продукты генов, относящихся к суперсемейству иммуноглобулинов, построены из
одного или большего числа таких доменов. Эти домены имеют высокую степень
гомологии. Они образованы примерно 110 аминокислотными остатками, содержат
чередующиеся гидрофобные и гидрофильные участки, образующие антипараллельные
раскладчатые участки со вставками разной длины. В результате дупликации такого
гена возник ген мультидоменного белка — древний NCAM (англ. CellAdhesion
Molecules).
Дальнейшая
эволюция привела к образованию генов, кодирующих рецепторы гормонов, антигены МНС,
дифференцировочные антигены, миелиновые белки, антигенсвязывающие рецепторы T—клеток
и иммуноглобулины (рис. 8.47). В результате перекомбинации экзонов произошло
объединение доменов типа фибронектина с доменами типа NCAM, что привело к
возникновению современного семейства молекул клеточной адгезии (NCAM, ICAM, NgCAM, MAG,
контактин). В результате дупликации и дивергенции генов возникали
взаимодействующие друг с другом семейства молекул (ТКР, антигены МНС, IgA и поли—IgА—рецептор).
Исследования
в области эволюционной иммунологии позволяют выделить четыре филогенетических
уровня развития иммунной системы.
На первом
уровне функционирует древняя система молекул клеточной адгезии,
обеспечивающих взаимодействие клеток между собой (одноклеточные эукариоты, примитивные
многоклеточные). Не исключено, что это
квази—иммунное распознавание чужеродного сохраняется у других представителей беспозвоночных и
позвоночных животных, включая
млекопитающих и человека.
На втором уровне,
определяемом как примитивное клеточное распознавание,
формируются домены, входящие в антиген—распознающие структуры (практически все
беспозвоночные первично—, и вторичноротые).
Третий
уровень, охватывающий хордовых без млекопитающих, характеризуется появлением
иммуноглобулинов. Причем, у миксин, являющихся подклассом типа хордовых,
иммуноглобулины имеют наиболее простую форму, тогда как у миног, составляющих
другой подкласс того же типа, происходит дивергенция С—домена на Сн— и cl—домены, в результате чего появляются тяжелые и легкие цепи
молекулы иммуноглобулина. Различные изотипы тяжелых Н—цепей обнаруживаются,
начиная с двоякодышащих рыб и земноводных.
Четвертый
филогенетический уровень включает млекопитающих и характеризуется дальнейшей
дивергенцией доменов, в результате которой возникают классы и подклассы
иммуноглобулинов.
|
|
|
Рис. 8.47 Эволюция
молекул суперсемейства иммуноглобулинов САМ — молекулы клеточной адгезии. |
8.4. РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА
Система регуляции деятельности иммунной системы должна быть достаточно
надежной; так как в противном случае вероятность развития неконтролируемой
иммунной реакции чрезвычайно высока и могут наблюдаться тяжелые последствия. О
важности такого контроля косвенно свидетельствует то, что в организме
существует множество механизмов, ограничивающих иммунный ответ.
8.4.1. Механизмы ограничения
иммунного ответа
Одним из
наиболее эффективных механизмов, ограничивающих синтез антител, является
механизм отрицательной обратной связи, в основе которого лежит ингибирование
иммунной реакции ее продуктом (антителами). Известно, что целые молекулы
иммуноглобулинов тормозят иммунный ответ более эффективно, чем их фрагменты. В
связи с этим можно полагать, что в данном случае происходит не простое снижение
содержания антигена за счет связывания его с антителами. Механизм такого
торможения, скорее всего, связан с образованием перекрестных связей между
антигеном, молекулой IgG и Fc—рецептором В—лимфоцита. Показано, что IgG обладает тормозящим действием, a IgM усиливает иммунный ответ (рис. 8.48). Поскольку антитела
последнего изотипа появляются первыми после введения антигена, то на ранней
стадии иммунного ответа им предположительно приписывается усиливающая
антителообразование роль. Приведем несколько примеров снижения
иммунореактивности под действием антител. Введение анти—D—антител Rh——матерям предотвращает развитие
у них первичной сенсибилизации резус—антигеном в результате беременности.
Удаление из кровотока антител методом плазмафореза в ходе иммунного ответа
усиливает их синтез, а введение преформированных IgG существенно снижает число
антителообразующих клеток, тормозя синтез иммуноглобулинов по механизму
обратной связи.
Механизмы
ограничения иммунного ответа с участием T—супрессоров. С помощью
Тс осуществляется регуляция различных форм гуморального и клеточного
иммунитета, в том числе гиперчувствительности замедленного типа а также
пролиферации ЦТЛ, Тх и В—клеток. Клетки—супрессоры могут обладать антигенной
специфичностью (подавлять иммунный ответ на определенный антиген), а могут быть
и антиген—неспецифическими. Активация антиген—специфических.Тс осуществляется с
помощью ИТс, имеющих такой же фенотип, как и Тх (CD4+). Этот процесс происходит при контакте ИТс с
антигеном на поверхности АПК, несущих антигенные детерминанты HLDQ продуктов МНС II класса. Собственно механизм
супрессии осуществляется с помощью растворимых факторов, способных подавлять
активность как Тх, так и В—клеток или ЦТЛ. Неспецифический Тс вовлекается в
угнетение иммунного ответа и под влиянием антигена секретирует неспецифические
супрессорные факторы, которые угнетают реакцию поблизости расположенных клеток
на антигены. Вероятный механизм взаимодействия различных популяций Тс
представлен на рис. 8.49. Адгезивные клетки (макрофаги и дендритные АПК) также
могут функционировать в качестве акцепторов для растворимых супрессорных
факторов, продуцируемых эффекторными Тс. Связывание этих факторов может
приводить к потере антиген—презентирующей способности в связи с блокированием
синтеза ИЛ1. Взаимодействуя с антигеном на поверхности АПК, Тс могут
регулировать активность Тх, связывающих другие антигенные детерминанты.
Подобное взаимодействие,
возможно,
лежит в основе так называемой «конкуренции антигенов», при которой один Т—зависимый
антиген подавляет иммунный ответ на другой.
Несмотря на
достаточно многочисленные исследования, показавшие, что клетки с фенотипом CD8+
могут подавлять продукцию антител посредством антиген—специфического секреторного
фактора, все попытки получить устойчивую линию Тс, а также получить
биохимические и молекулярно—биологические характеристики супрессорного фактора
оказались безуспешными. В связи с этим роль Тс в ограничении иммунного ответа
кажется сомнительной.
Идиотипические
сетевые взаимодействия. Автор гипотезы сетевого взаимодействия, лауреат
Нобелевской премии Н. Ерне предположил, что лимфоциты, способные распознавать
огромное число разнообразных чужеродных антигенных детерминант, должны
распознавать и идиотипические детерминанты самих лимфоцитарных рецепторов.
Предполагается, таким образом, существование общего сетевого взаимодействия или
набора сетевых взаимодействий идиотип— антиидиотип между лимфоцитами различных
Т— и В—субпопуляций (рис. 8.50). Попадание в организм чужеродного антигена
неизбежно должно нарушить равновесие сетевых идиотипических взаимодействий, а
стремление системы восстановить утраченное равновесие будет естественно
ограничивать иммунный ответ. Идиотипические взаимодействия могут сильно влиять
на параметры иммунного ответа. Ничтожно малые количества антиидиотипических
антител (нанограммы) могут значительно усиливать экспрессию идиотипа при ответе
на соответствующий антиген, а большие дозы (микрограммы) вызывают супрессию.
Можно полагать, что после удаления антигена из организма идиотип—антиидиотипические
взаимодействия не должны играть слишком большой роли в иммунорегуляции.
Идиотипическая сеть, вероятно, служит для сохранения иммунного ответа на
протяжении
|
|
|
||
|
|
|
||
|
Рис. 8.48 Продукция антител к эритроцитам барана. Усиление
образования антител преформированными IgM и, наоборот, подавление — преформированными IgG Мышам за два часа до иммунизации эритроцитами
барана (105 клеток) вводили культуральную среду — чистую или содержащую
моноклональные IgM или IgG к эритроцитам. СО — стандартное отклонение. |
|
||
|
|
|
||
|
Рис. 8.49 Вероятный
механизм взаимодействия идиотип—специфических Т—супрессоров, опосредованного
антиген—презентирующей клеткой ТсФ — фактор, вырабатываемый Т—супрессорами. |
|
||
|
|
||
|
Рис.
8.50 Элементы идиотипической сети, в
которой антигенные рецепторы, одного лимфоцита взаимно распознают идиотипы
рецепторов другого лимфоцита а — анти; Ид — идиотип; Ат1—Ид; Ат2α—аИд, не взаимодействующие
с паратопами; Ат2β—аИд, несущие «внутренний образ» антигена и
взаимодействующие с паратопами; Ат3—а(аИд). |
||
долгого
времени и поддержания клеточной памяти. Наличие Тх, специфичных в отношении общего
идиотипа В—клеток памяти, значительно ускоряет образование антител при
вторичном иммунном ответе.
Идиотипическая сеть позволяет манипулировать иммунным ответом, в
частности при гиперчувствительности, лежащей в основе иммунных заболеваний,
аллергии и отторжения трансплантата. Обнаружено, что аутоиммунизация
воздействует на собственную идиотипическую сеть более эффективно, чем
ксеноиммунные антиидиотипические антитела, распознающие только часть идиотипов.
«Вакцинация» животных облученными клетками Т—хелперных линий специфическими к
антигенам ткани мозга и щитовидной железы, предотвращает развитие аутоиммунного
энцефалита и тиреоидита. Иногда удается предотвратить отторжение крысами линии
А трансплантатов от линии В, иммунизируя реципиентов антителами, полученными у
крыс А против трансплантационных антигенов крыс В. При этом в результате
антиидиотипического ответа происходит супрессия Т—лимфоцитов , распознающих
трансплантат своими поверхностными анти—В—рецепторами.
В определенных условиях антиидиотипические антитела могут стимулировать
образование антител. Моноклональные антиидиотипические антитела несущие
«внутренний образ антигена», можно использовать в качестве заменителя антигена
для иммунизации в тех случаях, когда трудно получить сам антиген в достаточном
количестве.
Значение генетических факторов. Если в течение ряда поколений
скрещивать мышей, ведя отбор на способность давать слабый или сильный
гуморальный иммунный ответ, то можно получить две линии животных, одна из
которых дает высокие титры антител на любые антигены, другая — относительно
низкие. Различия в иммунореактивности обусловлены по меньшей мере десятью
разными генетическими локусами. Один или несколько из них определяют поведение
макрофагов. Несмотря на то, что обе линии обладают одинаковой скоростью
выведения частиц угля или бараньих эритроцитов из кровотока путем фагоцитоза,
макрофаги высокореактивной линии оставляют на своей поверхности больше антигена
в относительно неизмененной и, видимо, иммуногенной форме, чем макрофаги линии
с низкой реактивностью. Мыши с низкой реактивностью более резистентны к
заражению бактерией Salmonella
typhimurium, чем
макрофаги высокореактивных мышей. Таким образом, макрофаги обладают
наследственно закрепленной способностью поддерживать гуморальный и клеточный
иммунитет.
8.4.2. Участие цитокинов в
регуляции иммунных реакций
Цитокинами принято
называть обширное семейство биологически активных пептидов, обладающих
гормоноподобным действием, обеспечивающих взаимодействие клеток иммунной, кроветворной,
нервной и эндокринной систем. В отличие от гормонов, поддерживающих
гомеостатический баланс, цитокины обеспечивают ответную реакцию на внедрение
чужеродных тел, иммунное повреждение, а также воспаление, репарацию и
регенерацию. Многие исследователи рассматривают цитокины как «микроэндокринную
систему». Цитокины являются необходимыми медиаторами межклеточного
взаимодействия. Они формируют сеть коммуникационных сигналов между клетками
иммунной системы и клетками других органов и тканей.
Цитокины впервые были описаны как
полипептидные факторы, обусловливающие взаимодействие клеток иммунной системы.
Эти медиаторы, секретируемые лимфоцитами и моноцитами, получили название
соответственно «лимфокины» и «монокины». Позднее, когда было обнаружено, что подобные
или идентичные белковые медиаторы могут секретировать не только
иммунокомпетентные, но и другие клетки, эти молекулы стали называть цитокинами.
В последние годы появился еще один термин «эндогенные иммуномодуляторы»,
объединяющий интерлейкины, лимфокины, монокины, интерфероны, гормоны тимуса,
цитотоксические и супрессорные факторы. Следовательно, последний термин имеет
более широкое смысловое значение, чем понятие «цитокины».
Классификация и общие свойства
цитокинов. Универсальное определение цитокинов отсутствует, тем не
менее они рассматриваются как полипептиды и белки, которые обеспечивают
развитие воспаления и иммунного ответа. Цитокины секретируются не всегда. В
некоторых случаях они могут экспрессироваться на поверхности стимулированных
клеток. Однако независимо от того, секретируются цитокины или только
экспрессируются, все они обладают некоторыми общими свойствами:
— синтезируются в процессе реализации механизмов неспецифического или
специфического иммунитета;
— связываются со специфическими рецепторами
на клетках—мишенях;
— проявляют свою активность при
низких концентрациях (порядка 10—11 моль/л);
— не обладают ферментативной активностью или химической реактивностью;
— действуют опосредованно, изменяя функциональное состояние клеток—мишеней
с помощью вторичных мессенджеров (от англ. messenger — вестник, посыльный);
— оказывают аутокринное (на клетку—продуцент), паракринное (на соседние
с клеткой—продуцентом клетки) и дистантное (на клетки удаленных на значительное
расстояние органов и тканей) действие;
— служат медиаторами иммунной и воспалительной реакций;
— действуют как факторы роста и факторы дифференцировки клеток (при этом
вызывают преимущественно медленные клеточные реакции, требующие синтеза новых
белков);
— образуют регуляторную сеть, в которой отдельные элементы обладают
синергическим или антагонистическим действием;
— обладают полифункциональной активностью и перекрывающимися функциями.
Лейкоциты являются источниками цитокинов, в то же время — и мишенью для
них. В связи с этим многие из цитокинов получили название «интерлейкинов».
Классификация цитокинов до определенного времени была бессистемной.
Некоторые из них первоначально назвали по их доминирующему биологическому
действию. С 1976 г., когда был открыт ИЛ2, описано более 20 иммунологически
активных цитокинов, оказывающих различное действие на иммунную систему в
условиях in
vitro. Некоторые
цитокины имеют не интерлейкиновую номенклатуру, а свое первоначальное название,
например, ФНО (фактор некроза опухолей), КСФ (колониестимулирующие факторы), OSM (онкостатин М), LIF (фактор, ингибирующий лейкозные клетки), NGF (фактор роста нервов), CNTF (цилиарный нейротрофический фактор). Различные цитокины
могут быть сгруппированы в 5 обширных классов, объединенных по их доминирующему
биологическому действию: 1) воспалительные; 2) антивоспалительные; 3) факторы,
вызывающие рост и дифференцировку лимфоцитов; 4) гемопоэтические
колониестимулирующие факторы; 5) факторы, вызывающие рост мезенхимальных
клеток.
В
большинстве случаев регуляторная функция цитокинов осуществляется в местах
проникновения или концентрации патогенных агентов и сводится к вовлечению
клеток близлежащих тканей и крови в процесс элиминации чужеродного агента,
обеспечивая иммунные и воспалительные реакции. В критические моменты, когда
местная воспалительная реакция оказывается несостоятельной, цитокины появляются
в крови и разносятся кровотоком в различные органы и ткани, знаменуя начало
острофазового ответа организма. Иммунный процесс, воспаление и острофазовый
ответ характеризуются множеством хорошо известных проявлений: лихорадкой,
похуданием, сонливостью, потерей аппетита, лейкоцитозом, появлением в крови
белков острой фазы, активацией гипофизадреналовой системы (стрессорная
реакция), болевым синдромом и т. д. Все или большинство из них являются
результатом действия цитокинов.
Механизмы действия цитокинов. Влияние
цитокина осуществляется путем его взаимодействия со специфическим мембранным
рецептором клетки—мишени. В большинстве случаев рецепторы для цитокинов
представлены одной двумя или тремя пептидными или гликопротеидными цепями,
встроенными в клеточную мембрану. При этом цитокин взаимодействует с внешней,
экстрацеллюлярной, частью рецептора. Сигнал о такого рода взаимодействии
передается внутрь клетки интрацеллюлярной частью рецептора, которая обладает
ферментативной активностью. Эффективность действия рецептора зависит от его аффинности,
т. е. от того, какое минимальное количество лиганда необходимо для образования
прочного комплекса и, как следствие, для передачи специфического сигнала внутрь
клетки.
Аффинность
зависит от числа белковых цепей, входящих в состав рецептора. Как известно,
вторая цепь может быть общей у ряда рецепторов с разной специфичностью. Так,
белок gp 130 присутствует в качестве
дополнительной цепи в рецепторах для ИЛ6, OSM и LIF (рис.
8.51). В рецепторах для ИЛ3, ИЛ5 и GMCSF
(колониестимулирующие факторы гранулоцитарно—моноцитарного ряда) роль
дополнительной цепи выполняет белок КН97. С этой особенностью строения
большинства цитокиновых рецепторов связана, по—видимому, так называемая избыточность
действия, когда разные цитокины влияют сходным образом на одну и ту же
клеточную мишень.
Рецепторы цитокинов обнаруживаются
на различных типах клеток. Связывание цитокина с рецептором приводит к экспрессии
генов и последующему синтезу молекул, характерных для данного типа клеток.
Большинство генов могут экспрессироваться под действием нескольких цитокинов,
взаимодействующих со своими индивидуальными клеточными рецепторами. При этом
возможны различные варианты таких взаимодействий:
|
|
|
Рис. 8.51 Участие белка gр130 в формировании
высокоаффинных рецепторов для цитокинов ИЛ6К — рецептор для ИЛ6; OSMR — рецептор для онкостатина М; UFR — рецептор для фактора,
ингибирующего лейкозные клетки. |
синергизм,
суммация, антагонизм. Многие цитокины могут рассматриваться как аутокринные
факторы роста и участвовать в саморегуляции экспрессии своих собственных
рецепторов.
Цитокины играют важную роль в
регуляции иммунных реакций (рис. 8.52). Большинство из них являются
иммуномодуляторами, обладающими стимулирующими функциями. По—прежнему мало
известно об ингибиторах иммунной реакции. Одним из претендентов на эту роль
является семейство трансформирующих факторов роста, продуцируемых макрофагами и
лимфоцитами и способных выполнять функцию антигеннеспецифических супрессорных
молекул (эпидермальный фактор роста — EGF,
трансформирующий фактор роста — TGFα и TGFβ, фактор роста фибробластов — FGF и другие). Такую же функцию выполняет «растворимый
супрессор иммунного ответа» (англ. Soluble
Immune Response Supressor, SIRS),
обладающий способностью ингибировать пролиферацию лимфобластов. Данные о
специфичности действия SIRS и о
клетках, несущих его рецептор, отсутствуют. Сообщалось также об антагонисте
ИЛ1, молекула которого имеет 26% гомологии с ИЛ1β и 14% — с ИЛlα.
Возможным ингибитором пролиферации T—хелперов 1 порядка является ИЛ10, который
подавляет продукцию ИФН—γ и нарушает функцию представления антигенов
макрофагами Tx1. С другой
стороны, тот же самый цитокин индуцирует пролиферацию тимоцитов в присутствии
ИЛ2 и ИЛ4, усиливает экспрессию продуктов МНС II класса на В—лимфоцитах,
является кофактором роста В—лимфоцитов и индуктором выработки иммуноглобулинов.
Имеются данные о подавляющем влиянии на иммунные реакции ИЛ4. Оказалось, что
этот цитокин подавляет экспрессию генов ИЛ1 и ФНО.
Эффекты, вызываемые цитокинами,
чрезвычайно сходны с симптомами, появляющимися у больных с острыми и хроническими
заболеваниями инфекционного происхождения. Это свидетельствует о том, что
цитокины являются ключевыми факторами, регулирующими активность нейронов ЦНС,
утилизацию липидов, проницаемость сосудов, гемопоэз и уровень белков острой
фазы. При местно протекающем воспалении цитокины повышают функциональную
активность макрофагов и гранулоцитов, стимулируют синтез одного из основных
медиаторов воспаления — гистамина, усиливают продукцию факторов свертываемости
крови эндотелиоцитами сосудов, активируют систему остеокластов, стимулируют
выработку набора хондролитических ферментов, способствуют заживлению ран и
формированию рубцовой ткани.
|
|
|
Рис. 8.52 Участие цитокинов в
регуляции иммунных реакций 1 — действие
иммуномодуляторов; 2 —
направление дифференцировки клеток. Остальные обозначения — в тексте. |
8.4.3.
Основные свойства некоторых цитокинов
ИЛ1. Впервые
этот плейотропный медиатор был обнаружен в перитонеальном (брюшинном) экссудате
в острую фазу воспаления. После введения его животным наблюдается повышение
температуры тела. В связи с этим ИЛ1 получил название «эндогенный пироген».
Позднее эндогенный пироген был очищен. Дальнейшие исследования позволили
обнаружить новые эффекты влияния эндогенного пирогена: уменьшение уровня цинка
и железа в плазме крови, нейтрофилию, стимуляцию синтеза амилоидного белка А в
печени, колониестимулирующую активность. Эндогенный пироген был описан как
«лимфоцит—активирующий фактор», являющийся костимулятором Т—лимфоцитов . Стандартным
биологическим тестом для обнаружения ИЛ1 служит синергичная стимуляция
пролиферации мышиных тимоцитов в комбинации с митогенными лектинами
растительного происхождения, такими как конканавалин А или фитогемагглютинин.
На основании исследований, посвященных продукции ИЛ1, главными его
источниками считались моноциты и макрофаги. Однако позднее было обнаружено, что
ИЛ1 продуцируется и другими клетками, имеющими с макрофагами общее
происхождение: звездчатые ретикулоэндотелиоциты (клетки Купфера) в печени,
белые отростчатые эпидермоциты (клетки Лангерганса) в эпидермисе, клетки
микроглии и др. К числу продуцентов этого медиатора относятся фибробласты. Т— и
В—лимфоциты, натуральные киллеры, нейтрофилы и эндотелиоциты. Установлено, что
нейроны и астроциты способны стимулировать и высвобождать ИЛ1. Продукция ИЛ1
осуществляется периферическими симпатическими нейронами и хромаффинными
клетками мозгового вещества надпочечников и пищеварительного тракта.
ИЛ1 существует в виде двух различных полипептидных форм ИЛ1 а и ИЛ1β, синтез которых кодируется двумя генами. Обе эти формы образуются из соответствующих молекул—предшественников, имеющих одинаковую молекулярную массу (31 кДа). Предшественник ИЛ1α (проИЛ1α) биологически активен и способен соединяться с рецептором в форме димера. ИЛ1β приобретает способность связываться с рецептором только после ферментативного расщепления, в результате которого образуется конечный продукт с молекулярной массой 17,5 кДа. Этот процесс катализируется ИЛ1—β—конвертирующим энзимом.
Преобладающей формой ИЛ1 является ИЛ1β: количество соответствующей
мРНК, обнаруживаемое в активированных клетках, в 1050 раз превышает количество
мРНК для ИЛla. В
неактивированных клетках, как правило, не находят значительных количеств мРНК,
кодирующих синтез ИЛ1. Резкое увеличение продукции цитокина происходит в ответ
на инфекцию, действие микробных токсинов, медиаторов воспаления, продуктов
активированных лимфоцитов и комплемента.
Несмотря на структурные различия ИЛla и ИЛ1β, разную продолжительность их жизни (ИЛlα —
15 ч, ИЛ1β — 2,5 ч), две формы цитокина связываются с одними и теми же
рецепторами. Обнаружено два типа рецепторов для ИЛ1: на Т—лимфоцитах и
фибробластах с молекулярной массой 80 кДа и на В—лимфоцитах с молекулярной
массой 68 кДа. Оба типа рецепторов принадлежат к семейству иммуноглобулинов, их
внеклеточные домены содержат три домена гомологичных иммуноглобулинов.
ИЛ1 играет одну из центральных ролей в воспалительной реакции, в ответе
на бактериальную инфекцию и тканевые повреждения. Он проявляет свойства
нейроэндокринного гормона, стимулируя продукцию кортикотропина, простагландинов
и целого ряда других гормонов. Сообщалось, что ИЛ1 является митогеном для
астроцитов. Этот цитокин стимулирует продукцию ИЛ2 Т—лимфоцитами, повышает
экспрессию рецептора для ИЛ2. ИЛ1 усиливает пролиферацию В—лимфоцитов, секрецию
антител и экспрессию мембранного иммуноглобулинового рецептора. Под влиянием
ИЛ1 возрастает секреция гепатоцитами сывороточных амилоидов А и Р, С—реактивного
белка, α1—антитрипсина и церулоплазмина. Связывание ИЛ1 с рецепторами
сопровождается целым рядом других биологических эффектов: повышением
температуры тела, нарушением сна, головной болью, нарушениями деятельности
пищеварительной системы. Модуляция под действием ИЛ1 тех или иных процессов
осуществляется путем повышения или понижения уровня экспрессии других
рецепторов. ИЛ1 усиливает связывание опиатов рецепторами, повышает экспрессию
рецепторов для TFGJ3
(трансформирующего фактора роста), понижает экспрессию ИЛ1—рецепторов I типа,
уменьшает число рецепторов ФНО, снижает количество мРНК, кодирующей синтез
рецепторов ИЛ6, ингибирует образование рецепторов для лютеинизирующего гормона.
ИЛ2. Этот цитокин с молекулярной массой 15 кДа играет
исключительно важную роль в реализации механизмов иммунного ответа. У различных
видов животных и человека продукция ИЛ2 осуществляется лимфоцитами
периферической крови, костного мозга, лимфатических узлов, перитонеального
экссудата, тимуса, селезенки, миндалин и грудного протока, стимулированными к
пролиферации антигенами или лектинами. При этом продуцентами ИЛ2 являются T—хелперы
1. Покоящиеся лимфоциты не содержат и спонтанно не продуцируют ИЛ2. Обычный
физиологический путь активации лимфоцитов, обусловленный взаимодействием
специфического антигена и ТКР, не является единственным путем стимуляции Т—лимфоцитов
. T—лимфоциты могут быть стимулированы к продукции ИЛ2 с помощью ряда
митогенных лектинов (фитогемагглютинин, конканавалин А), антител к поверхностным
маркерным молекулам и целого ряда других биологически активных веществ.
Сообщалось о значительном усилении продукции ИЛ2 лимфоцитами и гормональными
факторами тимуса.
Помимо участия ИЛ2 в дифференцировке и пролиферации Т—лимфоцитов , этот
лимфокин вносит важный вклад в реализацию механизмов противоопухолевой
защиты. Он повышает литическую активность нормальных киллеров, а также
индуцирует клетки системы лимфокин—активированных киллеров. Кроме того, ИЛ2
вызывает пролиферацию ЦТЛ. Под действием ИЛ2 усиливается секреция ИФНγ Т—лимфоцитами.
Таким образом, ИЛ2 является ключевым фактором в развитии иммунологических
реакций. Действие ИЛ2 приводит к развитию плейотропного эффекта с участием
нескольких субпопуляций иммунной системы (рис. 8.53).
Рецептор для ИЛ2 состоит из трех полипептидных цепей, которые могут быть
экспрессированы вместе и по отдельности (рис. 8.54). В зависимости от того, из
скольких цепей будет составлен рецептор, изменяется его аффинность. Так, при
экспрессии одной α—цепи (молекулярная масса 55 кДа) рецептор обладает
наиболее низкой аффинностью с константой диссоциации (Kd) около 10 нМ. Такой рецептор очень небольшую
цитоплазматическую часть и после связывания ИЛ2 не способен проводить сигнал
внутрь клетки.
ИЛ3. Этот цитокин относится к семейству гемопоэтических ростовых
факторов (молекулярная масса 1528 кДа), является колониестимулирующим фактором
гранулоцитов—макрофагов. ИЛ3 вместе с эритропоэтином поддерживает рост и
дифференцировку клеток эритроидного ряда. Он способен регулировать раннюю
стадию дифференцировки В—лимфоцитов, поддерживает рост пре—В—клеток, а также
усиливает секрецию IgG.
|
|
|
Рис. 8.53 Схема биологических эффектов ИЛ2 Аг—
антиген; Мф — макрофаг; Тл — Т—лимфоцит; Вл — В—лимфоцит; — натуральные
киллеры; ЛАК — лимфокин—активированные киллеры; ФНО— фактор
некроза опухолей, Iа —
молекулы МНС II класса. |
|
|
|
Рис. 8.54 Строение высокоаффинного рецептора для ИЛ2 Для проведения сигнала требуется гетеродимеризация
цитоплазматических доменов β— и γ—цепеи. |
По химической природе ИЛ3 —
гликопротеин, углеводный компонент содержит сиаловые кислоты. Основным
источником ИЛ3 являются T—лимфоциты с фенотипическими характеристиками хелперов,
активированные фитогемагглютинином или антигеном.
ИЛ3 — один из основных факторов, поддерживающих рост и жизнеспособность
предшественников тучных клеток, играющих важную роль в нормальной
жизнедеятельности организма и при патологии. ИЛ3 мыши и человека выполняют
функцию фактора, активирующего клетки к продукции гистамина. Не исключено, что
вызываемая им активация пролиферации полипотентных клеток костного мозга
связана со способностью ИЛ3 стимулировать в клетках синтез гистамина. Благодаря
активации костномозгового кроветворения ИЛ3 обладает радиопротекторными
свойствами. Он потенцирует цитотоксическую активность макрофагов, вызванную
липополисахаридом.
ИЛ4. Этот лимфокин (молекулярная масса 1520 кДа) продуцируется Т—хелперами
2 и является фактором дифференцировки для Т— и В—лимфоцитов. Он служит
кофактором пролиферации покоящихся В—лимфоцитов и индуцирует продукцию
отдельных изотипов иммуноглобулинов, в частности, IgE и IgG
ИЛ4 служит ростовым фактором для части Т—лимфоцитов , стимулирует пролиферацию
костномозговых клеток—предшественников гемопоэза и тучных клеток. Известна
способность ИЛ4 генерировать активность ЛАК и усиливать противоопухолевую
активность макрофагов. Помимо Т—лимфоцитов , ИЛ4 может также продуцироваться
тучными клетками и точно не идентифицированными клетками стромы костного мозга.
Важной
особенностью ИЛ4, отличающей его от многих других цитокинов является строгая
видовая специфичность биологического действия. ИЛ4 человека оказывает
биологическое действие и связывается только с клетками человека и обезьян.
Мышиный ИЛ4 активен только в отношении различных линий мышей, но не действует
на клетки приматов.
ИЛ4 играет роль регулятора
иммунологических функций, способствующего достижению оптимального уровня
иммунного ответа. Однако его гиперпродукция или дисбаланс регуляторных влияний
со стороны других цитокинов могут проявляться в форме повышенной
иммунологической реактивности.
ИЛ5. Этот
димерный белок с молекулярной массой 5060 кДа продуцируется Т—хелперами 2, т.
е. теми же клетками, что и ИЛ4. Синтез ИЛ5 Т—хелперными лимфоцитами происходит
только в ответ на антигены или другие индукторы.
Влияние ИЛ5 на эозинофилы
заключается в усилении функциональной активности зрелых клеток, поддержании их
жизнеспособности, продукции супероксидного аниона и стимуляции хемотаксиса
эозинофилов, а также избирательной стимуляции пролиферации и дифференцировки
предшественников эозинофилов в костном мозгу. В последнем ИЛ5 синергичен с ИЛ1
и ИЛ3. Вероятно, ИЛ5 является цитокином, ответственным за селективную активацию
эозинофилов при аллергических заболеваниях.
ИЛ6. Этот
цитокин представляет собой белок с молекулярной массой 1934 кДа. Он
секретируется многими типами клеток, участвующих прямо или косвенно в
осуществлении воспалительной реакции и иммунного ответа (покоящиеся T—лимфоциты;
T—лимфоциты, трансформированные вирусом; фибробласты; моноциты; макрофаги;
эндотелиоциты; кератиноциты; клетки многих опухолей). Действие ИЛ6 может
осуществляться местно в очаге воспаления и системно при его попадании в циркуляцию.
Местное действие ИЛ6 на
иммунокомпетентные клетки заключается в стимуляции пролиферации T—хелперов 1 и
2, усилении продукции ИЛ2, индукции ЦТЛ, а также в ускорении дифференцировки В—лимфоцитов
в антителопродуценты. ИЛ6 увеличивает экспрессию молекул МНС класса I, но не
класса II.
Системное действие ИЛ6,
характеризующее его как типичный медиатор воспалительной реакции,
проявляется при распространении очага инфекции и попадании ИЛб в циркуляцию.
Одним из важных звеньев системного действия ИЛ6 служит его стимулирующее
влияние на пролиферацию костномозговых клеток—предшественников гранулоцитов и
макрофагов, приводящее к увеличению выхода зрелых форм этих клеток для
восполнения утраченных в ходе воспалительной реакции фагоцитов.
ИЛ6 вызывает индукцию белков острой
фазы воспаления гепатоцитами. Эта особенность цитокина также является
проявлением его системного действия. ИЛб, так же как ИЛ1 и ФНО, индуцирует
лихорадку, являясь еще одним эндогенным пирогеном. Он оказывает прямое действие
на клетки мозга, индуцируя продукцию АКТГ.
ИЛ7. Этот
лимфокин является полипептидом с молекулярной массой 14,9 кДа. Биологические
свойства ИЛ7 изучены недостаточно. Полагают, что этот цитокин выступает одним
из факторов, продуцируемых клетками стромы костного мозга, а возможно, и
тимуса, которые стимулируют рост пре—В— и пре—Т—лимфоцитов .
ИЛ8.
Представляет собой олигопептид с молекулярной массой 8,8 к Да. Его
изоэлектрическая точка находится в области 8,08,5. Как и все интерлейкины, он
является индуцибельным белком. ИЛ8 продуцируется макрофагами, лимфоцитами,
эпителиальными клетками почки, фибробластами, эндотелиоцитами. Рецепторы для
ИЛ8 обнаружены на нейтрофилах. ИЛ8 является мощным индуктором острой
воспалительной реакции, вызывая миграцию нейтрофилов в очаг проникновения патогенного
фактора. Помимо основной функции, ИЛ8 способствует усилению адгезивных свойств
нейтрофилов, генерации активных форм кислорода, активации пентозофосфатного
шунта, подъему концентрации Са2+, изменяет форму нейтрофилов,
способствует экзоцитозу.
Фактор
некроза опухолей (ФНО). Был впервые получен в результате введения мышам
бактериальных эндотоксинов. Обладает цитотоксической активностью по отношению к
опухолевым клеткам. ФНО представляет собой полипептид с молекулярной массой
около 17 кДа. Основными продуцентами этого цитокина являются моноциты
(макрофаги) и лимфоциты. Под воздействием бактериальных токсинов клетки
моноцитарно—макрофагальной системы активируются и начинают синтезировать ФНО,
ИЛ—1, ИЛ—6 и вещества прокоагулянтного действия.
Многие функции ФНО—α и
ФНО—β (лимфотоксин) идентичны функциям ИЛ—1. При совместном использовании
этих цитокинов часто наблюдается потенцирование действия или синергизм между
молекулами. ФНОα и ИЛ1 действуют синергично на фибробласты, усиливая
продукцию ПГЕ2. Синергичное влияние выявлено при радиопротекторном
эффекте. Полагают, что такой синергизм является скорее всего результатом
воздействия вторичных мессенджерных молекул, так как ИЛ1 уменьшает число
рецепторов для ФНОа.
ФНОα и
ФНОβ способны тормозить клеточную пролиферацию, дифференцировку и функции
клеток почти всех типов. Они служат медиаторами цитотоксичности. В результате
их высвобождения повышается проницаемость капилляров, повреждается эндотелий
сосудов, возникает внутрисосудистый тромбоз. В настоящее время признано, что
ФНО играет ведущую роль в патогенезе септического шока.
ИЛ10. Этот
лимфокин (1721 кДа), продуцируемый Т—хелперами 2, может рассматриваться как
антагонист ряда цитокинов. ИЛ10 подавляет продукцию ИФНγ Т—хелперами 1. Оh тормозит
пролиферативный ответ T—клеток на антигены и митогены, а также подавляет
секрецию ИЛ1β, ФНО и ИЛ6. В то же время ИЛ10 стимулирует секрецию
иммуноглобулинов В—лимфоцитами.
ИЛ12. Лимфокин
человека состоит из двух субъединиц с молекулярной массой 40 и 50 кДа, удерживаемых
дисульфидной связью. Субъединица р40 гомологична рецептору для ИЛ6, а
субъединица р50 имеет частичную гомологию с ИЛ6 и гранулоцитарным
колониестимулирующим фактором. ИЛ12 повышает литическую активность клеток
системы ЛАК, а также специфическую цитотоксичность ЦТЛ. ИЛ12 рассматривают как
ростовой фактор при активации Т—лимфоцитов
и натуральных киллеров.
8.4.4. Регуляторные
иммунонейроэндокринные сети
Клетки
иммунной системы обладают передающими трансмембранный сигнал рецепторами к
целому ряду гормонов и нейромедиаторов, включая кортикостероиды, инсулин,
гормон роста, тестостерон, эстрадиол, адреналин, норадреналин, ацетилхолин,
эндорфины, энкефалины и другие (рис. 8.55). Глюкокортикоиды, андрогены,
эстрогены и прогестерон подавляют иммунные реакции, а гормон роста, тироксин,
инсулин, мелатонин их стимулируют. В то же время показано, что характер влияния
на иммунные процессы глюкокортикоидных гормонов зависит от концентрации
последних: высокие концентрации оказывают иммунодепрессивное действие, низкие —
иммуностимулирующее. Половые различия особенно заметны при аутоиммунных
заболеваниях.
Усиление иммунного ответа может
быть получено в результате денервации селезенки, которая, так же как и другие
органы иммунной системы, имеет автономную иннервацию. Неонатальная
симпатэктомия, произведенная с использованием 6—гидроксидофамина, также
усиливает иммунный ответ.
Сильный
стресс может индуцировать состояние иммунодефицита. Такое состояние наблюдается
у спортсменов—профессионалов на «пике» спортивной формы. При этом выявляется
снижение активности натуральных киллеров, уменьшение показателя CD4/CD8 и
содержания IgA в слюне,
снижение интенсивности пролиферативного ответа лимфоцитов на антигены и
митогены, а также угнетение функций неспецифического иммунитета. Аналогичные
изменения можно наблюдать у животных в эксперименте при продолжительных и
интенсивных стрессорных воздействиях.
Сетевые взаимодействия. Некоторые
цепи сетевых взаимодействий между иммунной и нейроэндокринной системами
подробно рассмотрены. Известно, что многие иммунные реакции находятся под
контролем гипоталамо—гипофизарно—адреналовой системы. При этом показано
увеличение синтеза глюкокортикоидов под действием ИЛ1, ИЛ2, ФНО и ИЛ6. В то же
время глюкокортикоиды тормозят иммунный ответ, воздействуя на продукцию
упомянутых цитокинов (рис. 8.56). Наиболее изучено участие эндокринной системы
в эффекторной передаче сигналов от мозга к органам и клеткам, реализующим
иммунологические функции организма. Переключение нервных механизмов на
эндокринные может происходить посредством активации продукции либеринов и
статинов, стимуляции синтеза и освобождения гипоталамических нейрогормонов
(окситоцин, вазопрессин) и тропных гормонов гипофиза, а также через изменение
притока сигналов по нервным путям к эндокринным органам. Поступление гормонов с
кровотоком в органы иммунной системы, вероятно, регулируется опосредованно,
через изменение их кровоснабжения. К основным способам передачи модулирующих
сигналов от мозга к иммунной системе следует отнести гормональные, нервные и
нейропептидные пути. Нейроны, нейросекреторные клетки и глиальные элементы
головного мозга, в свою очередь, несут
|
|
|
Рис. 8.55 Рецепторы к нейромедиаторам
и регуляторным пептидам на мембранах макрофагов и лимфоидных клеток МХР — мускариновый холинорецептор; ГР — гистаминовый
рецептор; ОР — опиатный рецептор; СР — серотониновый рецептор; β—АР —
β—адренорецептор; Т — Т—лимфоцит; В — В—лимфоцит; М — макрофаг. |
|
|
|
Рис. 8.56 Два механизма
вмешательства иммунных процессов в деятельность нервной и эндокринной систем А —
глюкокортикоидная обратная связь: торможение синтеза интерлейкина—1 и других
лимфокинов; Б — аутоантитела
к гормонам и их рецепторам. Тх
— Т—хелпер, МФ — макрофаг. |
специфические
рецепторы к медиаторам иммунной системы, взаимодействуя с которыми, выполняют
центральный компонент острофазового ответа.
В осуществление
сетевых взаимодействий могут также включаться клеточные рецепторы к гормонам,
сами гормоны, антитела к гормонам и антиидиотипические антитела (рис. 8.56).
Появление в организме антител к гормональным рецепторам приводит к развитию
аутоиммунных заболеваний. Существует значительное разнообразие аутоиммунных
процессов, мишенью которых становится щитовидная железа.
Иммунная
система — сложная физиологическая система, контролирующая
индивидуальность и целостность организма. Главной особенностью работы этой
системы является способность отличать собственные структуры организма от
генетически чужеродных и уничтожать последние. Началом каждой иммунологической
реакции служит процесс распознавания антигена. В том случае, если иммунная
система определяет, что появившиеся клетки или вещества — это не «свое», а
«чужое», включаются механизмы иммунного ответа.
Способность организмов отличать
«свое» от «чужого» существует сотни миллионов лет, однако лишь у позвоночных
появляется морфологическая основа иммунной системы в виде лимфомиелоидного
комплекса. У млекопитающих имеется разветвленная сеть обособленных, в
достаточной мере структурированных образований, включающих костный мозг и тимус
(первичные лимфоидные органы), а также селезенку, пейеровы бляшки кишки,
миндалины, многочисленные и сложно организованные лимфатические узлы (вторичные
лимфоидные органы). Подобно нижестоящим в филогенетическом отношении классам
позвоночных, у млекопитающих различают органы со смешанным лимфомиелопоэзом (костный
мозг, селезенка) и органы, в которых осуществляется исключительно лимфопоэз
(тимус, лимфатические узлы). Наличие афферентных и эфферентных лимфатических сосудов обеспечивает миграцию и
широкий обмен клетками между органами и кровеносной системой. Лимфоидные органы
находятся под контролем нервной и эндокринной систем, деятельность которых, в
свою очередь, изменяется в зависимости от уровня функционирования иммунной
системы.
Основными клеточными элементами
иммунной системы являются лейкоциты во всем многообразии их популяций и
субпопуляций. Начиная с работ И. И. Мечникова, считается, что эффективное
функционирование иммунной системы обеспечивается тесным единством специфических
и неспецифических факторов системной защиты. По механизму действия в большей
степени специфичны те факторы иммунитета, которые возникают на поздних этапах
эволюции. Наиболее филогенетически старым элементом клеточного иммунитета
считают фагоцитирующие клетки, представленные у человека моноцитами
(макрофагами) и нейтрофилами. Одна из субпопуляций лимфоцитов — естественные
(нормальные) киллеры — не обладает специфичностью, оказывая цитотоксическое
действие на все чужеродные клетки. Наиболее высокоспецифическое действие в
отношении чужеродных антигенов демонстрируют филогенетически молодые Т— и
В—лимфоциты. В целостном организме высших позвоночных в результате
кооперации всех факторов неспецифические компоненты приобретают определенную
степень специфичности, а специфические факторы выполняют функцию инициаторов,
включающих мощные силы неспецифического иммунитета.
|
|
|
Рис.
8.57 Схема иммунного ответа АГ — антиген; АГ* — продукты деградации антигена; АПК —
антигенпрезентирующая клетка; Б — базофил; В — В—лимфоцит; Г — гепатоцит ИЛ —
интерлейкин; ИФ — интерферон; КАГ — чужеродная клетка; Мэ — макрофагэффектор;
Н — нейтрофил; Пл — плазматическая клетка; РОФ — реактанты острой фазы
воспаления; Та — Т—амплификатор (Тх 1); Тк —Т—киллер; Тх – Т—хелпер; ФНО —
фактор некроза опухолей; Э —эозинофил; 1а — молекулы МНС II класса; Ig — иммуноглобулин; Нк — нормальный киллер. |
При
появлении в организме патогенных микроорганизмов, злокачественных клеток, а
также клеток, зараженных вирусами, формируется неспецифическая воспалительная реакция,
направленная на обезвреживание, связывание и удаление чужеродных антигенов. Эта
реакция, названная острофазовым ответом, затрагивает многие системы организма и
осуществляется на клеточном, тканевом, органном и организменном уровнях (рис.
8.57). Организация острой воспалительной реакции носит клеточно—гуморальный
характер, и в ней участвуют гранулоциты (нейтрофилы, эозинофилы, базофилы),
макрофаги, лимфоциты (клеточные элементы специфического иммунитета), а также
системы комплемента, интерферона, лизоцим, С—реактивный белок, цитокины и
специфические антитела. Дегрануляция тучных клеток и базофилов, приводящая к
появлению в среде ряда биологически активных веществ (гистамин, серотонин,
гепарин и др.), вызывает сокращение гладкой мускулатуры артерий, расширение
капилляров, увеличение их проницаемости для клеточных элементов,
высокомолекулярных веществ и воды. Острая воспалительная реакция протекает в
условиях нарушения функций ЦНС, что проявляется в изменении поведенческих
реакций, возникновении лихорадки, увеличении содержания в крови АКТГ и
стероидных гормонов коры надпочечников.
Специфические
иммунные механизмы у позвоночных основаны на реакциях двух типов: клеточного и
гуморального. Такой дуализм иммунной системы основан на наличии двух популяций
лимфоцитов — Т— и В—клеток. При этом первые отвечают за клеточные реакции,
вторые вырабатывают антитела. Помимо лимфоцитов, в иммунных реакциях участвуют
и другие типы клеток, так называемые вспомогательные клетки, например,
макрофаги. Созревание и дифференцировка лимфоцитов в эффекторные Т— и В—клетки
включает антигеннезависимую и антигензависимую стадии, которые подразделяются
на несколько этапов, причем на каждом из них для клеток характерно появление
определенных антигенов, называемых дифференцировочными. Они
могут служить маркерами процесса дифференцировки.
Существует
также особый генетический аппарат, имеющий важное значение для проявления
иммунного ответа. Главный комплекс гистосовместимости (англ. Major Histocompatibility Complex — МНС) на разном уровне воздействует на иммунные процессы.
В области МНС локализованы так называемые Ir—гены (англ. Immune Response), определяющие интенсивность иммунного ответа на тот или
иной антиген. Благодаря деятельности этого комплекса формируется многообразие
мембранных структур, характерное для клеток конкретного индивидуума и играющее
важную роль в кооперации клеток.
Иммунный ответ клеточного типа
базируется на активности Т—лимфоцитов , часть из которых оказывает
непосредственное воздействие на антиген (например, клетки—киллеры), другие
влияют опосредованно через медиаторы иммунного ответа (лимфокины).
Специфичность клеточного иммунного ответа обеспечивается Т—клеточными
рецепторами. В индукции клеточного иммунного ответа важную роль играют
макрофаги, которые участвуют в презентации антигена и продуцируют факторы,
стимулирующие пролиферацию и дифференцировку T—клеток. Если Т—лимфоцит
присоединил соответствующий антиген, то в присутствии медиаторов иммунного
ответа начинается пролиферация в результате которой возникает клон
специфических T—клеток. В процессе развития иммунного ответа имеют место
сложные кооперативные взаимодействия отдельных субпопуляций Т—лимфоцитов .
Неактивированные В—лимфоциты
синтезируют небольшое количество иммуноглобулинов, которые встраиваются в мембрану
клеток и функционируют в качестве антиген—специфических рецепторов. Синтез
рецепторов и встраивание их в мембрану — это антиген—независимый процесс,
рассматриваемый как этап нормальной дифференцировки В—лимфоцитов. При попадании
антигена в организм происходит его связывание на рецепторах лимфоцитов, что
служит необходимым, но не единственным сигналом к дальнейшей пролиферации и
дифференцировке В—лимфоцитов. В большинстве случаев для индукции иммунного
ответа необходимо взаимодействие нескольких типов клеток: помимо
антителопродуцирующих В—клеток и их предшественников принимают участие
макрофаги и T—лимфоциты.
Первичный иммунный ответ, как правило, протекает в три
этапа: латентная фаза (антитела еще не обнаруживаются), log—фаза (постепенное
увеличение синтеза специфических антител), плато (поддержание максимального
количества циркулирующих антител). По достижении максимального уровня синтез
антител может прекратиться, что ведет к уменьшению их общей концентрации
вследствие катаболизма. Вторичный иммунный ответ, имеющий место при
повторном контакте с антигеном, развивается значительно быстрее. Он
характеризуется короткой латентной фазой, интенсивным антителообразованием и
более высоким максимальным уровнем антител. Существование вторичного иммунного
ответа обусловлено присутствием в организме долгоживущих клеток памяти.
В регуляции иммунного ответа гуморального
типа принимают участие многочисленные факторы. Антитела, появляющиеся в
начале иммунного ответа усиливают продукцию иммуноглобулинов. Антитела, синтезирующиеся
на более поздних сроках иммунного ответа и обладающие большим сродством к антигену,
оказывают ингибирующее действие на синтез иммуноглобулинов. Регуляция иммунного
ответа гуморального типа осуществляется
следующим образом: клетки— хелперы
усиливают синтез антител, затем активируются механизмы, ограничивающие этот процесс. Немаловажную роль при
этом играют генетические факторы.
Антитела продуцируются прежде всего в селезенке, костном
мозге и лимфатических узлах. Затем они попадают в кровь или лимфатические
протоки. Между внутри и внесосудистыми пространствами существует динамическое
равновесие, определяемое проницаемостью для соответствующего иммуноглобулина.
Концентрации IgA и IgE крайне высоки вне
сосудистого русла, так как они секретируются в основном в слизистых оболочках.
При первичном иммунном ответе выработка IgM
значительно опережает по времени синтез IgG, фаза продукции последнего
более продолжительна. При вторичном иммунном ответе IgG синтезируется более
активно. Подобная закономерность прослеживается для иммуноглобулинов в процессе
эволюции позвоночных.
Рыбы и хвостатые земноводные имеют только один класс
иммуноглобулинов, соответствующий высокомолекулярному IgM человека. У лягушек
появляется второй иммуноглобулин с молекулярной массой порядка 180 кДа, который
соответствует Ig—γ кур и наблюдается во всем
филогенетическом ряду от амфибий до птиц. Полагают, что этот иммуноглобулин
является непосредственным предшественником IgA млекопитающих. IgG, IgD и IgE
являются особенностью млекопитающих.
В ходе онтогенеза способность организма к иммунному
ответу на антиген возникает не сразу, а вырабатывается в течение длительного
периода. Сначала организм отвечает иммунными реакциями на ограниченное число
антигенов, постепенно их количество увеличивается. Организм новорожденных
обладает менее выраженной иммунологической компетентностью, чем взрослых.
Развитие иммунных реакций клеточного и гуморального типов в онтогенезе
происходит практически параллельно. При этом решающим фактором для индукции
иммунной реакции служит тип антигена. У плода человека в III триместре
беременности некоторые антигены могут вызывать иммунные реакции клеточного и
гуморального типа. Ответ на другие антигены возможен только после рождения
ребенка. У новорожденных способность к иммунному ответу проявляется в реакции
на прививку БЦЖ (
BCG (Bacillus CalmetteGuerin — бацилла Кальметта—Герена)
— вакцинный штамм микобактерии туберкулеза (Mycobacterium bovis) со
сниженной вирулентностью; применяется для профилактики туберкулеза), которую делают вскоре после
рождения. Первым иммуноглобулином, продуцирующимся в организме человека,
является IgM. К моменту рождения в организме ребенка обнаруживается
определенный уровень IgM. Концентрация IgM достигает уровня взрослого
индивидуума через 12 года, IgG — через 8 лет, IgA — спустя 10 лет.
Между клетками различных субпопуляций Т и В—лимфоцитов
возникают сложные сетевые взаимодействия вида идиотип—антиидиотип,
обусловленные их способностью распознавать не только чужеродные антигенные
детерминанты, но и идиотипические детерминанты самих лимфоцитарных рецепторов.
T—хелперы, T—супрессоры и В—лимфоциты взаимодействуют друг с другом в идиотип—антиидиотипических
реакциях, приводящих к стимуляции либо подавлению
иммунного ответа.
Регуляция пролиферации и дифференцировки в специфические
эффекторы Т— и В—лимфоцитов осуществляется с помощью цитокинов. Цитокины — это
гликопротеины, молекула которых содержит 100200 аминокислотных остатков.
Семейство цитокинов включает интерлейкины (выделено — 15, хорошо изучены функции
у 8), интерфероны, колониестимулирующие факторы, факторы некроза опухолей.
Часть из них продуцируется в организме постоянно, секреция других индуцируется
антигенами. Биологическая активность этих веществ осуществляется через
специфические рецепторы, широко представленные на многих типах клеток.
Цитокины контролируют протекание
иммунных реакций, инициируют формирование воспалительной реакции, участвуют в
элиминации опухолевых клеток, а также оказывают влияние на функциональное
состояние нервной и эндокринной систем.
Между иммунной и нейроэндокринной
системами существуют тесные двусторонние связи, которые определяют формирование
защитных реакций организма на повреждающие воздействия различной природы. В
реализации этих связей важное место принадлежит ИЛ1, обладающему широким
спектром влияний на механизмы резистентности организма. Помимо участия в
системе интраиммунной регуляции ИЛ1 в качестве иммуномедиатора оказывает прямое
влияние на структуры ЦНС. Нейротропные эффекты цитокина включают воздействие (непрямое)
на терморегуляторные центры и индукцию лихорадки, индукцию медленноволнового
сна, аналгетическое действие, снижение аппетита, а также активацию гипоталамо—гипофизарно—адренокортикальной
системы. Реализуемые через цитокины и антитела взаимосвязи между иммунной и
нейроэндокринной системами играют важную роль в механизмах резистентности
организма к различным патологическим факторам.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Вершигора
А. Е. Общая
иммунология. Киев, 1990.
Галактионов В. Г. Графические модели в иммунологии М., 1986.
Галактионов В. Г. Очерки эволюционной иммунологии. М., 1995.
Горышина Е.Н.,Чага О. Ю. Сравнительная гистология
тканей внутренней среды с основами иммунологии. Л.,1990.
Дреслер К.
Иммунология: Словарь. Киев, 1988.
Иммунология:
В 3 т. / Под ред. У. Пола. М., 1987.
Кетлинский
С. А.. Симбирцев А. С.. Воробьев А. А, Эндогенные иммуномодуляторы. СПб
1992
клиническая
иммунология и аллергология: В 3 т. / Под ред. Л. Йегера. М., 1990
клиническая
иммунология. Руководство для врачей / Под ред. Е. И. Соколова. М 1998
Лорнева Е. А., Шхинек Э. К. Гормоны и иммунная система. Л., 1988.
Новиков В.
С., Смирнов В. С. Иммунофизиология экстремальных состояний. СПб 1995
Пальцев М.
А., Иванов А. А Межклеточные взаимодействия. М., 1995.
Ллеифер Дж. Наглядная
иммунология. М., 1999.
Программированная
клеточная гибель / Под ред. В. С. Новикова. СПб., 1996
Роит А. Основы
иммунологии. М., 1991.
Хаитов Р.
М., Пинегин Б. В.. Истамов X. И. Экологическая иммунология. М 1995
Ярилин А.
А. Основы иммунологии. М. 1999.
Ярилин А.
А., Добротина Н. А. Введение в современную иммунологию. Н. Новгород,
1997.