6 ГОРМОНАЛЬНАЯ
РЕГУЛЯЦИЯ ФУНКЦИЙ
1533 — Ф.
Парацельс (Ph. Paracelsus, наст. имя Филипп фон Гогенгейм — Ph. v. Hohenheim Швейцария) обосновал лечение
некоторых заболеваний препаратами из тканей животных и человека.
1855 — К. Бернар (С. Bernard, Франция) предположил, что железы выделяют в кровь
«внутренние секреты», оказывающие действие на весь организм.
1855 — Т. Аддисон (Т. Addison, Великобритания), показал, что надпочечники являются
жизнено—важными органами, и описал «бронзовую болезнь», возникающую при их
повреждении.
1889 — Ш. Броун—Секар (Ch. Brown—Sequard, Франция) на основе опытов с
введением вытяжек из семенников основал учение о внутренней секреции.
1901 — Е.
Такамйне (J. Takamine, Япония) получил в чистом
кристаллическом виде действующее начало надпочечников (мозгового вещества) и
назвал его адреналином.
1902 — У. Бейлисс и Э. Старлинг (W. Bayliss, Е. Starling, Великобритания) открыли секретин
— первый из гормонов и, таким образом, основали эндокринологию. В 1905 г. по
предложению У. Харди (W. Hardy, Великобритания) Старлинг назвал новую группу веществ
«гормонами».
1909 — Т.
Кохер (Т. Kocher,
Швейцария) — Нобелевская премия за открытие роли щитовидной железы и разработку
щадящей операции для удаления ее по поводу зоба.
1910 — А.
Бидль (A. Biedl, Германия) выпустил первое руководство по физиологии
эндокринной системы.
1919 — Д.
Кендалл (D. Kendall, США) выделил тироксин и дал ему
название.
1923 — Ф. Бантинг (F. Banting, Канада),
Дж. Маклеод (J. Macleod, Канада) — Нобелевская премия за открытие
инсулина.
1929 — Э. Шаррер (Е. Scharrer, Германия) ввел понятие «нейросекреторная клетка», но его
взгляды получили признание только в 1960—е годы.
1931 — У. фон Эйлер и Дж. Гаддам (U. v. Euler, J. Gaddam, Швеция) открыли субстанцию Р — первый из регуляторных
пептидов.
1936 — Г. Селье (Н. Selye, Канада) открыл роль гормонов надпочечников (коркового
вещества) в процессах адаптации.
1947—Б. Усай (В. Houssay, Аргентина) — Нобелевская премия за исследования гормонов
передней доли гипофиза,
1940—1950—е — Г. Харрис (G. Harris, США)
описал систему воротного кровоснабжения гипофиза.
1950 — Э. Кендалл (Е. Kendall, США), Т. Рейхштейн (Т. Reichstein, Швейцария) и Ф. Хенч (Ph. Hench, США), —
Нобелевская премия за открытие кортикостероидов.
1955 — В. Дю Виньи (V. Du Vigneaud, США)—
Нобелевская премия по химии за впервые осуществленный синтез пептидного гормона
— окситоцина.
1975 — Хоффер (Hoffer, США) описал циркумвентрикулярные органы — особые области
мозга, через которые он получает значительную часть информации о состоянии
эндокринной системы.
1971 — Э. Сазерленд (Е. Sutherland, США) — Нобелевская премия за открытие вторичных
посредников, в частности, циклического аденозинмонофосфата.
1977 — Р. Гиймен (R. Guillemin, США), Э.
Шалли (A. Schally, США) — Нобелевская премия за открытие тиролиберина —
первого из известных рилизинг—гормонов гипоталамуса.
1977 — Р. Ялоу (R. Yalow, США) — Нобелевская
премия за усовершенствование методов радиоиммунологического исследования
пептидных гормонов (RIA).
1970—е — А.
А. Галоян (СССР) открыл, что сердце вырабатывает регуляторные пептиды.
1982 — С. Бергстрём, Б. Самуэльсон (S. Bergstrom, В. Samuelsson, Швеция) и Дж. Вейн (D. Vane.
Великобритания) — Нобелевская премия за открытие простагландинов.
1986 — С. Коэн (С. Cohen, США) и Р. Леви—Монтальчйни (R. Levi—Montalcini, Италия—США) — Нобелевская премия
за открытие пептидных факторов роста.
О
организме высших животных координация деятельности органов и тканей
осуществляется при участии нервной системы и влияний, оказываемых внутренней
средой. В последнем случае принято различать два типа воздействий. Первый из
них, названный неспецифическим, охватывает примеры отдаленного действия
продуктов тканевого обмена, поступающих в кровь. Второй является строго специализированным
и осуществляется системой желез внутренней секреции. Они вырабатывают
физиологически активные вещества, которые поступают в кровяное русло. Вещества
эти носят название гормонов. Понятие «гормон» является понятием сугубо
функциональным, а не химическим. Оно включает целый ряд веществ различной
химической структуры, и общим для гормонов является принцип их действия.
Гормональная
регуляция —
пример эволюционно наиболее древнего химического дистантного и локального
контроля. Термин гормон введен Р. Старлингом (1905) для секретина,
выделенного из двенадцатиперстной кишки и активирующего через кровь секрецию
сока поджелудочной железы. Доказательствами гормональной природы того или иного
вещества служат следующие признаки: выделение в кровь; наличие структуры —
«мишени»; существование специфического рецептора; связывание с рецептором
гормона должно осуществляться концентрационно зависимо и блокироваться
соответствующими антагонистами; подавление синтеза гормона или невозможность
связи с рецептором должно приводить к отсутствию гормонального эффекта.
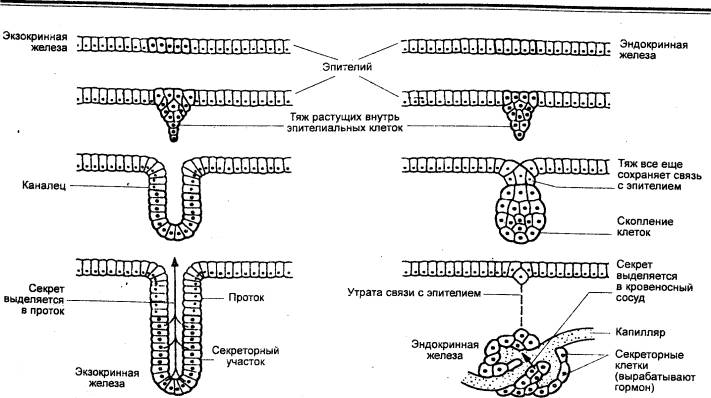
Ведущим морфологическим признаком желез внутренней
секреции является отсутствие протока, связывающего железу с внешней или
внутренней поверхностью организма (рис. 6.1). В связи с этим возник и сам
термин — железа внутренней секреции, называемая также эндокринной
железой.
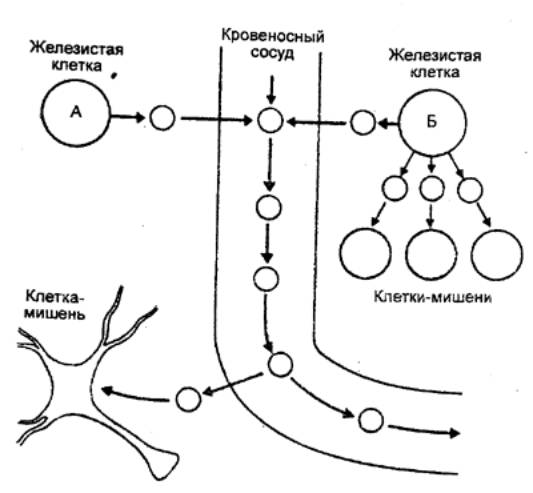
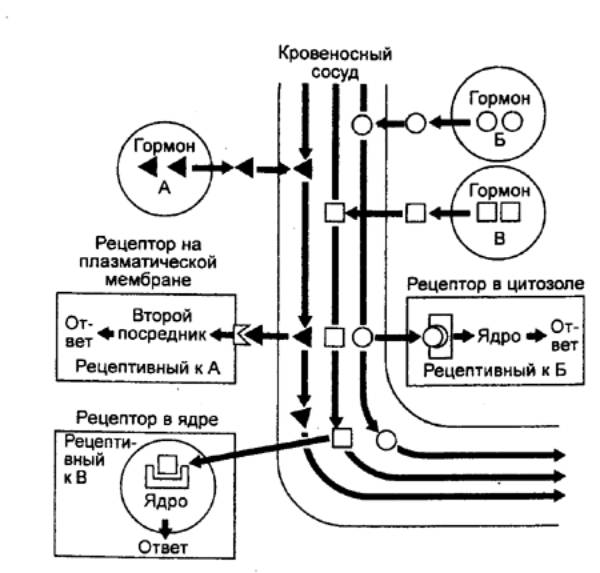
Помимо дистантного, осуществляемого через кровь,
регуляторного воздействия гормонов, синтезируемые клеткой вещества могут
оказывать и более локальное паракринное влияние на соседние клетки через
тканевую жидкость (рис. 6.2). Наряду с паракринным гормоном,
секретируемым в незначительных количествах в околоклеточное пространство,
имеется еще аутокринный гормон. Соответственно эффекты паракринных и
аутокринных гомонов локальны, тогда как гормон, выделяемый в кровь и ею
транспортируемый, действует дистально. Деление это условно, поскольку одно и то
же вещество в зависимости от изоформы молекулы и интенсивности его синтеза
может диффундировать недалеко, оставаясь в околоклеточном пространстве, или
далее поступать в кровеносный сосуд.
|
|
|
Рис. 6.1 Развитие экзокринных и эндокринных желез |
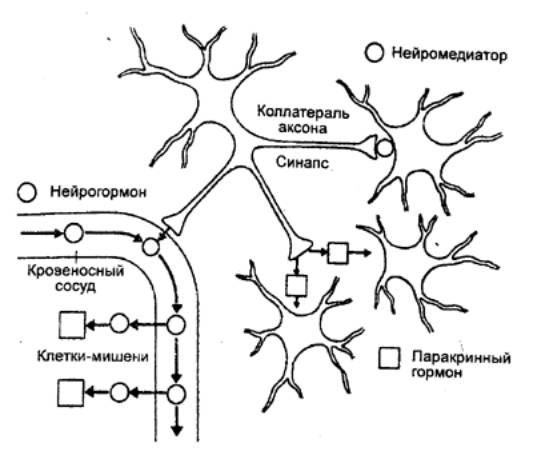
Следует
указать также на различие между нейромедиатором, нейрогормоном и паракринным
гормоном (рис. 6.3). Как, известно, нейрон в своей соме вырабатывает некое
вещество. Если оно выделяется в синаптических окончаниях, то соответствует
определению нейромедиатора. Аксон того же нейрона может иметь
коллатераль, которая оканчивается на кровеносном сосуде и высвобождает это же
вещество в кровоток. В таком случае оно ведет себя как гормон. Из другой
коллатерали аксона то же вещество диффундирует в окружающую ткань и действует
на соседнюю группу клеток, т. е. обладает паракринным действием.
Сходство генома соматических клеток предопределяет возможность секреции этого
вещества или его изоформ и в качестве цитокина — гормона подвижных
одиночных клеток крови и иммунной системы.
|
|
|
Рис. 6.2 Различия между гормональной (слева) и
паракринной (справа) регуляцией |
|
|
|
Рис. 6.3 Различие между
нейромедиатором, нейрогормоном и паракринным гормоном |
Филогенетически первичный
голокриновый тип секреции связан с разрушением клетки и выделением всех веществ
в окружающую среду (например, тромбоцитами при гемостазе). Другие типы секреции
характеризует избирательность выделяемого клеткой вещества или комплекса
соединений. Многие из них являются осмотически активными, что позволяет
рассматривать секрецию как механизм, предотвращающий разрушение клетки, при
повышении внутриклеточного осмотического давления. К осмотически активным
веществам относятся связывающие воду ионы (особенно натрия, хлора, калия),
белки и пептиды, глюкоза, производные липидов, мочевина и другие вещества,
поглощаемые или синтезируемые клеткой. Многие из них могут регулировать
осмотическое давление не только в клетке, но и в околоклеточном пространстве,
на уровне органа или организма. Другой, не менее важной для существования особи
или вида, функцией является регуляция клеточного цикла и роста клеток, а также
процессов репродукции. Поскольку эти процессы являются энергоемкими, то многие
гормоны регулируют энергетический гомеостаз на разных уровнях. Взаимосвязь этих
процессов в значительной мере обусловлена полиэффекторностью многих гормонов,
наряду со спецификой их действия.
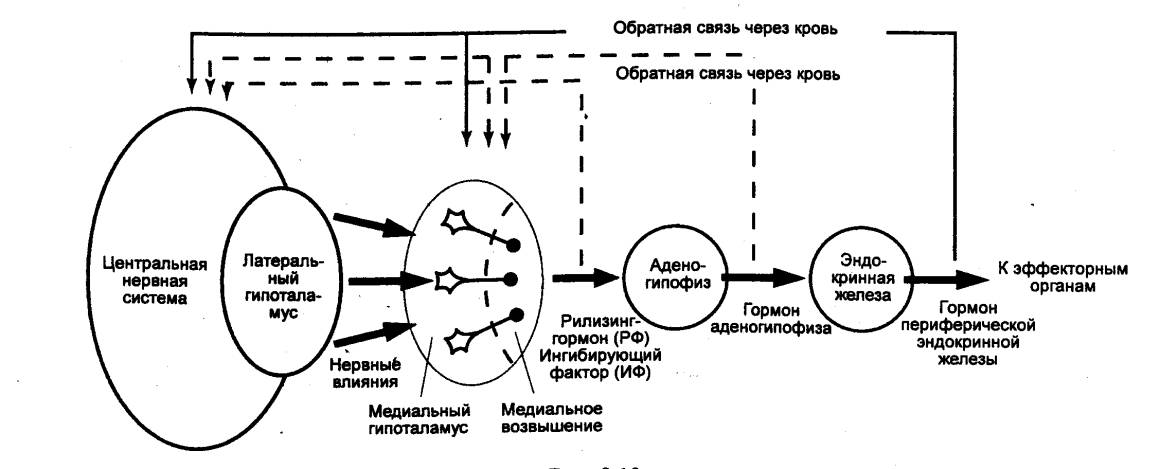
Эндокринная система
организма животных и человека включает комплекс центральных (церебральных) и
периферических эндокринных желез, а также другие гормон—продуцирующие
структуры. Центральные выделяют тропные гормоны, стимулирующие секреторную
активность периферических желез. К центральным относят шишковидное тело,
гипофиз и слюнные железы, к периферическим — щитовидную, паращитовидные,
вилочковую (тимус), поджелудочную железы, надпочечники и гонады. Сейчас к ним
еще добавлены и гормон—продуцирующие структуры: сердце, легкие, печень, почки,
сенсорные и репродуктивные органы, а также целые системы: сердечно—сосудистая,
дыхательная, мышечная, костная, иммунная, пищеварительная.
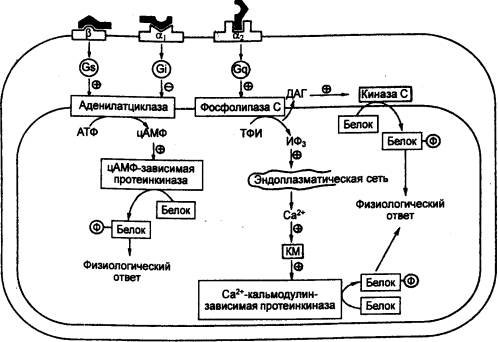
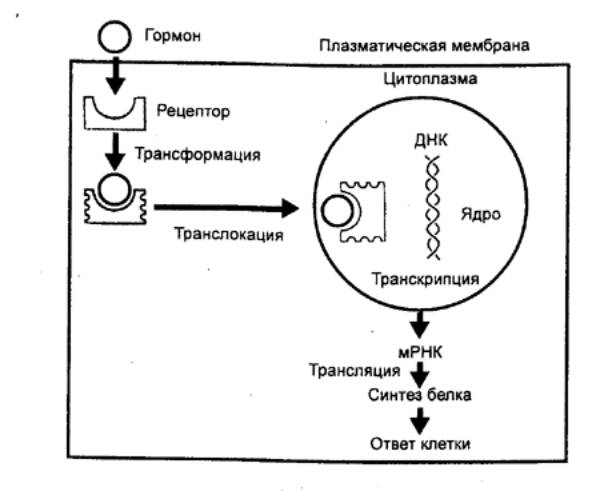
Специфика трансмембранных
градиентов рН, осмотического давления, концентрации ионов и другие факторы
определяют характерные для каждого типа тканей условия экспрессии генов,
синтеза и процессинга гормонов. Это приводит не только к различию гормонопоэза (от греч. poiesis
— выработка, образование) в разных структурах организма, но и к возможному сходству
молекулярных форм гормонов. Последнее обеспечивает возможность быстрой
локальной периферической регуляции функций и подключение к ней при
необходимости сходных гормонов, дополнительно секретируемых центральными
железами. С другой стороны, гормоны или их фрагменты, выделяемые
периферическими структурами, с током крови могут попадать в церебральное русло
и оказывать стимулирующее или тормозное воздействие на центральный гормонопоэз
и функции головного мозга (эмоции, поведение и т. д.). Важно подчеркнуть, что
комплексы гормонов, гормонопоэз которых взаимозависим, на всех уровнях
организма синтезируются совместно.
Гормоны, синтезируемые
центральными и периферическими эндокринными железами, а также нейронами или
специализированными нейросекреторными клетками, регулируют в нервной ткани
сходные процессы: метаболизм, энергетический обмен, мембранный транспорт,
процессы синтеза и выделения веществ, осмотическое давление нейроплазмы,
межклеточной жидкости, ликвора, крови и других жидкостных сред. Все это
изменяет уровень поляризации нейрональных мембран и, соответственно, активность
нервных центров регуляции висцеральных систем и поведения организма.
6.1. ЗНАЧЕНИЕ И МЕСТО ЭНДОКРИННОЙ РЕГУЛЯЦИИ В ОБЩЕЙ
СИСТЕМЕ ИНТЕГРАЦИОННЫХ МЕХАНИЗМОВ
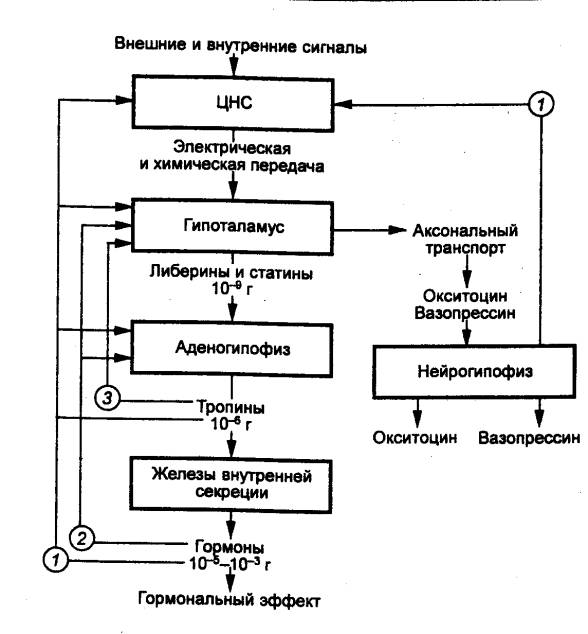
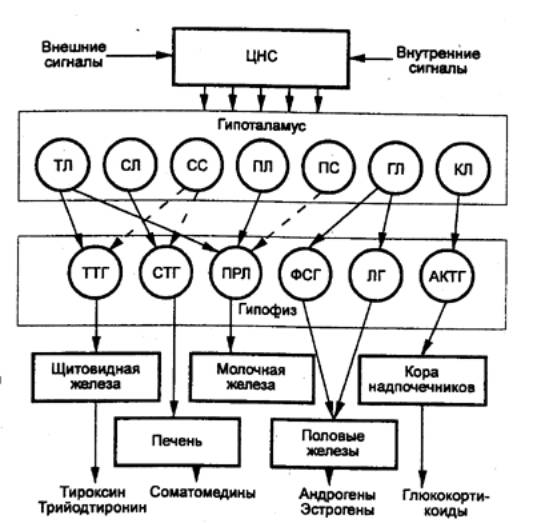
Эндокринные железы и выделяемые ими гормоны находятся
в тесном взаимодействии с нервной системой, образуя общий интеграционный
механизм регуляции. Регулирующее влияние ЦНС на физиологическую активность
желез внутренней секреции осуществляется через гипоталамус. Гипоталамус
связан афферентными путями с другими структурами ЦНС _ со спинным,
продолговатым и средним мозгом, таламусом, базальными ядрами, лимбическими
образованиями, отдельными полями коры больших полушарий и др. Благодаря этому в
гипоталамус поступает информация от всего организма и передается эндокринным
железам.
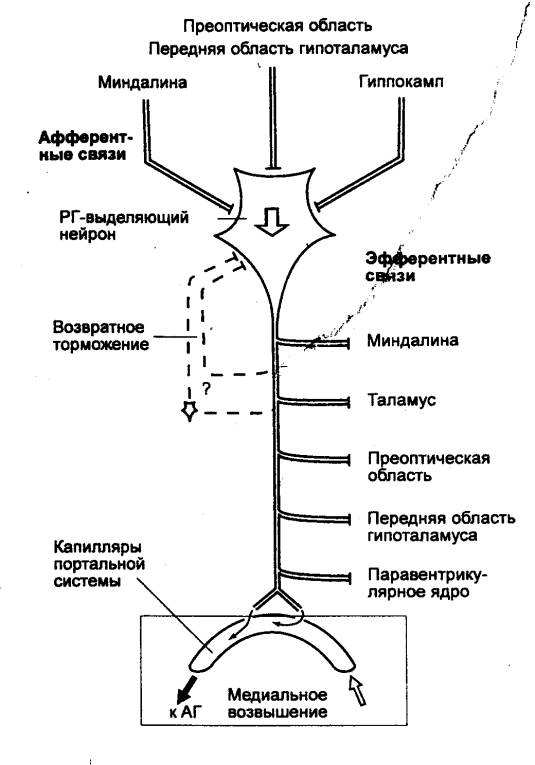
Таким образом, нейросекреторные клетки гипоталамуса
трансформируют афферентные нервные стимулы в гормональные факторы.
Гипоталамические гормоны оказывают влияние на функцию
клеток гипофиза ,вырабатывающих ряд тропных гормонов, которые в свою
очередь влияют на синтез и секрецию гормонов ряда периферических эндокринных
желез оказывают действие на органы или ткани—мишени. Все уровни этой системы
взаимодействий тесно связаны между собой комплексами обратных связей.
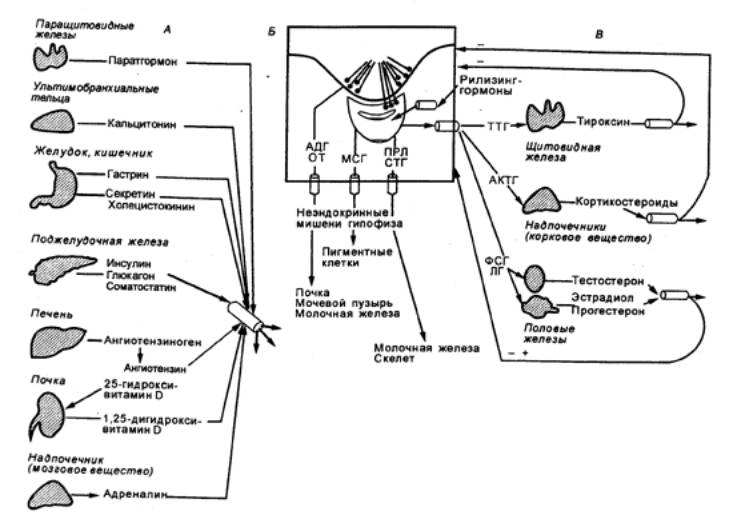
Важную роль в регуляции функций эндокринных желез
играют медиаторы автономных нервных волокон, т. е. существует двойной
контроль за деятельностью желез внутренней секреции (рис. 6.4).
|
|
|
Рис.
6.4 Система гормональной регуляции организма
позвоночных А — эндокринные железы, не являющиеся органами—мишенями
гипофиза—Б — гипоталамо—гипофизарная
система; В — эндокринные железы—мишени гормонов аденогипофиза. Висперотропные
нейрогормоны: АДГ — антидиуретический гормон, ОТ — окситоцин; гормоны
аденогипофиза: АКТГ — адренокортикотропный гормон, ЛГ — лютеинизирующий
гормон ПРЛ — пролактин, СТГ — соматотропный гормон, ТТГ — тиреотропный гормон
ФСГ — фолликулостимулирующий гормон; гормон промежуточной доли гипофиза—МСГ —
меланодитстимулирующий гормон. |
6.1.1. Методы изучения
функций желез внутренней секреции
Наиболее давним и широко используемым приемом вплоть до
настоящего времени является удаление или разрушение органа, который, по
предположению, выполняет эндокринную функцию, и прослеживание последствий такой
операции. Устанавливают симптомы недостаточности гормонов и затем путем
введения экстрактов железы или ее ткани, т. е. путем так называемой заместительной
терапии, демонстрируют восстановление нормальных функций. Таким образом
доказывается выработка в органе гормона с определенным физиологическим
действием. В последние десятилетия расшифрована химическая структура и
осуществлен синтез многих гормонов. Очищенные препараты гормона часто
используют в качестве заместительной терапии при определении функции изучаемого
органа. Экстракты или гормоны исследуют также при введении интактным животным,
что позволяет получить дополнительную информацию о функциональном значении этих
гормонов. Введение экстрактов эндокринных желез, очищенных препаратов или синтетических
гормонов широко используют в клинической медицине прежде всего в случаях
нарушения нормальной функции желез. Если функция эндокринной железы
недостаточна, гормон можно вводить извне; в тех случаях, когда функция железы
не нормализуется, эту заместительную терапию проводят в течение всей жизни
больного. В качестве примера можно привести некоторые формы сахарного диабета,
возникающего в результате нарушения функции β—клеток поджелудочной железы;
при этом больному вводят гормон поджелудочной железы — инсулин — с
постоянным контролем уровня глюкозы.
Кроме удаления эндокринных желез и выполнения
заместительной терапии в эндокринологии используют гистофизиологический
метод оценки функционального состояния эндокринных органов. При этом
изучают изменения в железе на разных этапах жизненного цикла животного или при
различных физиологических нагрузках с привлечением специфических
гистологических и гистохимических методов, электронной микроскопии, с
количественной оценкой показателей функций клеток и тканей.
Большое значение имеет определение содержания
гормона в ткани железы и в крови. Для этой цели ранее широко использовали метод
биотестирования, состоящий в том, что испытываемый экстракт вводят животному
(после удаления у него соответствующей эндокринной железы) и прослеживают
возникающие изменения изучаемого биологического эффекта гормона. Количество
гормона, которое изменяет такой показатель на определенную величину, называют гормональной
единицей. Этот метод требует больших количеств испытываемого материала,
сложен и недостаточно точен. Однако для некоторых гормонов (например, для
инсулина) гормональные единицы до сих пор используют в качестве количественной
меры концентрации. В настоящее время для определения гормонов широко используют
радиоиммунологический метод. В радиоиммунологическом анализе используют иммуноглобулины
(антитела), которые специфически связывают исследуемый гормон. Связывание
гормона антителами высокоспецифично, что позволяет анализировать малые
количества гормонов.
Радиоиммунологический анализ весьма точен и
чувствителен, причем в течение одного рабочего дня можно обработать несколько
сотен проб. Однако с его помощью можно измерять только иммунологическую
активность гормона, которая не всегда совпадает с биологической активностью.
В дальнейшем был разработан метод, в котором для
связывания гормона используют специфические рецепторы. Это дает
возможность получать более точные данные о концентрации гормона.
6.1.2. Понятие о нейросекреции
В гл. 2 уже были приведены
сведения о развитии регуляторных механизмов в эволюции. На ранних этапах
эволюции возникли нейросекреторные клетки которые способны вырабатывать
гормоны, называемые также нейрогормонами. Эти нейросекреторные клетки
обнаруживают многие свойства нейронов: они обладают аксоном, дендритами,
тельцами Ниссля и нейрофибриллами, способны генерировать и проводить нервные
импульсы.
Нейросекреторные клетки
обнаружены у беспозвоночных и у всех позвоночных животных. У многих беспозвоночных
они локализованы преимущественно в церебральных ганглиях, у насекомых
расположены во всех ганглиях ЦНС. У всех позвоночных животных нейросекреторные
клетки находятся в головном мозгу в области гипоталамуса, а у рыб они
обнаружены также в каудальной части спинного мозга и образуют каудальную
нейросекреторную систему. По существу, нейросекреторными являются также клетки
мозгового вещества надпочечников и многих перивентрикулярных структур ЦНС.
В процессе эволюции
происходит развитие нейросекреторных систем которые состоят из групп
клеток, образующих ядра (например, ядра гипоталамуса). От тел
нейросекреторных клеток отходят аксоны, составляющие тракт, который
оканчивается в нейрогемальной области. Здесь расположены окончания
волокон, транспортирующих нейросекрет, и кровеносные сосуды.
Развитые нейросекреторные
системы у беспозвоночных и позвоночных животных обнаруживают черты сходства.
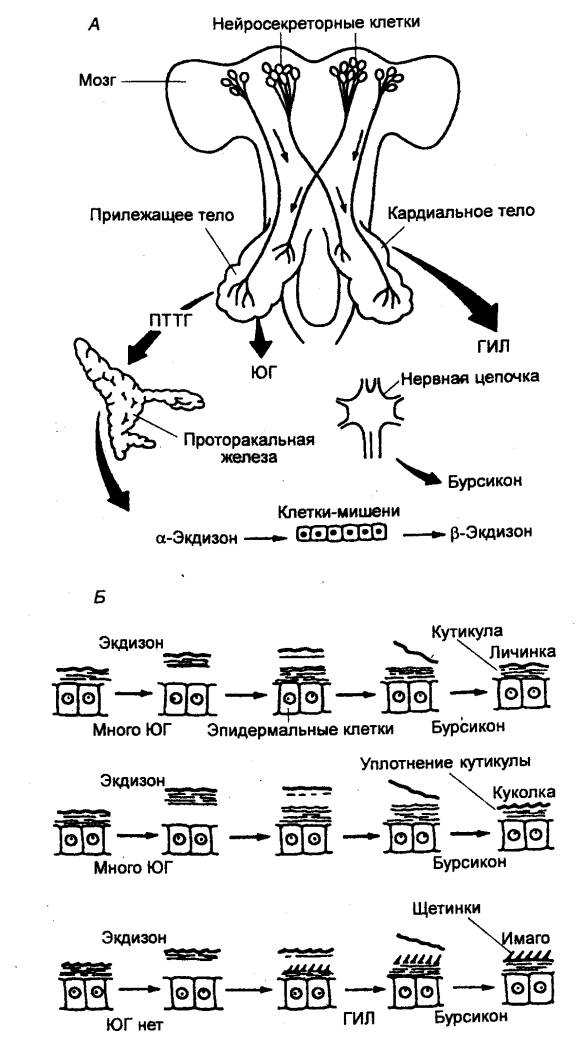
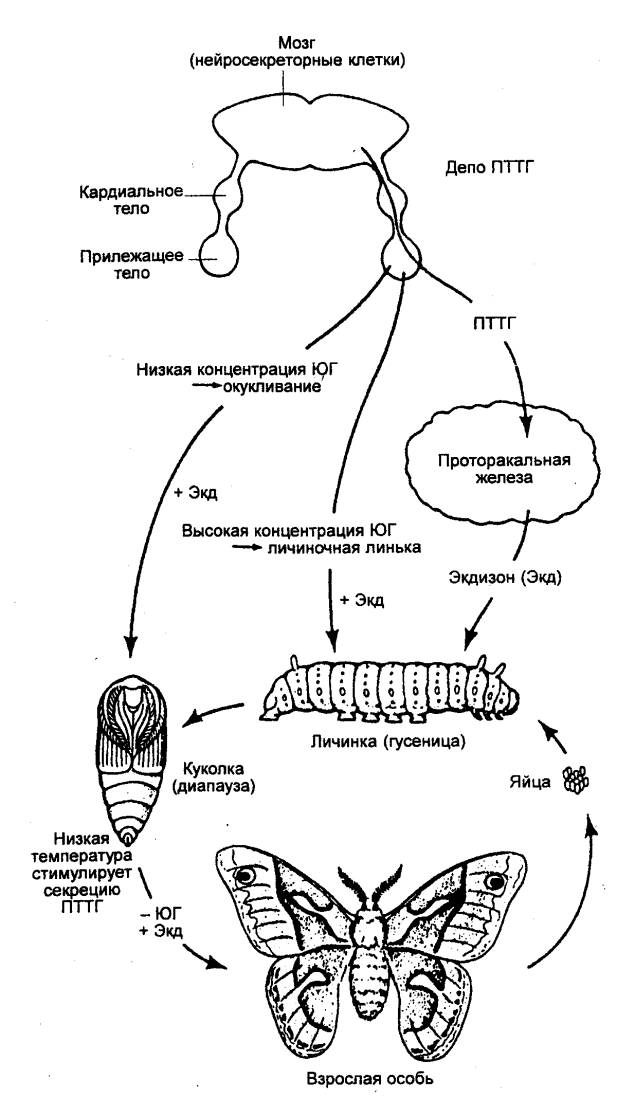
Так, нейросекреторные клетки мозга насекомых (рис. 6.5) доставляют гормоны
путем аксонального транспорта в неирогемальные органы — кардиальные и прилежащие
тела. Продукты нейросекреции — проторакотропный гормон (ПТТГ), гормон
имагинальной линьки (ГИЛ) — высвобождаются в гемолимфу синусов, окружающих
окончания. Прилежащие тела секретируют также ювенильный гормон (ЮГ). В
целом это приводит к смене личиночной, куколочной и взрослой стадий метаморфоза
(рис. 6.6).
У
ракообразных нейросекреторные клетки сконцентрированы в так называемом Х—органе,
а их аксоны направляются в нейрогемальный орган — синусную железу, где
депонируется нейросекрет. У низших позвоночных, у рыб существуют две
нейросекреторные системы: каудальная в спинном мозгу и гипоталамо—гипофизарная.
Аксоны нейросекреторных клеток каудальной неиросекреторной системы образуют
тракт, оканчивающийся в нейрогемальном органе — урофизе; синтезирующиеся
гормоны связываются с белком—носителем.
В гипоталамусе всех
позвоночных животных и человека расположен ряд скоплений нейросекреторных
клеток, в которых вырабатываются две основные группы гормонов: белковопептидные
и моноаминовые — дофамин норадреналин и серотонин.
Нейросекреторные клетки ядер гипоталамуса посылают
аксоны в разные неирогемальные области мозга: в продолговатом мозгу это самое
заднее поле в гипоталамусе — нейрогипофиз, медиальное возвышение, субкомиссуральные
и субфорникальный органы, а также сосудистый орган терминальной пластинки в
передней стенке III желудочка. Все они относятся к так называемым циркумвентрикулярным
органам мозга, содержат перфорированные капилляры. На уровне этих структур
ГЭБ обустроен особым образом. Синтезируемые в гипоталамусе вещества могут через
эти капилляры попадать в кровь (церебральный и системный кровоток) и в ликвор.
В нейросекреторных
|
|
|
Рис. 6.5 Эндокринная нервная система насекомых и ее роль в процессе
линьки (А), а также изменение кутикулы в процессе линьки, приводящие к смене
(сверху вниз) личиночной, куколочной и взрослой стадий (Б) ПТТГ — проторакотропный гормон; ГИЛ — гормон
имагинальной линьки; ЮГ — ювенильный гормон. |
|
|
|
Рис. 6.6 Взаимодействие
гормонов в процессе метаморфоза у насекомых ПТТГ — проторакотропный
гормон; ЮГ — ювенильный гормон. |
клетках гипоталамуса, кроме гормонов, синтезируются также
белки—носители, транспортирующие гормоны в крови. Возможно, им присущи и другие
функции.
В нейросекреторных клетках
гипоталамуса хорошо развиты эндоплазматический ретикулум, комплекс Гольджи,
образуются элементарные нейросекреторные гранулы, которые с током аксоплазмы
перемещаются в отростки клеток. В окончаниях происходит отщепление части
молекул гормона от носителя и переход его в кровь. Характерную особенность
клеток составляет большое число синапсов на теле и отростках. Функция
эффекторных нейросекреторных клеток контролируется большим числом
интернейронов. На поздних
|
|
|
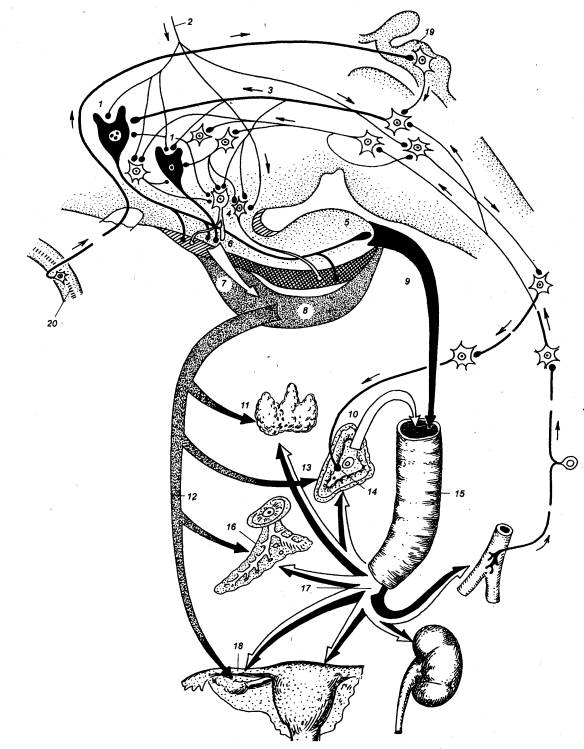
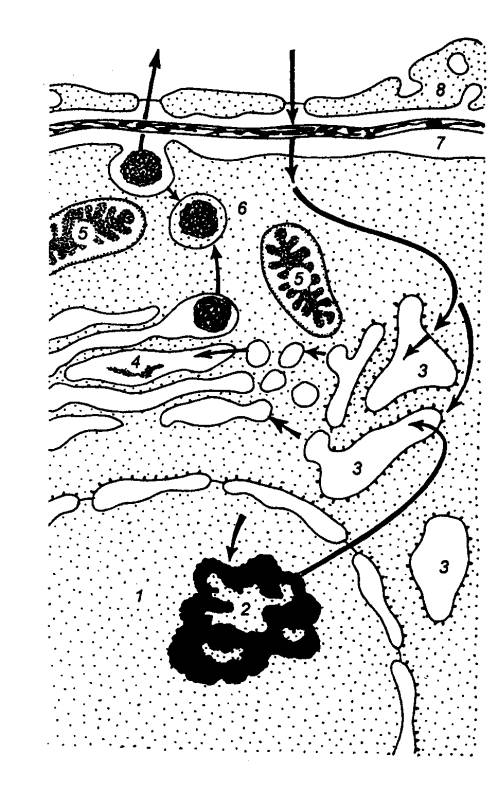
Рис. 6.7 Нейрогормональный
контроль висцеральных органов 1 — пептидергические
нейросекреторные клетки (Нск), 2 — пути к различного
типа Нск и нейронам гипоталамуса от супрагипоталамических областей мозга, 3
— катехоламинергические пути к гипоталамическим Нск, 4 — моноаминергические Нск, 5 — нейрогипофиз, 6 — медиальное возвышение, 7 —
влияние пептидных аденогипотрофизопных и моноаминовых нейрогормонов на
аденогипофиз через портальный кровоток, 8 — аденогипофиз, 9 —
пара—аденогипофизарные пути влияния пептидных висцеральных нейрогормонов на
нейрогипофиз, 10— поступление катехоламинов из мозгового слоя надпочечников в
кровоток, 11 — влияние на
шитовидную железу, 12— пути влияния тропных гормонов аденогипофиза, 13 — влияние на кору надпочечников 14— хромафинные клетки мозгового слоя надпочечников, 15 — магистральный сосуд общего
кровотока, 16— влияние на эндокринную
часть поджелудочной железы— панкреотические островки(Лангерганса), 17 —
влияние нейрогормомов на висцеральные органы, 18— влияние на гонаду( половую
железу); сплошными линиями обозначены доказанные межнейрональные связи
прерыви стыми — предполагаемые связи, стрелками — направление нервного
импульса, 19 — пластинка
крыши, 20—сосуд. |
этапах эволюции в эту
регуляцию включаются высшие интегративные центры головного мозга.
Интернейроны головного мозга, иннервирующие нейросекреторные
клетки гипоталамуса, собирают афферентные импульсы, которые идут от экстеро— и
интероцепторов и сигнализируют об изменениях во внешней и внутренней среде
(рис. 6.7). В настоящее врем выяснен механизм двойного контроля в результате
взаимодействия пептидных и моноаминовых нейрогормонов на уровне эффектора.
6.2.
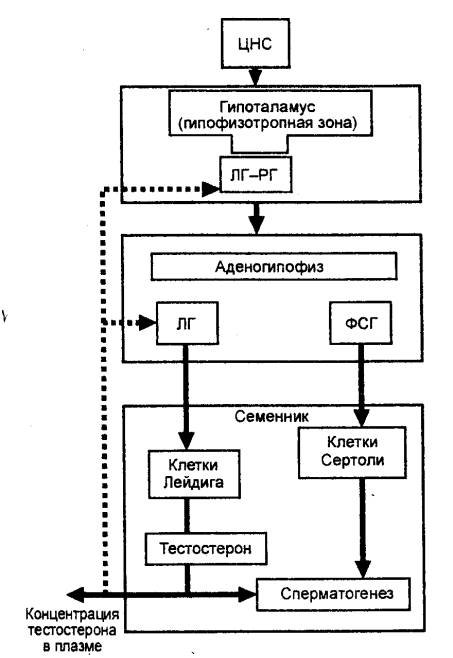
ГИПОТАЛАМО—ГИПОФИЗАРНАЯ СИСТЕМА
Гипоталамо—гипофизарную систему можно разделить на
две основные части: гипоталамо—заднегипофизарную (нейрогипофизарную) систему, в
которой вырабатываются нейрогормоны (вазопрессин и окситоцин), и гипоталамо—аденогипофизарную
систему, в которой вырабатываются гипофизотропные факторы — либерины и статины.
Либерины (рилизинг—гормоны) стимулируют, а статины подавляют секрецию гормонов
аденогипофиза (рис. 6.5, 6.8, 6.9). Кроме этих двух основных систем существует
нейросекреторная иннервация вегетативных центров ствола мозга и
лимбической системы. Проводящие нейросекрет волокна обнаружены и в других
структурах головного и спинного мозга.
|
|
|
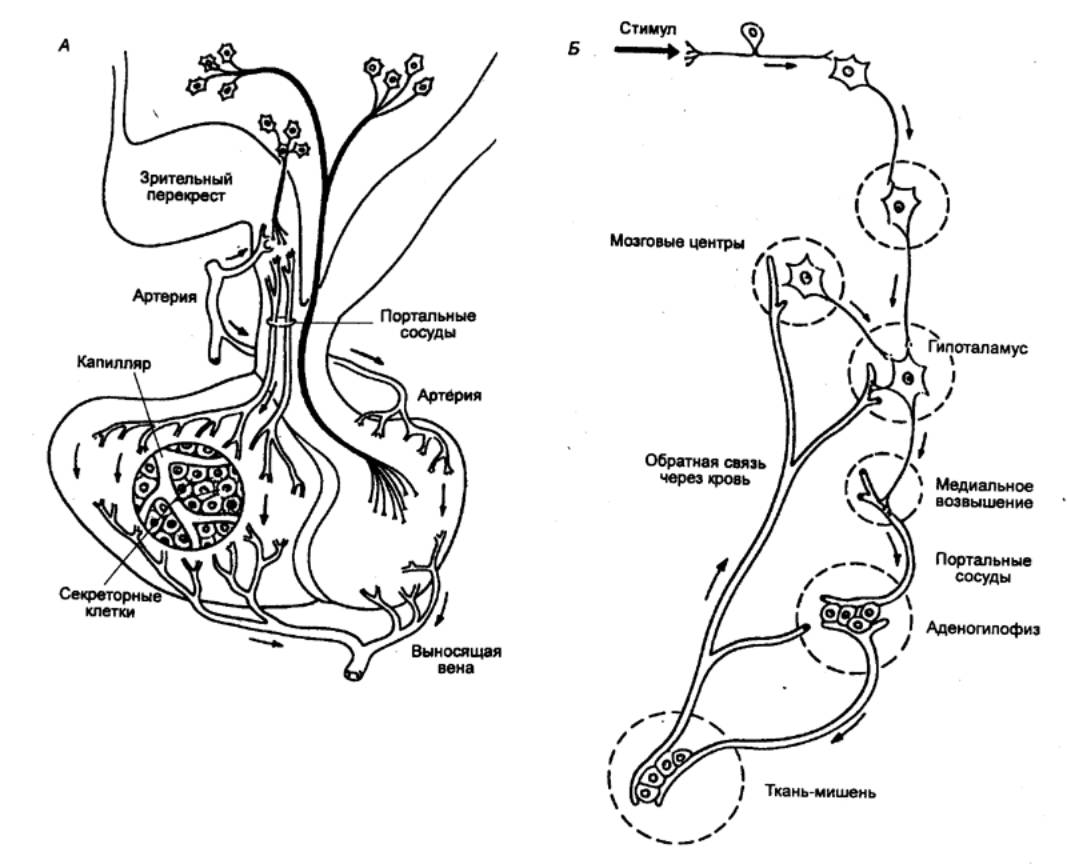
Рис. 6.8 Гипоталамо—гипофизарноя портальная система На А: либерины и статины, выделяемые
окончаниями нейросекреторных клеток в медиальном возвышении, поступают по
портальным сосудам в аденогипофиз, где стимулируют или подавляют секреторную
активность. На Б: импульсы,
поступающие в гипоталамус из разных структур мозга, вызывают в медиальном
возвышении секрецию либеринов и статинов. |
6.2.1. Гипоталамо—нейрогипофизарная система
Гипоталамо—нейрогипофизарная система состоит из крупных
нейросекреторных клеток, которые у высших позвоночных располагаются в двух
основных ядрах: супраоптическом и паравентрикулярном. Волокна,
проводящие нейросекрет и составляющие гипоталамо—гипофизарный тракт,
оканчиваются в нейрогемальном органе — нейрогипофизе, или задней доле гипофиза.
В клетках этих ядер происходит выработка висцеротропных гормонов (ранее их
называли нейрогипофизарными) — вазопрессина, или антидиуретического
гормона (АДГ), и окситоцина. В супраоптическом ядре вырабатывается
преимущественно вазопрессин, а в паравентрикулярном — больше окситоцина. Эти
гормоны являются нонапептидами, т. е. состоят из девяти аминокислот. У низших
позвоночных существует единое преоптическое ядро, в котором
вырабатываются гомологи вазопрессина и окситоцина.
Вазопрессин
(или антидиуретический гормон — АДГ) — ведущий фактор регуляции
осморегуляторной функции почек (табл. 6.1). Он уменьшает мочеотделение и
повышает осмотическую концентрацию мочи. Это действие гормона связано главным
образом с увеличением проницаемости стенки канальцев для воды. Рецепторы
гормона расположены в почечных канальцах. В связи с функциональным значением
АДГ его содержание выше у животных, обитающих в аридной зоне (например, у
верблюдов), и, напротив, при жизни в условиях высокой влажности АДГ
вырабатывается в незначительном количестве (морская свинка).
Окситоцин
оказывает влияние на гладкую мускулатуру матки и других органов (семенных
протоков, стенки кровеносных сосудов и пр.), стимулирует родовую деятельность.
Кроме того, этот гормон вызывает, сокращение миоэпителиальных клеток в молочной
железе, стимулируя выделение молока.
Помимо специальных висцеротропных эффектов эти
гормоны могут действовать синергично с рилизинг—гормонами, способствуя выходу
аденогипофизарных гормонов, т. е. обладают свойствами либеринов.
Та б л и ц
а 6.1
Гормоны супраоптического и
паравентрикулярного ядер
|
Гормон |
Группа
животных |
Ткань—мишень |
Основное
действие |
Регуляция
секреции |
|
Вазопрессин |
Млекопитающие |
Почка |
Усиление
реабсорбции воды |
Секрецию
стимулирует повышение осмотического давления плазмы или уменьшение объема
крови |
|
Окситоцин |
Млекопитающие |
Матка |
Сокращение
гладких мышц |
Секрецию
гормонов у млекопитающих вызывает раздражение сосков при сосании и растяжение
шейки матки. Повышенная концентрация прогестерона подавляет секрецию |
|
Аргинин—вазотоцин |
Все
классы позвоночных |
Почка |
Усиленная
реабсорбция (у четвероногих) |
Секрецию
стимулирует повышение осмотического давления плазмы или уменьшение объема
крови |
|
Мезотоцин |
Рептилии,
амфибии, двоякодышащие рыбы |
Почка |
Уменьшение
реабсорбции воды |
Неизвестна |
Гормоны в комплексе с нейрофизином в виде гранул транспортируются из тел клеток
по аксонам в нейрогипофиз. Терминали аксонов образуют тесные контакты с
капиллярами, в которые выделяются гормоны. Поступившие в кровь свободные от
носителя гормоны быстро разрушаются: период их полураспада составляет 2—4 мин,
инактивация происходит в печени и почках. Фрагменты молекул более стойки к
действию протеаз крови.
|
|
|
Рис. 6.9 Нейрон гипофизотропной зоны, гипоталамуса,
образующий либерины АГ — аденогипофиз, РГ — рилизинг—гормон (фактор) |
Молекулы вазопрессина и окситоцина состоят из 9
остатков аминокислот, по двум из которых они различаются. Оба гормона
секретируются в меньших количествах и другими структурами нервной системы, клетками
вилочковой железы, поджелудочной железы, надпочечников, почек и гонад (половых
желез). В геноме гены гормонов различны, что делает возможным раздельную
стимуляцию их секреции. Они включают экзоны, кодирующие нонапептид, его
транспортер нейрофизин и гликопротеин. Запуск увеличения секреции вазопрессина
происходит при действии ряда стрессорных факторов и, в частности, увеличении
осмотического давления плазмы крови, ликвора, межтканевой жидкости. Последнее
происходит вследствие диеты, обогащенной
осмотически активными веществами (глюкозой, липидами,
белками, NaСl), или уменьшения объема жидкости в организме (при
лактации, кровопотерях, усиленном потоотделении, диурезе — образовании и
выделении мочи, диарее — поносе). Поэтому основными механизмами гомеостатирования
осмотического давления, в которых участвует вазопрессин, является уменьшение
потерь жидкости через почки и легкие, а также увеличение потребления воды через
запуск жажды и питьевого поведения. Нормализации осмотического давления
способствует также регуляция вазопрессином концентрации ряда осмотически
активных веществ в плазме крови. В разных структурах эти эффекты опосредуются
через разные типы рецепторов к гормону.
В гломерулярном слое коры надпочечников вазопрессин
увеличивает секрецию альдостерона, обладающего однонаправленным с ним анти—Nа—уретическим
эффектом в почечных канальцах. В легких вазопрессин стимулирует секрецию
гормона пневмадина, уменьшающего выделение воды на выдохе.
В головном мозгу наряду с регуляцией внутричерепного
давления, вазопрессин увеличивает связывание воды глией. Насыщенность нейропиля
водой предохраняет нейроны от скачков трансмембранных градиентов осмотического
давления. Помимо того, посредством локальной вазоконстрикции и регуляции
системного артериального и внутричерепного давлений гормон участвует в
перераспределении объема жидкости между структурами.
Уменьшая выделение из организма осмофильных ионов Na+
и Cl—, вазопрессин снижает концентрацию в плазме крови и другого
осмотически активного вещества —
глюкозы. Как и другие гормоны гипофиза, выделяющиеся при cтpecce, он
активирует в мембране нейрона транспортер, переносящий глюкозу в клетку, а
также внутриклеточный гликолиз и стимулирует секрецию инсулина, обладающего выраженным
гипогликемическим эффектом. Это приводит не только к нормализации осмотического
давления, но и к активации метаболизма нейронов, деполяризации их мембран, к
повышению возбудимости ЦНС в целом, а также селективно — центра жажды и
питьевого поведения гипоталамуса. Выбору адаптивной программы поведения
способствует активация вазопрессином механизмов долговременной памяти.
Усиление секреции окситоцина происходит при
растяжении матки во время акта родов. Раздражение рецепторов соска во время
акта сосания также способствует выделению окситоцина. При этом в «рефлексе
выделения молока» афферентное звено представлено нервными путями, а эфферентное
— гормональным посредником.
Первый рецептор окситоцина ОТ1 был обнаружен в
гладкомышечных элементах матки, а затем и в гипоталамо—гипофизарной системе. Он
сопряжен с G—белками, что определяет Ca2+—зависимую стимуляцию
окситоцином сокращений матки при родах и миоэпителиальных клеток молочной
железы (рефлекс выведения молока), подвижность сперматозоидов, экзоцитоз пролактина,
норадреналина, а также и самого гормона. Тормозные эффекты окситоцина
опосредуются через рецептор ОТ2.
Циркадная секреция вазопрессина и окситоцина
определяет суточную цикличность состояний бодрствования. У человека отмечены
два максимума содержания вазопрессина в плазме крови: с 8 до 10 ч и с 16 до 18—20
ч. Во время сна подъемы содержания вазопрессина приходятся на стадию быстрого
сна, когда «висцеральная буря» из—за возрастающей гипоксии на предыдущей стадии
приводит к появлению десинхронизации в ЭЭГ. При родах анальгезирующее действие
окситоцина сочетается с усилением сокращения гладких мышц матки и снижением
возбудимости ЦНС. В послеродовой период снижение возбудимости ЦНС ослабляет
воздействие стрессорных факторов и воспоминаний о них на кормящую мать,
предотвращая невротизацию ребенка. Повышение концентрации окситоцина в плазме
крови в недели, предшествующие родам, активирует иммунокомпетентные клетки и
процессы в репродуктивных органах.
Эволюция висцеротропных нонапептидных гормонов
гипоталамуса. У млекопитающих
описаны два основных гормона — окситоцин и аргинин—вазопрессин, и
лишь у отдельных животных, например, у свиньи имеется вместо аргинин—вазопрессина
лизин—вазопрессин, отличающийся одной аминокислотой. Однако у
позвоночных описано девять других нонапептидных гормонов.
У
наиболее древних из ныне живущих позвоночных — круглоротых (миноги, миксины) —
существует только один гормон — аргинин—вазотоцин. У этих животных он
выполняет широкие регуляторные функции. Все другие позвоночные (кроме млекопитающих)
также имеют аргинин—вазотоцин. Однако у ряда рыб аргинин—вазотоцин проявляет
диуретическое свойство, и лишь с выходом позвоночных на сушу этот гормон
приобретает антидиуретическое действие.
В
процессе эволюции позвоночных происходит постепенная смена клубочкового диуреза
на клубочковый антидиурез (амфибии), а затем возникает канальцевая реабсорбция.
По—видимому, у низших позвоночных этот гормон участвует также в регуляции ряда
репродуктивных функций, в частности, совместно с мезотоцином и другими
гомологами окситоцина влияет на гладкую мускулатуру половых путей, способствуя
выходу половых клеток. Таким образом, у низших позвоночных сфера действия этих
гормонов более широкая, чем у млекопитающих.
Гомологами окситоцина млекопитающих являются мезотоцин,
обнаруженный у амфибий, рептилий, птиц, и другие окситоциноподобные гормоны,
найденные у разных семейств рыб.
Предполагают, что наиболее древний гормон — аргинин—вазотоцин;
из близкого к нему предкового гормона в ходе эволюции, очевидно, образовались
остальные нонапептидные гормоны с более специализированными эффектами.
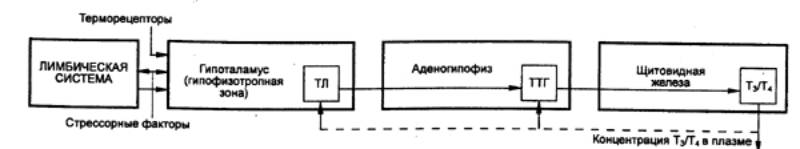
6.2.2. Гипоталамо—аденогипофизарная система
Основное назначение гипоталамо—аденогипофизарной
системы — осуществление связей между гипоталамусом и гипофизом. В 40—50—е гг. XX
столетия Г. Харрис обратил внимание на наличие системы воротного
кровоснабжения, связывающей гипоталамус с гипофизом. В дальнейшем были выяснены
функциональные связи между гипоталамусом и гипофизом. В мелких нейросекреторных
клетках гипоталамуса, располагающихся в так называемой гипофизотропной зоне,
происходит выработка либеринов и статинов, которые регулируют функцию
железистых клеток аденогипофиза. Аксоны нейросекреторных клеток оканчиваются в
медиальном возвышении, являющемся нейрогемальной областью гипоталамо—аденогипофизарной
системы.
Гормоны из гипофизотропной зоны поступают в
аденогипофиз через воротные вены гипофиза. Воротная (портальная) система
кровообращения начинается ветвями верхней гипофизарной артерии, которые
распадаются на мелкие капилляры. Возвратные ветви этих сосудов сливаются,
образуя воротные вены, которые несут кровь к капиллярному сплетению
аденогипофиза. Аксоны нейросекреторных клеток гипофизотропной зоны оканчиваются
на стенках этих сосудистых петель. Из капилляров гипофизотропные гормоны
попадают к своим мишеням — клеткам аденогипофиза, вырабатывающим гормоны (см.
рис. 6.3).
Функция железистых клеток гипофиза находится под
регулирующим влиянием в основном шести либеринов и трех статинов гипоталамуса
(табл. 6.2).
Свое название они получили от названий тех гормонов
гипофиза, выделение которых они регулируют. Так, гормон, влияющий на
тиреотропные клетки гипофиза, называют тиреотропин—рилизинг—гормоном
(ТРГ), или тиреолиберином. Все эти гормоны являются малыми пептидами.
Структура большинства гормонов расшифрована и осуществлен синтез ряда из них.
На основе рилизинг—гормона лютеинизирующего гормона
созданы различные синтетические аналоги люлиберина, отличающиеся более сильным
и длительным действием. Это имеет большое значение для дальнейшего изучения
физиологической роли этих веществ и находит применение в клинической медицине,
сельском хозяйстве, рыбоводстве.
В последние годы установлено, что некоторые из
гипофизотропных гормонов синтезируются не только в гипоталамусе, но и в других
отделах мозга и даже в других органах. Например, тиреолиберин у амфибий
образуется в коже и в плазме крови. У млекопитающих ТРГ обнаружен также в
таламусе, мозжечке и других структурах мозга. Множественную локализацию
биосинтеза имеет соматостатин, обнаруживаемый кроме гипоталамуса во
внегипоталамических областях мозга, а также в кишке и поджелудочной железе, где
он тоже выполняет роль фактора, тормозящего секрецию. Эти вещества обнаружены и
у ряда беспозвоночных животных.
Функциональная роль нейрорегуляторных пептидов в тех
случаях, когда они вырабатываются вне гипоталамуса, выяснена пока далеко не
полно. Возможно,
Т а б л и ц
а 6.2
Гипоталамические
пептиды— либерины и статины, действующие на аденогипофиз
|
Фактор |
Основные эффекты у
млекопитающих |
Регуляция секреции |
|
Кортиколиберин |
Стимулирует секрецию АКТГ |
Секреция стимулируется
стрессорными нервными сигналами и подавляется АКТГ |
|
Тиреолиберин |
Стимулирует секрецию ТТГ и
пролактина |
Секрецию усиливает низкая температура
тела и тормозят тиреоидные гормоны |
|
Соматолиберин |
Стимулирует секрецию СТГ |
Секрецию стимулирует
гипогликемия |
|
Люлиберин |
Стимулирует секрецию ФСГ и
ЛГ |
У самцов секреция
вызывается снижением концентрации тестостерона в крови, а у самок — нервными
сигналами и снижением концентрации эстрогенов. Высокая концентрация ЛГ или
ФСГ в крови подавляет секрецию |
|
Соматостатин |
Тормозит секрецию СТГ и
ТТГ |
Секреция вызывается
физической нагрузкой. Фактор быстро инактивируется в тканях тела |
|
Пролактостатин |
Тормозит секрецию
пролактина |
Секрецию стимулирует
высокая концентрация пролактина и подавляют эстрогены, тестостерон и нервные
сигналы при сосании |
|
Меланостатин |
Угнетает секрецию МСГ |
Секрецию стимулирует
мелатонин |
что в ряде случаев они являются нейротрансмиттерами.
Среди гормонов гипоталамуса найдены пептиды, обладающие морфиноподобным
действием. Энкефалины и эндорфины играют роль в регуляции
поведения. В гипоталамусе обнаружены и другие пептиды — субстанция Р, нейротензин,
ВИП (VIP, вазоактивный интестинальный (кишечный) пептид), бомбезин
и др. Часть из них ранее выделяли из кишки и считали гормонами, регулирующими
ее деятельность. В мозгу они регулируют обмен веществ, церебральный кровоток и
пищевое поведение.
В гипоталамусе, как и в других участках мозга,
постоянно синтезируются моноамины, являющиеся необходимым звеном нервных
и секреторных процессов.
Предполагают, что нонапептидные гормоны оказывают
непосредственное влияние на органы—мишени. Гипофизотропные олигопептиды, по—видимому,
возникли позже в эволюции в связи с развитием в системе нейрогормональной
регуляции эндокринной железы I порядка — гипофиза.
Гипофиз, или нижний мозговой придаток, является эндокринной
железой функции которой регулируются гипоталамическими гормонами.
Следовательно, это важный регуляторный центр, который объединяет нервный и
эндокринный компоненты координирующей системы организма (рис. 6.10, 6.11).
В
эмбриогенезе гипофиз образуется из двух различных зачатков. Из дна воронки
промежуточного мозга формируется нейрогипофиз, состоящий у высших
позвоночных из медиального возвышения, ножки, или стебля, и задней (нервной)
доли гипофиза. Железистая доля, или аденогипофиз, развивается из эпителиального
выпячивания крыши передней кишки (гипофизарный карман, или карман Ратке). В
процессе развития происходит объединение этих двух частей в единый орган. У
рыб, например, тяжи нейрогипофиза пронизывают железистую часть, образуя так
называемые корни нейрогипофиза. У млекопитающих задняя доля представляет собой
компактное образование, в котором
|
|
|
Рис. 6.10 Связь между нервными и эндокринными механизмами в гипоталамо—гипофизарной
системе |
|
|
|
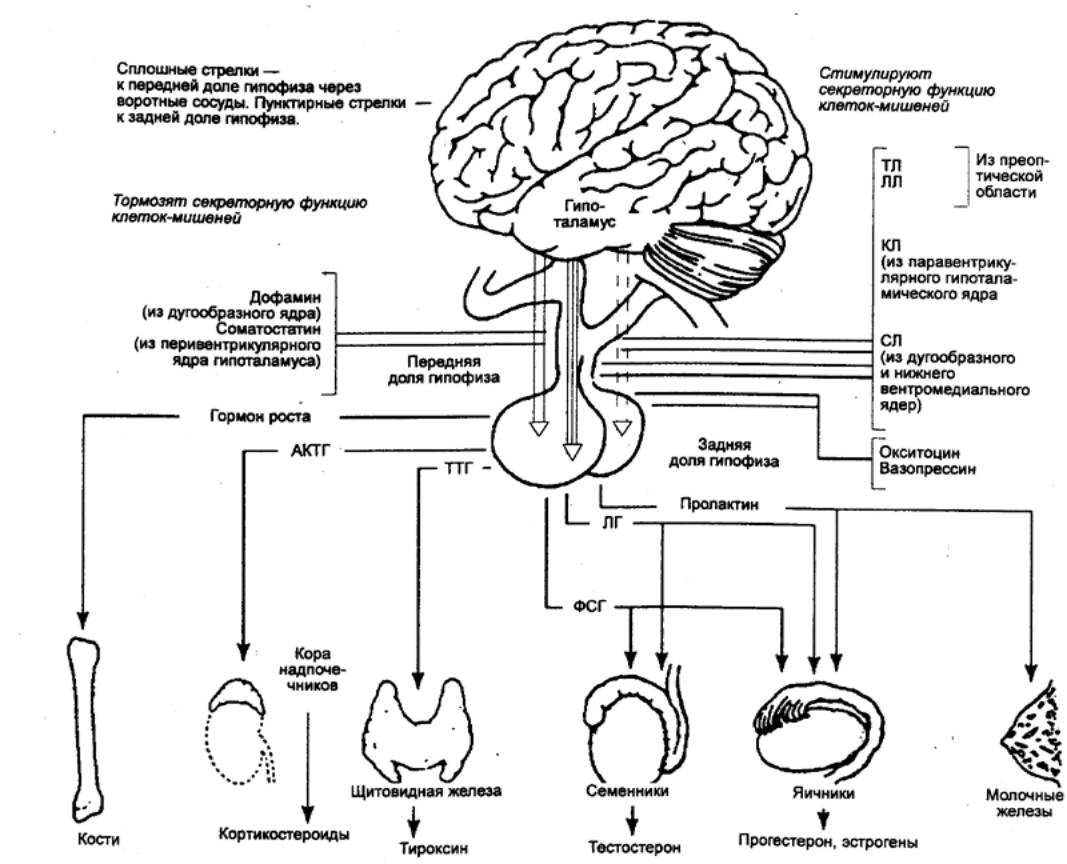
Рис. 6.11
Схема, показывающая, как
специфические группы клеток передней доли гипофиза с помощью гормонов
управляют определенными эндокринными органами, расположенными в разных частях
тела АКТГ —
адренокортикотропный гормон (кортикотропин); КЛ — кортиколиберин; ЛГ —
лютеинизирующий гормон;СЛ — соматолиберин; ЛЛ — люлиберин; ТЛ — тиреолиберин;
ТТГ — тиреотропный гормон; ФСГ — фолликулостимулирующий гормон. |
|
|
|
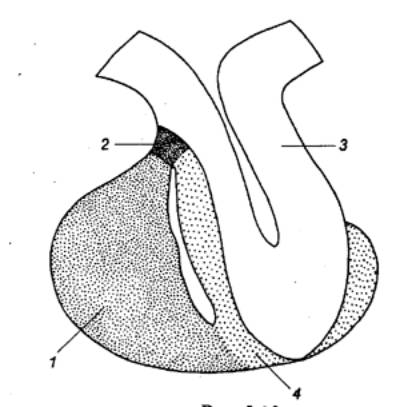
Рис. 6.12 Схема частей
гипофиза млекопитающих Аденогипофиз: 1 — дистальная часть, 2
— бугорная часть, 3 — нейрогипофиз, 4 — промежуточная часть. |
|
|
|
Рис.
6.13 Секреция гормона белковой
природы 1
— ядро, 2 — ядрышко, 3 — эндоплазматический ретикулум, 4 — комплекс Гольджи, 5 —
митохондрия, б — секреторная гранула, 7
— базальная мембрана, 8 —
эндотелий, стрелками обозначены пути поглощения материала для синтеза
гормона, транспорт синтезированного гормона, путь химической информации для
направления конечного синтеза от транскрипции ДНК к трансляции РНК. |
оканчиваются нейросекреторные волокна, отходящие в
основном от клеток супраоптического и паравентрикулярного ядер и содержащие
окситоцин и вазопрессин.
Гомолог гипофиза (по происхождению) существует уже у хордовых
животных. Это субнейральная железа оболочников, однако неясно, каково ее
функциональное значение. Наиболее древние позвоночные животные — круглоротые
(миноги, миксины) — имеют гипофиз примитивного строения, но в нем уже
вырабатывается большая часть гормонов, характерных для этой железы.
В аденогипофизе различают дистальную, или переднюю,
часть, и промежуточную часть. У большинства млекопитающих промежуточная доля
слабо развита, а у птиц вообще отсутствует. Эта часть аденогипофиза значительно
развита у низших позвоночных. У ряда позвоночных, в том числе и у
млекопитающих, существует еще бугорная (тубералъная) часть (рис. 6.12).
В гипофизе большинства позвоночных и человека вырабатываются гормоны нескольких
семейств. Все они обладают метаболическими и пролиферативными эффектами на
уровне периферических желез и других структур.
При удалении гипофиза в организме развиваются симптомы
гормональной недостаточности, так как гормоны аденогипофиза в этом
случае не оказывают стимулирующего влияния на ряд эндокринных желез и функций.
В аденогипофизе существуют различные типы клеток,
каждый из которых вырабатывает соответствующий гормон. С помощью
гистологических и гистохимических методов обычно выделяют ацидофильные,
базофильные (или цианофильные) и хромофобные клетки. Применение дополнительных
методик позволяет провести их последующее подразделение. Ацидофильные клетки
вырабатывают гормон роста и пролактин, базофильные клетки —
гонадотропины и тиреотропин, хромофобные клетки, по—видимому, являются
предшественниками ацидофильных и базофильных клеток.
В последние годы широкое применение нашли иммунохимические
методы, при использовании которых происходит реакция с антисывороткой к
соответствующему известному гормону. Таким образом, в настоящее время
идентифицированы места синтеза всех гормонов аденогипофиза.
Номенклатура
типов клеток аденогипофиза зависит
от того, какой гормон они вырабатывают. Так, клетка, вырабатывающая
гонадотропный гормон, называется гонадотропоцитом, клетка, синтезирующая
пролактин, — пролактотропоцитом и т. д.
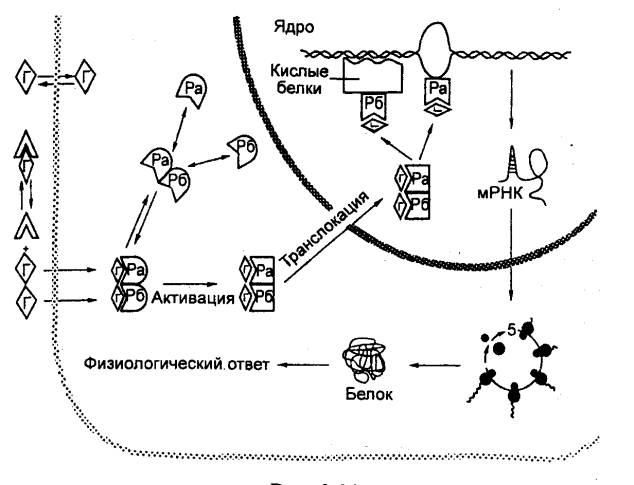
Образование и выделение
гормонов в железистой клетке гипофиза происходит следующим образом. Из
капилляров путем микропиноцитоза в клетку проникают вещества, необходимые для
синтеза секреторных продуктов. В цитоплазме синтезируются протеины, поступающие
в эндоплазматическую сеть, от которой отделяются пузырьки, поступающие в
аппарат Гольджи, где происходит конечный синтез секреторного продукта.
Созревшие секреторные гранулы поступают в межклеточное пространство (рис.
6.13).
Тропные гормоны аденогипофиза. Четыре гормона из семи (табл. 6.3) оказывают
регулирующее влияние на периферические эндокринные железы, поэтому
Таблица 6.3
Тропные гормоны аденогипофиза
|
Гормон |
Химическая
природа |
Ткань—мишень |
Главные
эффекты у млекопитающих |
Регуляция
секреции |
|
Адренокортикотропный
гормон (АКТГ) |
Пептид
п=39 |
Кора
надпочечников |
Стимулирует
синтез и секрецию стероидов корой надпочечников |
Стимулируется
кортикоколиберином |
|
Тиреотропный
гормон (ТТГ) |
Гликопротеин |
Щитовидная
железа |
Усиливает
синтез и секрецию тиреоидных гормонов |
Стимулируется
тирелиберином и подавляется тиреоидными |
|
Гормон
роста (СТГ) |
Полипептид |
Все
ткани |
(См.
табл. 6.4) |
|
|
Фолликулостимулирующий
гормон (ФСГ) |
Гликопротеин |
Семенные
канальцы у самцов, фолликулы яичников у самок |
У
самцов повышает образование спермы, у самок стимулирует созревание фолликулов |
Стимулируется
люлиберином и подавляется ингибином |
|
Лютеинизирующий
гормон (ЛГ) |
Гликопротеин |
Интерстициальные клетки
семенников (у самцов) и яичников (у самок) |
Вызывает
окончательное созревание фолликулов, секрецию эстрогенов, овуляцию,
образование желтых тел, секрецию прогестерона у самок; усиливает синтез и секрецию андрогенов у самцов |
Стимулируется
люлиберином |
|
Пролактин |
Полипептид п=198 |
Молочная
железа (альвеолярные клетки) |
Стимулирует синтез белков
молока и развитие молочных желез; пробуждает родительский инстинкт у самок |
Находится
под посто янным тормозящим действием гипотала мического
фактора (пролактостатина); она становится возможной при повышенной
концентрации эстрогенов и пониженной секреции пролактостатина |
|
α—Меланоцитстимулирующий
гормон (α—МСГ) |
Олигопептид
п=13 |
Пигментные
клетки |
Повышает
синтез меланина в меланоцитах и увеличивает размеры меланофоров (вызывает
потемнение кожи) |
Подавляется
гипоталамическим факторам (меланостатином) |
частично их функции будут рассмотрены
в соответствующих разделах, посвященных их органам—мишеням — корковому веществу
надпочечников, щитовидной железе и гонадам.
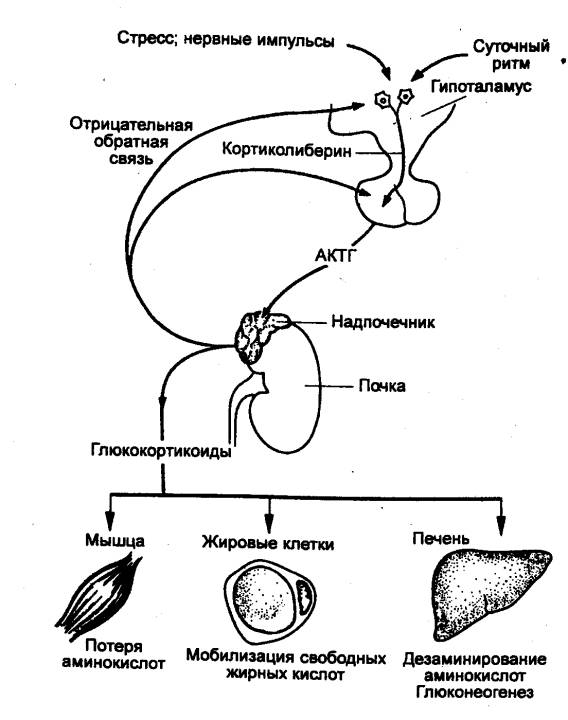
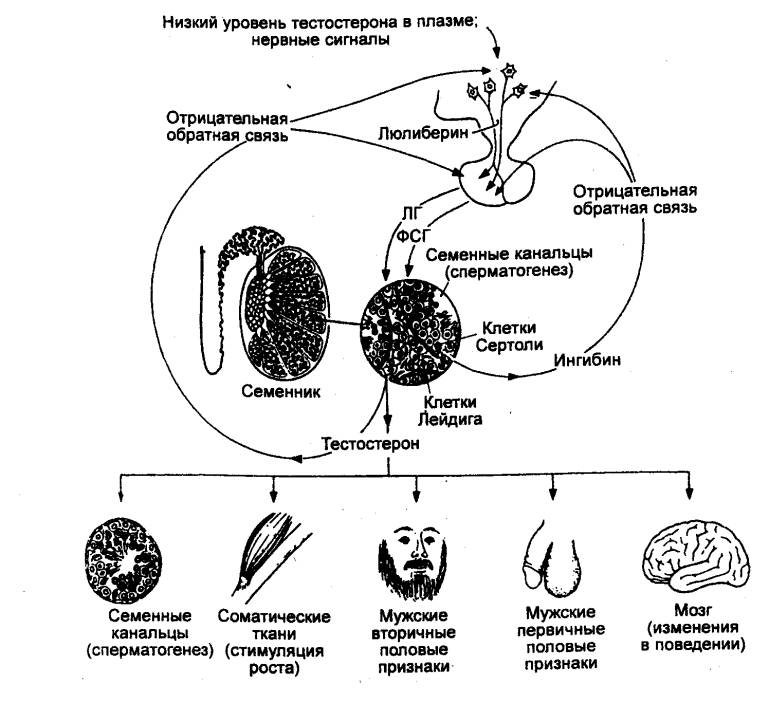
Адренокортикотропный гормон (АКТГ, кортикотпропин) необходим для развития и
секреции коры надпочечника (в основном двух ее слоев — пучковой и сетчатой
зон). АКТГ стимулирует выработку и секрецию глюкокортикоидов. Для роста и
функции третьего слоя коры надпочечника — клубочковой зоны — не требуется
влияния АКТГ. В этой зоне вырабатываются минералокортикоиды, и эти процессы регулируются
другим путем (см. разд. 6.3.2). В отсутствие АКТГ кора надпочечников
подвергается атрофии.
АКТГ представляет собой полипептид из 39
аминокислотных остатков. Осуществлен синтез этого гормона. АКТГ не обладает
значительной видоспецифичностью. Концентрация гормона в крови в обычных
условиях невысока (0—5 нг/мл), причем наблюдается четкая циркадная ритмика в
его секреции. При стрессе уже через несколько минут увеличивается скорость
секреции АКТГ и его содержание в крови. АКТГ непосредственно действует также и
на другие органы—мишени. В частности, установлено прямое влияние АКТГ на
липолиз в жировой ткани, на функции иммунокомпетентных клеток и органов,
нервной системы. Один из фрагментов АКТГ обладает инсулотропным эффектом.
Синтез и секреция АКТГ регулируются кортикотропин—рилизинг—гормоном
гипоталамуса; гормоны коры надпочечника на основании механизма обратной связи
также включаются в регуляцию секреции АКТГ.
Тиреотропный гормон (тиреотропин, ТТГ) является гликопротеином,
состоящим из двух субъединиц: α и β β—субъединица определяет
специфическую биологическую активность гормона, α—субъединица сходна в ТТГ
и гонадотропинах. Тиреотропин стимулирует рост и развитие щитовидной железы,
регулирует выработку и выделение ее гормонов — тироксина (Т4) и трийодтиронина
(Т3). Тиреотропин, циркулирующий в плазме, связан с γ—глобулином.
Метаболизируется ТТГ главным образом в почках. Функция тиреотропоцитов
регулируется тиролиберином гипоталамуса. Как и в других случаях, гормоны
щитовидной железы также входят в цепи регуляции секреции ТТГ.
Гонадотпропные гормоны у высших позвоночных
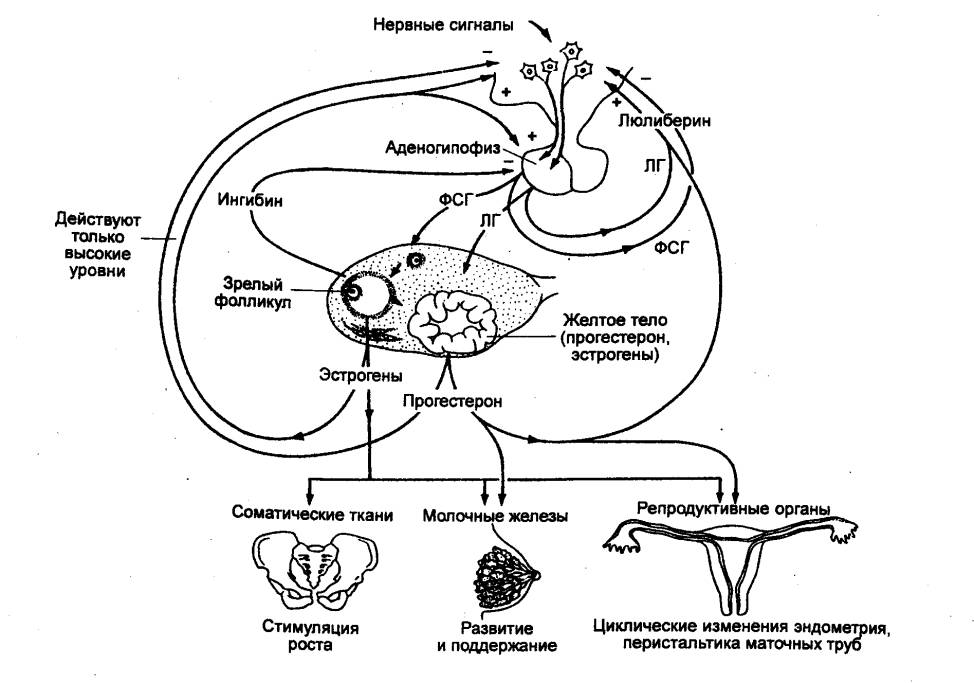
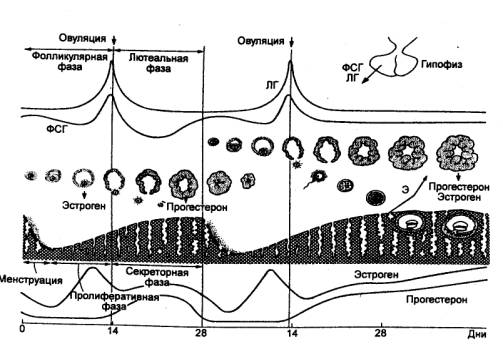
представлены двумя гормонами с несколько различающейся сферой действия. Фолликулостимулирующий
гормон (ФСГ) у самок стимулирует развитие фолликулов в яичниках, самцам
этот гормон необходим для развития семенных канальцев и дифференциации
сперматозоидов. Лютеинизирующий гормон (лютеотропин, ЛГ) участвует в
овуляции, образований желтого тела, стимулирует секрецию половых гормонов
стероидогенной тканью яичников и семенников. Однако многие этапы развития,
созревания половых клеток, овуляции и спермиогенеза являются результатом
синергического действия ФСГ и ЛГ. У низших позвоночных выделяемые гонадотропные
гормоны по сфере действия отличаются от ФСГ и ЛГ.
Введение гипофизэктомированным животным гонадотропинов
вызывает возобновление развития атрофированных гонад и развитие вторичных
половых признаков.
Следовательно, основными эффектами гонадотропинов
являются стимуляция развития и созревания половых клеток, стимуляция
гаметогенеза, овуляции и стероидогенеза. ФСГ и ЛГ самцов идентичны этим
гормонам у самок, т. е. эти гормоны не обладают половой специфичностью.
Оба гормона являются гликопротеинами и состоят из двух
субъединиц — α и β, как и ТТГ. Гонадотропины различных животных
несколько различаются между собой по структуре, в результате чего
обнаруживается их таксономическая
специфичность. При этом введение гонадотропинов от животных одних классов не
оказывает (или оказывает лишь частичное) воздействие на репродуктивную функцию
других животных. Это зависит, по—видимому, также от специфичности рецепторов
гормонов в гонадах.
Так, гонадотропины гипофиза
рыб почти не оказывают влияния на гонады млекопитающих. ЛГ млекопитающих имеет
ограниченное влияние на функцию гонад рыб. Секреция ФСГ и ЛГ, очевидно, регулируется
одним гонадолиберином — ЛГ—РГ (люлиберином). В состав регулирующей системы
входят также половые стероиды и некоторые пептиды. Секреция ЛГ—РГ, в свою
очередь, контролируется гормонами периферических желез—мишеней и медиаторами
ЦНС.
Эффекторные гормоны
аденогипофиза. Эти гормоны оказывают
стимулирующее влияние на неэндокринные органы— и ткани—мишени. К этой группе
относится три гормона: гормон роста, пролактин и меланоцитстимулирующий гормон.
Гормон роста (ГР, соматотропный
гормон, СТГ, соматотропин) —
полипептид. У человека он состоит из 191 аминокислотного остатка. Соматотропин
отличается высокой видоспецифичностью, поэтому при необходимости замещающей
терапии должен вводиться гормон того же вида. ГР имеет ряд эффектов, он
стимулирует общий рост тканей, кроме того, имеет ряд метаболических эффектов.
Мишенями для ГР являются кости скелета и печень.
ГР стимулирует
эндохондральное окостенение — процесс, посредством которого кости растут в
длину. В связи с этим для биотестирования ГР использовали изменения ширины
эпифизарного хряща большеберцовой кости гипофизэктомированных крыс (тибиатест).
С появлением радиоиммунологических методов производят количественное
определение ГР, как и других гормонов.
После полового созревания
происходит окостенение эпифизарных хрящей, и ГР перестает влиять на рост костей
в длину, он способен усиливать лишь периостальный рост кости и рост некоторых
тканей. Когда у взрослых людей происходит чрезмерная выработка гормона роста, у
них наблюдаются разрастание мягких тканей, деформация и увеличение размеров
кистей, стоп, нижней челюсти, внутренних органов. Это заболевание называется акромегалией (от греч. akros —
крайний и megas, megalu — большой). Если ГР
вырабатывается в избытке в молодом возрасте, когда кости еще способны расти в
длину, развивается гигантизм. Напротив, при недостаточности ГР у ребенка
рост прекращается по достижении 1 м. При такой гипофизарной карликовости
пропорции тела нормальны.
Недавно показано, что эффект
ГР, обеспечивающий рост, опосредуется рядом факторов роста в костях и печени,
вырабатываемых под влиянием ГР.
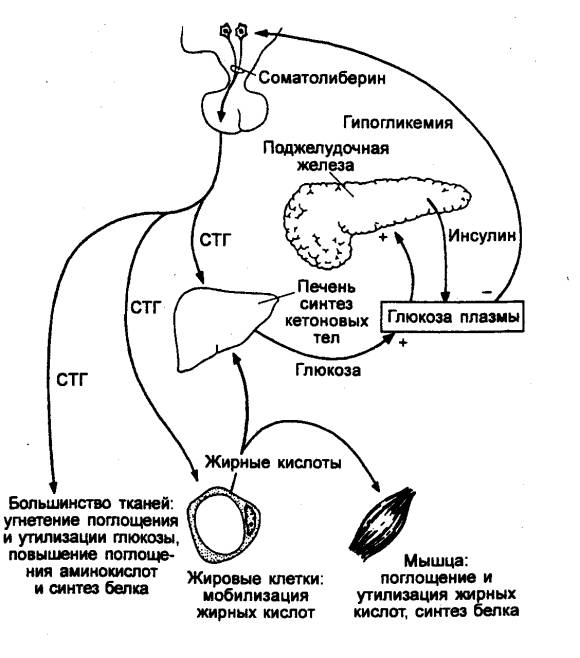
Метаболические эффекты ГР многообразны. Весьма важно влияние ГР на белковый
обмен и прежде всего усиление им синтеза белков. Гормон обладает
анаболитическим действием и оказывает также влияние на обмен жиров и углеводов.
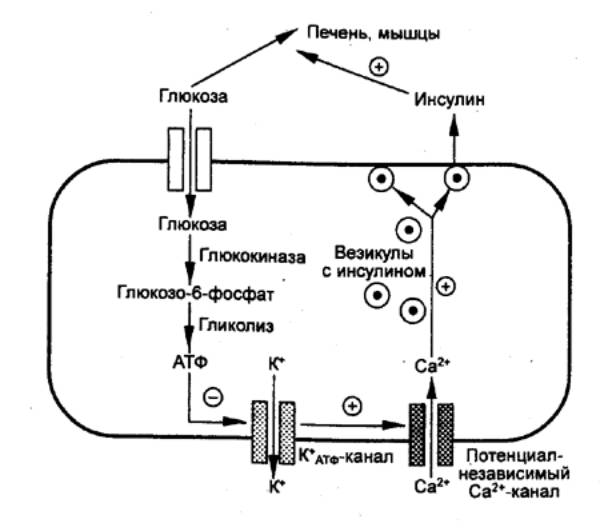
Инъекция ГР вызывает падение уровней глюкозы и свободных жирных кислот в
плазме, а через несколько часов отмечается их увеличение . Это происходит
потому, что проникновение глюкозы в клетки, в обычных условиях усиливаемое
инсулином, нарушается, т. е. толерантность к глюкозе, обеспечиваемая инсулином,
снижается под влиянием ГР. Повышение концентрации глюкозы происходит в
результате увеличения скорости глюконеогенеза под влиянием ГР.
В течение суток наблюдаются
колебания концентрации ГР в 10—20 раз, которые связаны с эндогенным ритмом
секреции гормона. Максимум секреции ГР отмечается у человека ночью и связан с
фазой глубокого сна.
Секреция ГР регулируется соматолиберином и соматостатином.
Уровень ГР зависит от соотношения выработки этих двух гипоталамических
гормонов, которая, очевидно, регулируется высшими центрами мозга,
расположенными в области лимбической системы.
На секрецию ГР оказывает влияние содержание
энергетических субстратов в клетках и тканях. Снижение концентрации глюкозы в
крови стимулирует секрецию ГР через гипоталамические рецепторы глюкозы.
Секреция ГР зависит также от концентрации в крови аминокислот и свободных
жирных кислот. Кроме того, секреция ГР усиливается стрессорными стимулами
различного характера. Возможно, что это влияние опосредуется центральными
адренергическими структурами.
Пролактин (ПРЛ) — полипептид, состоящий из 198 остатков аминокислот. У
млекопитающих ПРЛ стимулирует рост молочных желез и секрецию молока. ПРЛ стимулирует
синтез белков молока и других его компонентов, а также ускоряет молокоотдачу.
Его содержание в крови увеличивается во время акта сосания или при доении под
влиянием окситоцина.
У ряда видов млекопитающих (но не у всех) пролактин
оказывает также влияние на поддержание существования желтого тела и на
активность этого образования. В связи с этим возникло второе название этого
гормона — лютеинизирующий гормон (ЛГ). Этот гормон тормозит секрецию
ФСГ, у самцов вызывает рост предстательной железы, семенных пузырьков, секрецию
семенной жидкости, т. е. вовлекается в регуляцию репродуктивной функции.
Пролактин обладает также метаболическим действием, участвуя в регуляции
жирового обмена, и оказывает гипергликемический (диабетогенный) эффект.
Пролактин (или пролактиноподобный гормон у низших
позвоночных) вырабатывается в гипофизе всех позвоночных, за исключением
круглоротых. Эффекты ПРЛ весьма многообразны и могут быть сгруппированы в
четыре основных направления.
1.
Влияние на водно—солевой обмен, минеральный обмен и осморегуляцию. У ряда видов
рыб ПРЛ необходим для жизни в пресной воде. После гипофизэктомии рыбы гибнут,
однако они выживают, если им вводить ПРЛ. Часть рыб выживает без гипофиза в
пресной воде, но в этом случае наблюдаются нарушения водно—минерального обмена.
Показано, что ПРЛ оказывает влияние на проницаемость мембран для воды, снижает
отдачу ионов Na+.
2.
Влияние на пролиферацию и секрецию клеток эктодермы. Эти эффекты обнаруживаются
у всех позвоночных, начиная с рыб. У птиц ПРЛ влияет на образование «зобного
молочка», нужного для выкармливания птенцов, влияет на рост перьев и т. д.
3.
Участие у позвоночных разных классов в регуляции репродуктивного поведения. Это
прежде всего забота о потомстве. Здесь ПРЛ выступает в качестве синергиста
половых гормонов. Переход в водную среду для размножения у ряда амфибий также
регулируется пролактином.
4. Существенное влияние на жировой обмен, а у ряда
низших позвоночных — и на рост.
Таким
образом, для ПРЛ характерен чрезвычайно широкий спектр действия, причем его
эффекты наиболее разнообразны у низших позвоночных. Очевидно, это весьма
древний гормон, функции которого постепенно видоизменялись и
специализировались; при появлении млекопитающих ПРЛ стал гормоном, специально
регулирующим молочную железу. Однако многие эффекты гормона остались общими —
влияние на жировой обмен, водный обмен, репродуктивные функции.
Пролактиноподобный гормон низших позвоночных по структуре несколько отличается от пролактина млекопитающих; введение его
высшим позвоночным почти не оказывает эффекта. По—видимому, ПРЛ и ГР возникли
из одного предшественника, так как эти гормоны близки по структуре, а также
имеют и ряд общих эффектов. Гормон, ингибирующий выведение пролактина (ПРЛ—ИГ,
пролактостатин), вырабатывается в гипоталамусе. Согласно последним данным, он
является дофамином. Кроме того, существует и рилизинг—гормон (ПРЛ—РГ,
пролактолиберин). На секрецию ПРЛ, усиливая ее (возможно, через гипоталамус),
также влияют стероиды и окситоцин. Секреция пролактина зависит и от
продолжительности фотопериода, времени суток.
Меланоцитстимулирующий гормон (МСГ, меланотропин) существует в двух формах — α— и β—МСГ,
которые являются полипептидами и весьма близки по структуре к АКТГ. α—форма
МСГ человека содержит 13 аминокислотных остатков, β—форма — 22. Регуляция
функции клеток промежуточной доли гипофиза, вырабатывающих МСГ, осуществляется
гипоталамическими либеринами МСГ—РГ и статинами МСГ—ИГ.
Основная функция МСГ заключается в стимуляции биосинтеза
кожного пигмента меланина, а также увеличении размеров и количества пигментных
клеток. Действие МСГ у рыб, амфибий и пресмыкающихся состоит в увеличении
пигментации кожи за счет дисперсии меланина в пигментных клетках (меланофорах
или меланоцитах). Изменение окраски кожных покровов имеет существенное защитное
значение, так как животное может иметь окраску, близкую к цвету окружающей
среды. У млекопитающих МСГ участвует в сезонных изменениях пигментации кожи и
меха; этот гормон может влиять и на возбудимость нервной системы, участвовать в
генезе положительных эмоций. Поскольку меланин является антиоксидантом,
подавляющим перекисное окисление липидов, МСГ можно считать гормоном—протектором,
защищающим нейроны от перевозбуждения и повреждения активными метаболитами
кислорода.
Все гормоны гипофиза оказывают позитивное воздействие
на рост, дифференцировку, иммунную активность иммунокомпетентных клеток и
органов.
У млекопитающих шишковидное тело (верхний придаток
мозга, эпифиз, пинеальная железа) являются частью эпиталамуса. Оно расположено
дорсолатеральнее шишковидного углубления стенки III желудочка и на спайке
поводков «подвешено» между краниальными холмиками пластинки крыши. От черепа
его отделяет затылочный венозный синус. Железа покрыта соединительнотканной
оболочкой, внутрь от которой отходят трабекулы, придающие ей дольчатое
строение. Клеточный состав железы представлен пинеалоцитами — основными
секреторными клетками стромы, опорными клетками, редкими нейронами и
нейроглией. Выделяемые железой вещества могут секретироваться в кровь или
ликвор III желудочка, оказывая действие на перивентрикулярные ядра гипоталамуса
и других структур головного мозга через ликвор и мозговой кровоток. Кроме того,
вещества шишковидного тела опосредованно через ЦНС и системный кровоток
оказывают действие на периферические органы—мишени, которыми являются многие
эндокринные железы.
Значительная роль в регуляции функции шишковидного
тела отводится симпатической нервной системе, иннервирующей железу, гипофиз,
сосуды, оболочки мозга и т. д. Паравентрикулярные и супрахиазматические ядра
гипоталамуса также участвуют в иннервации шишковидного тела. Все эти структуры
обладают свето— и магниточувствительностью, олигосинаптически и гормонально они
взаимосвязаны друг с другом. Ядра гипоталамуса, активируемые светом, и
структуры эпифиза, секреция которого усиливается в темноте, рассматриваются как
компоненты экстраокулярной (внеглазной) фотонейроэндокринной системы,
контролирующей уровень гормонов в плазме крови и соответствующие функции в
зависимости от времени суток и сезона года.
Гормоны шишковидного тела представлены в основном
индоламинами, пептидами и белками. Среди индоламинов, производных триптофана,
наиболее известны серотонин и мелатонин, которые могут секретироваться и в
других тканях и органах. Одним из основных регуляторов их синтеза является
норадреналин — медиатор симпатических терминалей и гормон надпочечников.
Выделяясь в ликвор III желудочка, серотонин действует
на гипоталамо—гипофизарную систему в условиях стресса, где увеличивает секрецию
соматотропина, кортикотропина и пролактина, запускающих защитные реакции
организма, и подавляет выход в кровь гонадотропинов и тиреотропина. Серотонин
увеличивает секрецию тормозного медиатора ГАМК, что оказывает сомногенный
эффект. Помимо того, гормон непосредственно влияет на активацию иммунной
системы, облегчая течение воспалительных реакций. Серотонин может соединяться с
гемоглобином, препятствуя диссоциации его молекулы под влиянием ультрафиолета.
Второй основной гормон шишковидного тела — мелатонин,
также регулирует функции железосодержащего металлопротеина — пигмента меланина.
Гормон увеличивает агрегацию меланоцитосом в радужке глаза и эпителии кожи.
Таким образом, в темное время года увеличение секреции мелатонина вызывает
побледнение кожных покровов, что важно для поддержания определенного уровня
синтеза в коже «солнечного» гормона — витамина А. В радужной оболочке глаза
эпифизарный и локально синтезируемый в сетчатке мелатонин повышает
светочувствительность фоторецепторов. Эти эффекты гормона противоположны
действию меланотропина гипофиза, секреция которого растет с увеличением
продолжительности светового дня.
Ключевым эффектом мелатонина на гипоталамическом уровне
является снижение метаболизма в светочувствительных нейронах
супрахиазматических ядер, иннервирующих и активирующих все центры
нейроэндокринного гипоталамуса. Это во многом определяет функциональное
взаимодействие между эпифизом и гипоталамо—гипофизарной системой. Кроме того,
гормон подавляет секрецию гонадолиберина и окситоцина и активирует секрецию
соматостатина. Наряду с прямым подавлением синтеза половых стероидных гормонов
в гонадах, это приводит соответственно к блоку гаметогенеза и роста, в том числе
недифференцированного (онкогенеза). Участие мелатонина в регуляции функций
иммунной системы проявляется в активации ее онкостатических функций, а также
подавлении первичных проявлений заболеваний, вызванных вирусом иммунодефицита
человека (ВИЧ).
Группа пептидов и белков шишковидного тела регулирует
репродуктивные функции посредством контроля секреции гонадотропинов гипофиза и
половых стероидов гонад. Гонад отропин, гонад олиберин и антигонадотропины
шишковидного тела оказывают на репродуктивную систему реципрокное действие.
Как и комплекс гормонов гипоталамо—гипофизарной
системы, гормоны эпифиза оказывают воздействие на метаболизм и процессы роста
рядом расположенных структур ЦНС, а также на периферические эндокринные железы.
Специфика защитных реакций, запускаемых и регулируемых гормонами шишковидного
тела, обусловлена их доминированием в темное время суток и года. Большая
скорость кровотока в железе и ее перивентрикулярное расположение, наличие
лимбических, обонятельных, гипоталамических, стволовых и симпатических входов,
чувствительность к периодическим изменениям магнитного поля и освещенности
свидетельствуют о ключевой роли эпифизарных гормонов в суточной и сезонной
регуляции функции ЦНС и многих периферических систем организма.
В целом церебральные эндокринные системы — гипоталамо—гипофизарную
и эпифиз можно рассматривать как экстраокулярную фотонейроэндокринную систему.
Надо заметить, что в сетчатке ганглиозные «выходные» нейроны различаются по
организации рецептивных полей. Как остроумно заметил кто—то из исследователей,
один тип рецепторного поля («on—») по центру активируется
светом, другой — «засвечивается» темнотой («off—»). Строго говоря,
гипоталамо—гипофизарная система и эпифиз представляют собой аналогичные, но
вынесенные за пределы сетчатки структуры. Прямая (для супрахиазматических ядер)
и опосредованная (для шишковидного тела) связь с сетчаткой позволяет комплексно
оценивать уровень освещенности экстраокулярной системой и локальные перепады
интенсивности светового потока. Выход на нейрональные и гормональные эффекты
окулярной и экстраокулярных систем мозга позволяет сочетать быстрые и
длительные ответные реакции организма в наиболее адаптивном режиме.
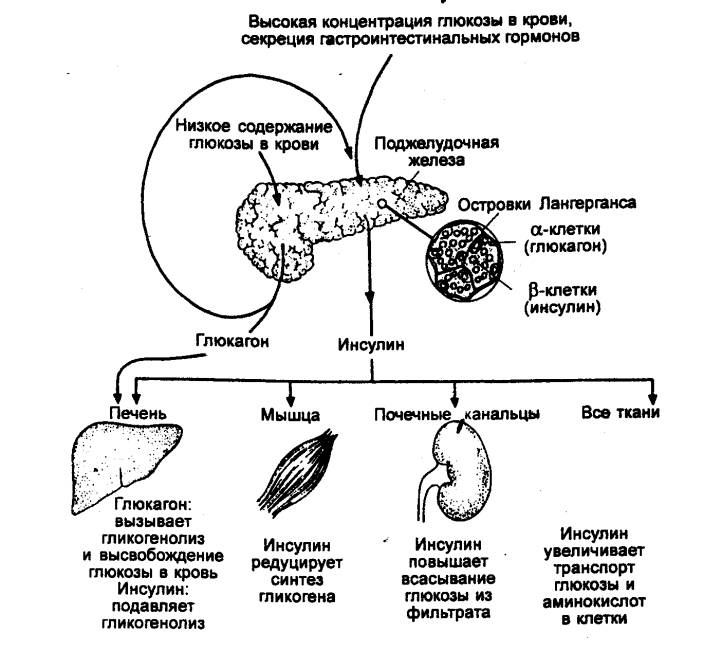
6.3. ПЕРИФЕРИЧЕСКИЕ
ЭНДОКРИННЫЕ ЖЕЛЕЗЫ
Действие гормонов
аденогипофиза (см. разд. 6.2) состоит в основном в регуляции выработки гормонов
других эндокринных желез, функция которых тесно связана с деятельностью
гипоталамо—гипофизарной системы. Тиреотропин аденогипофиза стимулирует
выработку тиреоидных гормонов в щитовидной железе, кортикотропин влияет на
секрецию глюкокортикоидов корой надпочечника, а гонадотропины приводят к
выработке половых гормонов стероидогенной тканью гонад. В коре надпочечника
синтезируются также минералокортикоиды (альдостерон), некоторые андрогены, а в
мозговом веществе надпочечника — катехоламины.
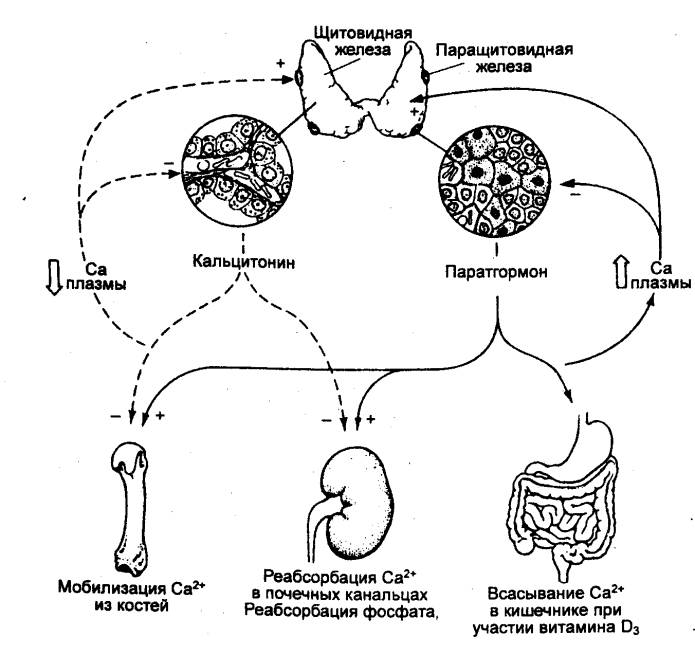
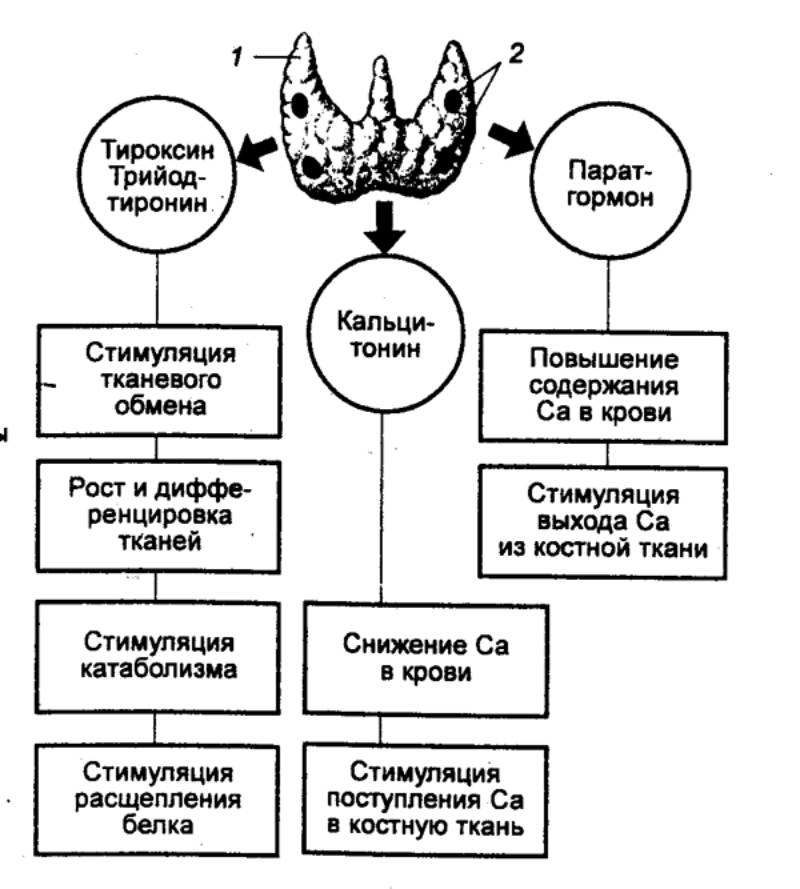
6.3.1. Щитовидная железа и
паращитовидные железы
Щитовидная железа образуется из выпячивания на вентральной
стенке глотки между I и II жаберными карманами. Две пары паращитовидных желез
имеют сходное происхождение и локализованы на дорсальной поверхности щитовидной
железы. Их некоторые гормоны функционально взаимосвязаны. Основной особенностью
щитовидной железы, имеющейся у всех позвоночных, является способность эпителия
ее фолликулов поглощать йод из окружающей среды и в комбинации с аминокислотой
тирозином синтезировать йод—содержащие тиреоидные гормоны: три— и
тетрайодтиронины.
У многих представителей беспозвоночных (моллюски,
черви и др.) также существуют структуры, способные к синтезу йод—содержащих
факторов. У хордовых животных (ланцетник и др.) на вентральной стенке глотки
существует желобок, называемый эндостилем. Его клетки наряду с
выполнением пищеварительной функции способны поглощать йод и синтезировать
тироксин Т4 и трийодтиронин Т3, которые поступают в кишечник, а затем
разносятся кровью по всему организму. Следовательно, эндостиль является железой
с экзокринной секрецией.
Основной структурной и функциональной единицей
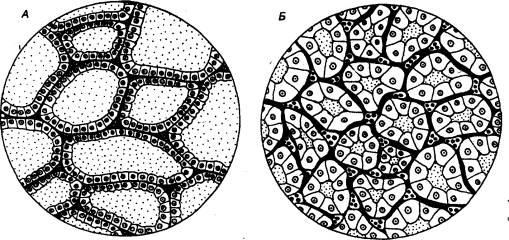
щитовидной железы является фолликул (рис. 6.14). Стенка фолликула
образована тиреоидным
|
|
|
Рис. 6.14 Фолликулы щитовидной железы крысы при
неактивном (А) и активном (Б)
состояниях железы А — эпителий
плоский, фолликулы содержат много коллоида, Б — тиреоидный эпителий высокий, в полости фолликулов мало
коллоида. |
эпителием,
в полости фолликула находится коллоид, в котором образуются тиреоидные гормоны.
Фолликулы окружены соединительной тканью с кровеносными сосудами. Щитовидная
железа обильно снабжается кровью; по капиллярам поступают компоненты,
необходимые для образования гормонов, и выводятся синтезированные гормоны.
У ряда низших позвоночных (круглоротые, костистые
рыбы) группы фолликулов лежат разрозненно, и щитовидная железа имеет диффузный
характер. В ходе дальнейшей эволюции у других групп рыб и у наземных
позвоночных щитовидная железа становится более компактной. У млекопитающих она
состоит обычно из двух долей, соединенных перешейком, и локализована в области
трахеи. Кроме фолликулов в щитовидной железе млекопитающих обнаружены так
называемые парафолликулярные, светлые или С—клетки, вырабатывающие калъцитонин
(или тиреокальцитонин). Эти клетки по эмбриональному происхождению
отличаются от тиреоидных (тиреоцитов) и у других позвоночных входят в состав ультимобранхиальных
телец (зажаберных телец)—скоплений эпителиальных клеток глотки. В связи с
этим функции кальцитонина будут рассмотрены отдельно.
Основная особенность клеток щитовидной железы. Это способность щитовидной железы активно извлекать
йод из плазмы крови против химического и электрического градиентов, накапливать
его и преобразовывать в органически связанный йод и физиологически активные
тиреоидные гормоны. Пути биосинтеза тиреоидных гормонов у всех позвоночных
сходны. В щитовидной железе под действием тиреотропного гормона вырабатываются
два гормона: тетрайодтиронин (тироксин, Т4) и трийодтиронин (Т3).
Трийодтиронин вырабатывается в меньших количествах, чем тетрайодтиронин, но
значительно превосходит его по активности.
Отличительной особенностью тиреоидных гормонов является
содержание йода; Йод поступает в основном с пищей и водой. Т4 содержит четыре
атома йода, связанных с тирониновым ядром, Т3 — три атома. Компоненты
образования тиреоидных гормонов соединяются с гликопротеином — тиреоглобулином
— и поступают в коллоид в полости фолликула. При поступлении в кровь путем
протеолиза Т3 и Т4 отщепляются от тиреоглобулина, но в плазме они вновь
соединяются с тироксинсвязывающим глобулином и лишь небольшая часть Т3 и Т4
остается в крови в активном состоянии. Степень стимулирующего эффекта тироксина
зависит, как правило, от уровня свободного тироксина. Основные данные о синтезе
тиреоидных гормонов и их функциях получены в работах с использованием
радиоактивного изотопа 131J в
качестве метки.
Действие
гормонов щитовидной железы.
Трийодтиронин и тетрайодтиронин обладают примерно одинаковым действием, но
активность Т3 почти в пять раз выше, чем Т4. Эффекты Т4 развиваются через более
длительный латентный период; он может превращаться в организме в Т3 путем
дейодирования. В связи с этим предполагают, что Т4 может являться прогормоном.
Тиреоидные гормоны имеют
широкий спектр действия (табл. 6.4). Их основные эффекты состоят во влиянии на
различные обменные процессы, рост и развитие, они участвуют также в адаптивных
реакциях (рис. 6.15).
|
Таблица 6.4 Гормоны, регулирующие энергетический обмен
|
|
|
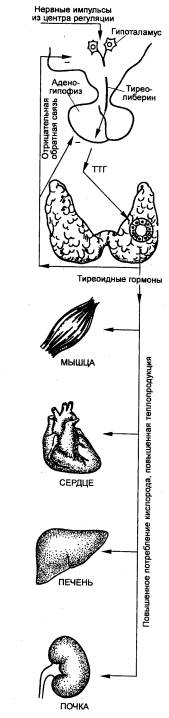
Рис. 6.15 Связи щитовидной
железы у млекопитающих Фолликул на рисунке щитовидной железы изображен в непропорционально
крупном масштабе. |
Наиболее выражено влияние Т3
и Т4 на энергетический обмен. В отсутствие тиреоидных гормонов скорость
обменных процессов снижается; при их избытке основной обмен в покое может
повышаться почти вдвое по сравнению с нормой. Калоригенный эффект наиболее
четко выражен у высших позвоночных и проявляется во всех клетках растущего
организма, но особенно в клетках нервной системы.
Гормоны действуют путем индукции синтеза ферментов, Na, К—АТФазы
и активации митохондриальных энзимов дыхательного цикла, что увеличивает синтез
белка и окисление жиров и углеводов. Таким образом, тиреоидные гормоны
действуют на разные стороны обмена веществ. У различных животных четко доказана
их роль в регуляции минерального обмена. Так, тироксин способствует сохранению
градиента электролитов между вне— и внутриклеточной средой. Показана роль
тиреоидных гормонов в обмене кальция и магния.
Действие Т3 и Т4 состоит также в повышении
чувствительности тканей к катехоламинам; они усиливают гликогенолитическое и
гипергликемическое действие катехоламинов. На ряд процессов тиреоидные гормоны
оказывают сенсибилизирующее или пермиссивное действие. Т3 и Т4 участвуют в
регуляции выделения глюкокортикоидов надпочечниками, гормона роста
аденогипофизом.
Тироксин стимулирует общий рост тела, поэтому его недостаток
может привести к карликовости. Роль тиреоидных гормонов наиболее четко
прослеживается у молодых животных. Недостаток этих гормонов сопровождается
нарушением состояния нервной системы, задержкой роста и развития. У человека
при недостатке гормонов в эмбриональный период наблюдается тяжелая умственная
отсталость.
При связывании гипофизарного тиреотропина с рецептором
базальной мембраны клетки фолликула щитовидной железы активируется транспортер
тирозина и йодная помпа. Поступающий в клетку тирозин связывает йод с
образованием моно— и дийодтирозинов. Они акцептируют на поверхности молекулы
тиреоглобулина. Вместе с коллоидными белками при апокриновой секреции они
поступают в полость фолликула, где образуется глобулярная структура
тиреоглобулина. Последнее способствует превращению тирозинов в три— и
тетрайодтиронины. Затем этот комплекс посредством пиноцитоза захватывается из
полости клеткой обратно. При захватывании пиноцитозом тиреоглобулин
освобождается от йодсодержащих гормонов. В плазме крови энзимы (дейодиназы)
отщепляют йод полностью у тирозинов и частично — у тиронинов, что приводит к
преобладанию пула трийодтиронинов. Однако тироксин обладает значительно большей
эффективностью. В сосудистом русле тиронины транспортируются связывающими их
белками крови, которые синтезируются в печени.
Рецепторы йодтиронинов локализованы внутриклеточно,
что обеспечивает гормональные эффекты на уровне хроматина ядра и митохондрий.
Гормоны активируют экспрессию генов ряда витаминов, сократительных белков, Na, К—АТФазы
и энзимов дыхательного цикла. Через поры этой помпы в клетку транспортируется
глюкоза, кислород и некоторые аминокислоты.
Таким
образом, йодсодержащие гормоны активируют поступление в клетку субстрата
окисления и окислителя, а также стимулируют энзиматически сам процесс дыхания.
Это обусловливает участие гормонов в регуляции энергетического обмена, а также
энергоемких реакций: митоза и мейоза в процессе гаметогенеза, тонуса скелетных
мышц и сократительного термогенеза (дрожи), увеличения силы сердечных
сокращений, повышения возбудимости ЦНС и генеза отрицательных эмоций, полового
и терморегуляторного поведения, метаморфозов (у низших позвоночных животных и
насекомых). Это определяет возникновение при гипо— и гипертиреозах
соответствующих психозов, расстройств сна, памяти, внимания, репродукции и
двигательной активности.
Тиреоидные гормоны оказывают стимулирующее влияние на
процессы метаморфоза, что наиболее четко показано на амфибиях. При помещении
головастиков лягушки в воду, не содержащую йода, не осуществляется метаморфоз;
добавление йода или тиреоидных гормонов приводило к
осуществлению метаморфоза и развитию организма во взрослые формы.
Тиреоидэктомия
сопровождается задержкой развития половых желез, что свидетельствует о
необходимости тиреоидных гормонов для нормальной половой функции. Они имеют
большое значение при сезонных адаптациях у различных животных. При
осуществлении приспособительных изменений в организме тиреоидные гормоны
действуют совместно с другими гормонами, прежде всего с глюкокортикоидами.
Регуляция
концентрации тиреоидных гормонов. Уровень Т4 и Т3 в крови в нормальных условиях
варьирует в очень узких пределах. В ситуациях, которые требуют повышенной
концентрации тиреоидных гормонов, их секреция соответственно возрастает.
Секреторная
функция щитовидной железы, как и других эндокринных желез, регулируется по принципу
отрицательной обратной связи (рис. 6.16). При снижении секреции Т3 и Т4
содержание ТТГ в плазме повышается; напротив, концентрацию ТТГ можно снизить
введением Т3 и Т4. В систему регуляции входит также гипофизотропная зона
гипоталамуса, где вырабатывается ТРГ, стимулирующий выработку ТТГ гипофизом
(рис. 6.7, 6.17, 6.18). Тироксин тормозит секрецию ТТГ и, очевидно, ТРГ.
Возможно, что накапливающиеся в щитовидной железе тиреоидные гормоны могут
подавлять свое собственное образование и выведение Т4 в кровь. Это может быть
одним из аутокринных факторов, регулирующих дальнейший синтез гормона. На
секрецию Т3 и Т4 оказывают влияние сигналы от терморецепторов.
Патофизиология. Тиреоидные гормоны играют
важную роль в регуляции жизненно важных функций организма, изменение уровня их
содержания приводит к тяжелым патологическим состояниям. Давно известный
синдром диффузного токсического зоба (болезнь Базедова, болезнь Грейвса)
возникает из—за образования (очевидно, в вилочковой железе) длительно
действующего стимулятора щитовидной железы, который обладает свойствами ТТГ.
Его выделение не тормозится механизмом отрицательной обратной связи, и поэтому
он неограниченно стимулирует образование тиреоидных гормонов. Этот стимулятор
нарушает иммунологические процессы в организме, в связи с чем болезнь Базедова
рассматривают как аутоиммунное заболевание.
|
|
|
Рис.
6.16 Прямые и обратные связи в
системе нейроэндокринной регуляции 1
— медленно развивающееся и продолжительное ингибирование секреции
гормонов и нейромедиаторов, а также изменение поведения и формирования
памяти; 2 — быстро
развивающееся, но продолжительное ингибирование; 3 — кратковременное ингибирование. |
|
|
|
Рис. 6.17 Регуляция активности эндокринных
желез центральной нервной системой при участии гипоталамуса и гипофиза ТЛ —
тиреолиберин; СЛ — соматолиберин; СС — соматостатин; ПЛ — пролактолиберин; ГЛ
— гонадолиберин; КЛ — кортиколиберин; ТТГ — тиреотропный гормон; СТГ —
соматотропный гормон (гормон роста); ПРЛ — пролактин; ФСГ —
фолликулостимулирующий гормон; ЛГ — лютеинизирующий гормон; АКТГ —
адренокортикотропный гормон ПС — пролактостатин. Сплошными стрелками
обозначены активирующие, пунктирными — ингибирующие влияния. |
|
|
|
Рис. 6.18
Регуляция уровня тиреоидных гормонов с включением механизмов влияния
через терморецепторы и стресс—факторы Т3 —
трийодтиронин, Т4 — тироксин, ТЛ — тиреолиберин, ТТГ — тиреотропин; сплошными
стрелками обозначено прямое, стимулирующее влияние различных факторов,
пунктирными — торможение по типу обратной связи. |
Предполагают,
что стимулятор представляет собой антитело к рецептору ТТГ в аденогипофизе.
Избыточная продукция тиреоидных гормонов приводит к активации катаболизма
белков, в результате чего и может наступить отрицательный азотистый баланс. При
этом происходят также нарушение углеводного обмена, торможение перехода
углеводов в жиры, усиление мобилизации жира, нарушение водного и минерального
обмена, нарушаются процессы окислительного фосфорилирования. Заболевание
сопровождается похуданием, тахикардией, повышенной нервной возбудимостью, часто
наблюдается пучеглазие (экзофтальм).
Среди
других заболеваний, связанных с увеличением продукции тиреоидных гормонов,
часто встречается токсическая аденома щитовидной железы (болезнь
Пламмера). В этом случае в щитовидной железе образуется доброкачественная
опухоль, автономно продуцирующая повышенные количества тиреоидных гормонов.
Теоретически возможен также гипертиреоз, связанный с повышением секреции
ТТГ; однако такое заболевание наблюдается крайне редко.
Гипотиреоидное
состояние связано с пониженной
продукцией тиреоидных гормонов. Для гипотиреоза характерно разрастание ткани
щитовидной железы. Это происходит потому, что Т3 и Т4 не включаются в
необходимой степени (из—за их малого количества) в цепь регуляции обратной
связи. В результате продолжается выработка ТТГ, который и приводит к
дальнейшему увеличению щитовидной железы. Нарушение секреции тиреоидных
гормонов часто связано с недостаточным количеством йода в окружающей среде (эндемический
зоб). Развитие этой формы зоба наблюдается в различных районах земного
шара, например, в Альпах. В этих случаях введение йода с пищей предотвращает
развитие заболевания.
Другие
формы гипотиреоза возникают в связи с генетическими нарушениями синтеза
тиреоидных гормонов или вследствие аутоиммунного разрушения железы. Гипотиреоз
может наблюдаться также при нарушении секреции ТТГ гипофизом и ТЛ
гипоталамусом. Синдром врожденной недостаточности щитовидной железы именуется кретинизмом.
Снижение окислительных процессов и понижение синтеза белка приводят к задержке
роста у детей. У взрослых недостаточность функции щитовидной железы вызывает
умственную и физическую отсталость. При этом происходит нарушение белкового
(понижение синтеза и распада белка), углеводного (гипогликемия), водного и
минерального обмена, наблюдается брадикардия. Резко выраженная форма
гипотериоза называется микседемой (от греч. myxa — слизь — и oedema —
отек); она сопровождается тестовидным утолщением кожи,
связанным с увеличением объема соединительной ткани и задержкой в ней воды, и отложением
муциноподобных веществ.
Многие
результаты о действии тиреоидных гормонов получены при по удалении щитовидной
железы с замещающей терапией тиреоидными гормонами или ТТГ. Определенное
значение в изучении физиологии щитовидной железы имело применение различных антитиреоидных
веществ, ингибирующих ее функцию. Важную роль здесь играют также
особенности цитоморфологии щитовидной железы, выявляемые на основании
гистологического и электронно—микроскопического анализа. Однако в настоящее
время наибольшее значение имеют методы радиоиммунологического анализа
концентраций Т3, Т4 и ТТГ в плазме. Плодотворным методом является введение
радиоактивного изотопа 131J (или 123J) и регистрация его поглощения щитовидной железой с
получением «карты» распределения его излучения (радиоизотопное сканирование).
Так, в частности, возможно определение функции щитовидной железы при различных
состояниях организма. Скорость падения радиоактивности в этом случае служит
мерой выделения тиреоидных гормонов.
6.3.2. Надпочечник и его гормоны
У млекопитающих надпочечник — это парный
орган, лежащий над почкой и состоящий из двух частей, которые различаются по
своему происхождению, морфологии и функции, — коркового (коры) и мозгового
вещества. Кора развивается из складки целомического эпителия, из которого
образуются и гонады. Симпатобласты из брюшных симпатических ганглиев мигрируют
в область расположения коркового вещества и в дальнейшем образуют клетки
мозгового вещества надпочечников, вырабатывающие катехоламины. Такое
происхождение объясняет близость гормонов, выделяющихся в коре надпочечника и в
железистой ткани гонад: и те, и другие являются стероидами. Это определяет синергичносты симпатической
нервной системы и гормонов мозгового вещества надпочечника.
У низших позвоночных гомологом коры надпочечника
является интерреналовая железа — островки железистой ткани,
вырабатывающей кортикостероиды. Они разбросаны в ткани головной и отчасти
туловищной почки. Хромаффинная ткань, являющаяся гомологом мозгового вещества
надпочечника, разобщена с интерреналовой и находится вблизи крупных кровеносных
сосудов.
|
|
|
Рис. 6.19 Схема зон надпочечника и вырабатываемые ими гормоны 1 — пучковая зона, 2 — сетчатая зона, 3 — корковое вещество, 4 — мозговое вещество, 5 — клубочковая
зона. |
В ходе эволюции позвоночных происходила постепенная
концентрация структур интерреналовой и хромаффинной ткани и их объединение в
одну железу — надпочечник. Уже у рептилий образуется единый парный орган, характерный
также и для более высокоорганизованных позвоночных и человека (рис. 6.19).
Объединение коры и мозгового вещества в один
орган дает определенное
преимущество для регуляции комплексной секреции
стероидов и катехоламинов,
например, при стрессе.
Кора надпочечника. У млекопитающих состоит из трех слоев: клубочковой
зоны, лежащей снаружи, пучковой зоны и сетчатой, прилежащей к
мозговому веществу. Надпочечник имеет обильное кровоснабжение.
Из коры надпочечника выделено около 50 различных
стероидов (табл. 6.5). Большинство из них являются промежуточными продуктами
синтеза активных гормонов. Основным субстратом для синтеза стероидных гормонов
является
холестерин, поступающий в клетки с
кровью. В клетках он хранится в виде
|
Таблица 6.5 Стероидные
гормоны
|
эфиров или других соединений в
мембранах, липидных каплях или липосомах, представляющих собою депо холестерина.
В процессе синтеза стероидов большую роль играют митохондрии,
эндоплазматический ретикулум, комплекс Гольджи. Ряд этапов синтеза стероидов
осуществляется в митохондриях, в связи с этим в стероидогенных тканях эти
органоиды имеют везикулярные кристы.
В коре надпочечника вырабатываются гормоны, называемые
кортикостероидами, или кортикоидами. Они разделяются на две
основные группы: глюкокортикоиды, выделяемые пучковой и сетчатой зонами,
и минералокортикоиды, образующиеся в наружной клубочковой зоне. Кроме
того, в коре надпочечника, главным образом в сетчатой зоне, секретируются
небольшие количества половых стероидов, в основном андрогенов.
Состав секретируемых кортикостероидов различается у
разных животных; у человека только три кортикоида секретируются в виде
гормонов: кортизол (гидрокортизон), альдостерон и в меньшей
степени кортикостерон. В крови гормоны находятся в связанном состоянии с
белком—носителем — транскортином.
Кортикоиды обладают широким спектром действия.
Удаление обоих надпочечников приводит к смерти животного. Основным действием
глюкокортикоидов является влияние на углеводный обмен; минералокортикоиды
(альдостерон) связаны с балансом электролитов, андрогены регулируют белковый
обмен. Такое разделение эффектов кортикостероидов характерно для высших
позвоночных.
У млекопитающих требуется введение очень высоких доз
глюкокортикоидов, чтобы выявить их минералокортикоидный эффект, а
глюкокортикоидное действие альдостерона выражено столь слабо, что практически
равно нулю. Однако у низших позвоночных такого четкого разделения влияний
кортикостероидов нет. У большинства рыб в интерреналовой железе вообще не
вырабатываются минералокортикоиды; в этом случае глюкокортикоиды обладают более
широким спектром действия и кроме влияний на углеводный обмен оказывают
минералокортикоидное действие. Лишь с выходом позвоночных на сушу у амфибий
начинает в больших количествах вырабатываться альдостерон и в дальнейшем ходе
эволюции развиваются специфические эффекты двух групп кортикостероидов.
Эффекты глюкокортикоидов. Влияние глюкортикоидов
весьма разнообразно. Выявляется оно наиболее четко у животных после удаления
надпочечников (адреналэктомии) и введения альдостерона. Так, синтез глюкозы из
аминокислот — глюконеогенез — находится под регулирующим влиянием
кортизола. У этого гормона несколько путей влияния, но преимущественно его
воздействие осуществляется за счет увеличения активности ряда ферментов,
необходимых для глюконеогенеза. Глюкоза, вырабатываемая в результате введения
кортизола, восполняет запасы гликогена в печени, истощенные после удаления коры
надпочечника. Таким образом, кортизол увеличивает образование и отложение
гликогена в печени и мышцах и повышает уровень глюкозы в крови.
Глюкокортикоиды обладают катаболическим действием.
Они тормозят синтез белков в периферических тканях и усиливают их катаболизм.
Аминокислоты, поступающие в печень в результате катаболизма белков, служат
субстратом для глюконеогенеза. Избыток кортизола приводит к атрофии мышц. В
отсутствие глюкокортикоидов нарушаются мобилизация и выделение жирных кислот из
жировой ткани, т. е. липолиз. Благодаря повышению кровотока в клубочках
и усилению клубочковой фильтрации кортизол обеспечивает экскрецию воды.
Он обладает также специфическим влиянием на экскрецию мочи — снижает
проницаемость для воды дистального отдела почечных канальцев.
При
недостаточности коры надпочечника наблюдается мышечная слабость, проявления
которой снижаются при введении кортизола.
В головном мозгу обнаружены
многочисленные рецепторы глюкокортикоидов, благодаря чему эти гормоны оказывают
разнообразное действие на функции ЦНС и органов чувств. При
недостаточности коры надпочечников нарушается способность различать оттенки
вкусовых, обонятельных и звуковых ощущений;
введение
глюкокортикоидов способствует нормализации функции. Глюкокортикоиды, видимо,
влияют на процессы обработки информации в центрах мозга,. регулируя интеграцию
сенсорных импульсов, хотя механизм их влияния пока не ясен.
Глюкокортикоиды оказывают
значительное влияние на клеточный и гуморальный иммунитет. При
снижении активности коры надпочечников происходит увеличение вилочковой железы
и лимфатических узлов. Введение глюкокортикоидов нормализует функции этих
органов. Кортизол обладает четким противовоспалительным действием, в связи с
чем его применяют при лечении ревматических заболеваний. Однако в условиях
хронического стресса длительная секреция кортизола приводит к разрушению
краевой зоны вилочковой железы и вторичным иммунодефицитам.
Концентрация глюкокортикоидов
поддерживается в течение более или менее длительных периодов времени на
постоянном уровне за счет специальных регуляторных механизмов, хотя существуют
циркадные колебания. Например, у человека продукция кортизола максимальна в
утренние часы и снижена ночью. Около 90% глюкокортикоидов связано с белками
крови.
Регуляция секреции
глюкокортикоидов. Схема регуляции
секреции глюкокортикоидов такова. Кортиколиберин, образованный в
гипофизотропной зоне гипоталамуса (см. разд. 6.2), поступает в гипофиз и
вызывает выделение АКТГ. Последний доставляется кровью к коре надпочечника, где
он стимулирует синтез и секрецию глюкокортикоидов (рис. 6.20). Введение АКТГ
крысе уже через 2 мин приводит к увеличению уровня глюкокортикоидов. Секреция
кортиколиберина в гипофизотропной зоне гипоталамуса находится под контролем
автономной нервной системы. Кроме того, глюкокортикоиды по механизму
отрицательной обратной связи подавляют его образование.
|
|
|
Рис. 6.20 Секреция глюкокортикоидов
и их действие |
Так, введение
глюкокортикоидов в гипофизотропную зону вызывает снижение секреции АКТГ.
Секреция АКТГ изменяется также при инъекции стероидов в аденогипофиз. Очевидно,
что в гипофизотропной зоне и в гипофизе располагаются рецепторы
глюкокортикоидов. Возможно, АКТГ способен и непосредственно ингибировать свою
собственную выработку через так называемую короткую цепь обратной связи.
При этом этот гормон влияет на функцию нейросекреторных клеток, вырабатывающих
либерин.
Патофизиология. Из анализа эффектов глюкокортикоидов следует, что повышение
и снижение выработки этих гормонов приводят к серьезным нарушениям функций
организма. В результате повышенного содержания кортизола наблюдаются ожирение,
гипергликемия, усиленный распад белков (катаболическое действие), задержка воды
и хлорида натрия в организме (отеки), гипертензия, пониженная резистентность.
При недостаточности функции
коры надпочечников, снижении выработки кортикостероидов развивается тяжелое
состояние — аддисонова (бронзовая) болезнь. Она характеризуется
гиперпигментацией кожи и слизистых оболочек (бронзовый оттенок), ослаблением
сердечной мышцы, артериальной гипотензией, повышенной утомляемостью,
восприимчивостью к инфекциям, нарушениями водно—солевого обмена.
6.3.3. Гонады и половые гормоны
В гонадах происходит развитие и созревание половых
клеток, а также выработка половых гормонов.
Процессы
развития, созревания половых клеток и размножения значительно различаются у
разных позвоночных, в связи с чем наблюдаются особенности и в механизмах их
гормональной регуляции. У рыб, амфибий, рептилий и птиц в яйцах накапливается
желток, необходимый для развития эмбриона, которое протекает в большинстве
случаев вне тела самки. Большой сложности достигает репродуктивная система
млекопитающих (см. гл. 14), у которых развитие эмбриона происходит в теле
самки. У большинства видов млекопитающих образуется плацента — специальный
орган, обеспечивающий развитие плода и вырабатывающий собственные гормоны.
В
осуществлении функции размножения принимает участие ряд гормонов гонад, однако
основное значение имеют стероиды. Их можно разделить на три основные группы: эстрогены (от греч. oistros
— неистовое желание, страсть и —genes — вызывающий), гестагены (от лат. gesto — носить, быть беременной и
греч. –genes) и андрогены
(от греч. aner, andros —
мужчина и –genes). Гормоны первых двух групп называют также женскими
половыми гормонами, важнейшими из них являются эстрадиол, эстрон и прогестерон.
Третья группа — мужские половые гормоны. Из них наиболее значим тестостерон.
Прогестерон является предшественником глюко— и минералокортикоидов, а также
андрогенов. Причем эстрогены служат производными тестостерона. Это объясняет
особенности состава пула половых стероидов в коре надпочечников и гонад
(мужских и женских).
Пути
синтеза и обеспечивающая их система ферментов обнаружены у всех позвоночных и
некоторых групп беспозвоночных животных. Это указывает на значительную
древность, стабильность и универсальность половых стероидов, играющих важную
роль в обеспечении репродукции и, следовательно, в сохранении вида.
Действие
половых стероидов. Гормоны,
образующиеся в гонадах, способствуют эмбриональной дифференцировке (у
млекопитающих) и последующему развитию половых органов (рис. 6.21). В
дальнейшем они определяют половое созревание и развитие разнообразных вторичных
половых признаков. Половые стероиды регулируют процессы, связанные с синтезом
желтка в ооцитах и овуляцией, а у млекопитающих также индуцируют
изменения в эндометрии
|
|
|
Рис.
6.21 Регуляция секреции и эффекты
женских половых гормонов у млекопитающих |
матки, предшествующие имплантации яйцеклетки после
ее оплодотворения и обеспечивающие нормальное протекание беременности
(прогестерон). Совместно с другими гормонами половые стероиды вызывают изменения
молочных желез, необходимые для секреции молока.
В
опытах на крысах показано, что если на ранних этапах эмбриогенеза блокировать
секрецию тестостерона, у плода—самца развиваются гениталии (половые органы)
самки. Если на этих стадиях развития плоду—самке ввести тестостерон, происходит
частичное развитие гениталий самца. Путем воздействия половыми стероидами на
развивающиеся эмбрионы ряда рыб получают фенотипических самок из генотипических
самцов и наоборот. В результате соответствующих воздействий формируются
популяции, состоящие только из самок или из стерильных особей. У эмбрионов
женского пола в период внутриутробного развития яичники не обладают
гормональной активностью.
Половое
созревание.
Половые стероиды оказывают значительное влияние на развитие и созревание
половых клеток. Эстрогены стимулируют Синтез белка вителлогенина в
печени, который включается в ооцит и образует желток, необходимый для роста и
развития эмбриона. В опытах на лягушках в ооцитах которых еще не началось
накопление желтка, показано, что введение эстрадиола уже через 12—24 ч
приводило к синтезу вителлогенина.
Половыми стероидами контролируется развитие весьма
разнообразных вторичных половых признаков, обеспечивающих процесс
размножения. Так, брачный наряд рыб и других животных, развитие рогов и других
образований определяются половыми стероидами. После удаления яичников или
семенников у взрослых особей различных животных (от рыб до млекопитающих)
наблюдается обратное развитие вторичных половых признаков. Эти эффекты были
четко показаны на птицах в опытах М. М. Завадовского (рис. 6.22).
В
период полового созревания усиливается эндокринная активность гонад у девочек и
мальчиков. Под влиянием гонадотропинов, эстрогенов и гестагенов у девочек и
андрогенов у мальчиков происходит развитие и созревание половых органов.
Тестостерон необходим также для осуществления сперматогенеза.
|
|
|
Рис.
6.22 Влияние пересадки половых желез
на вторичные половые признаки у кур I — петух и курица, II — кастрированные петух и курица,
III — кастрированный петух с
пересаженным яичником и кастрированная курица с пересаженным семенником. |
У женщин половые гормоны вызывают изменения миометрия,
характерные для менструального цикла. Эстрогены обусловливают
пролиферативную фазу, во время которой утолщается слизистая оболочка и
происходит развитие желез эндометрия. После овуляции под влиянием прогестерона
железы эндометрия вступают в секреторную фазу, что создает возможность
имплантации оплодотворенной яйцеклетки. В дальнейшем благодаря прогестерону
поддерживается
нормальное
развитие плода.
Экстрагенитальные эффекты половых
гормонов.
Эти эффекты разнообразны. Так, андрогены обладают анаболическим эффектом.
Они усиливают синтез сократительных белков, чем объясняется, в частности,
значительное развитие мускулатуры у самцов. Для прогестерона характерен катаболический
эффект. Прогестерон усиливает основной обмен, что сопровождается повышением
пороговых температур, потоотделения и расширением сосудов. Поэтому прогестерон
повышает базальную температуру тела, измеряемую утром, в покое.
Во взаимодействии с другими гормонами
половые стероиды влияют на рост костей. Под их действием
приостанавливается рост благодаря окостенению эпифизарных хрящей. При
недостаточности андрогенов гормон роста продолжает влиять на неокостеневшие,
эпифизы, усиливая рост, что приводит к развитию евнухоидного гигантизма.
Влияние на половое
поведение.
Уровнем тестостерона в значительной степени определяется агрессивное
поведение самцов разных животных. Например, в популяциях некоторых рыб
(колюшка), где устанавливается социальная иерархия, у доминирующих особей
выявлен наиболее высокий уровень тестостерона. Как и у других рыб, эти особи
имеют преимущества при размножении. Та же ситуация наблюдается в популяциях
других животных (птицы, ластоногие, копытные и др.).
Половые гормоны имеют важное
значение для осуществления заботы о потомстве, которая выражается весьма
разнообразно. Так, например, постройка и охрана гнезда у многих рыб
контролируется половыми стероидами. Под влиянием половых стероидов происходит
также выработка ряда феромонов, в частности тех, которые необходимы при
осуществлении процесса размножения.
Периоды размножения у различных животных обычно имеют
сезонную цикличность. В тропиках при постоянно высокой температуре
возможно многократное размножение ряда рыб. Оно возникает по мере развития и
созревания последовательных порций половых клеток. Самки млекопитающих (кроме
человека и других приматов) спариваются только в определенные периоды,
длительностью в несколько дней. Эти периоды совпадают с изменениями в слизистой
оболочке половых органов (эструс, течка). При имплантации эстрогенов в
гипоталамус вне периода размножения развивается течка с характерным поведением;
это четко демонстрирует роль половых стероидов. У самок приматов существует
менструальный цикл, в середине которого перед и после овуляции наблюдается
наибольшая половая активность.
Уровень половых гормонов в половом цикле. Уровень половых гормонов в половом цикле у
позвоночных животных подвержен значительным колебаниям. В процессе развития
ооцитов под влиянием гонадотропина гипофиза усиливается секреция эстрадиола,
который приводит к синтезу вителлогенина. Этот белок поступает в кровь и под
влиянием гонадотропных гормонов (ГТГ) включается в ооцит. Таким образом
образуется желток. После завершения накопления желтка уровень эстрадиола
снижается. Гонадотропные гормоны в более низких концентрациях периодически
поступают в кровь. У самцов под влиянием гонадотропинов повышается уровень
тестостерона; этот гормон необходим при осуществлении сперматогенеза и
спермиации. Уровень половых гормонов оказывает влияние на секрецию
гонадотропина гипофизом и на продукцию ГТГ в гипоталамусе; взаимодействия
осуществляются с помощью механизма отрицательной обратной связи.
У низших позвоночных отсутствует такое разделение
функций гонадотропных гормонов, как это наблюдается для ФСГ и ЛГ у
млекопитающих. У рептилий обнаружены ФСГ и ЛГ, и сфера их действия близка к
тому, что происходит у млекопитающих.
Концентрация половых стероидов существенно меняется
на протяжении Менструального цикла у женщины. Во второй трети цикла уровень
эстрогенов резко повышается, а затем падает. В конце цикла повышается уровень
прогестерона (рис. 6.23).
|
|
|
Рис. 6.23 Менструальный цикл приматов ЛГ — лютеинизирующий гормон, ФСГ —
фолликулостимулирующий гормон, Э — эстрогены. |
Секреция женских половых гормонов регулируется гонадотропными
гормонами гипофиза — ФСГ и ЛГ. Под влиянием ФСГ в начале менструального цикла
происходит созревание первичного фолликула, увеличивается концентрация
эстрадиола. Секреция эстрадиола регулируется совместным влиянием ЛГ и ФСГ. В
середине цикла уровень ЛГ резко повышается, что приводит к разрыву фолликула,
овуляции и превращению фолликула в желтое тело Во время овуляции происходит
также повышение уровня ФСГ. Очевидно, ФСГ принимает участие в регуляции этого
процесса. Латентный период со времени пика ЛГ до овуляции составляет от 24 до
36 ч. Желтое тело под влиянием ЛГ вырабатывает прогестерон, концентрация
которого резко повышается сразу же после овуляции. Регуляция секреции ФСГ и
ЛГ осуществляется рилизинг—гормоном ЛГ—РГ
(люлиберином). Этот гормон (или ГТГ—РГ)
регулирует секрецию ЛГ и ФСГ. Секреция ЛГ—РГ, как показано на обезьянах, носит
эпизодический характер. Фазы усиленной секреции длительностью в несколько минут
разделены 1—1,5—часовыми интервалами; в это время секреция ЛГ—РГ незначительна.
Под влиянием импульсной секреции ЛГ—РГ в преовуляторной фазе скорость секреции
ФСГ нарастает, а по мере созревания фолликула увеличивается секреция эстрогена.
В опытах доказана роль эстрогенов в стимуляции выведения гонадотропинов, т. е.
в этот период существует положительная обратная связь.
После овуляции происходит
повышение уровня прогестерона. В этот период два половых гормона — эстрадиол и
прогестерон — обеспечивают механизм отрицательной обратной связи, т. е.
повышение уровня этих гормонов приводит к торможению выделения ФСГ и ЛГ и,
таким образом, препятствует
созреванию
следующего фолликула (см. рис. 6.23).
На секрецию ЛГ—РГ существенное влияние оказывает состояние
различных отделов ЦНС, прежде всего лимбической системы и преоптической области
гипоталамуса. В связи с этим понятны влияния разнообразных факторов (стресс) на
менструальный цикл. У многих животных осуществление различных этапов полового
цикла связано с изменением продолжительности фотопериода (светового дня) и
показателей температуры; эти влияния также, очевидно, осуществляются через
упомянутые структуры нервной системы.
Торможение овуляции. Торможение овуляции может
быть достигнуто путем введения экзогенных эстрогена и прогестерона, которые в
начале цикла тормозят секрецию ЛГ—РГ посредством отрицательной обратной связи.
В результате не возникает пика ЛГ и не происходит овуляции. Этот механизм
используют при применении некоторых контрацептивных средств.
Течка (эструс). У самок млекопитающих перед спариванием
возникает особое состояние, соответствующее периоду половой активности и
совпадающее по времени с созреванием фолликулов в яичниках. При течке
происходит выделение отторгающихся клеток эпителия влагалища, иногда
сопровождающееся
кровотечением (например, у
собак). У женщин кровотечение во время
овуляции отсутствует. Кровотечение связано с разрушением части эндометрия
матки. Оно возникает через две недели после овуляции и происходит при резком
снижении уровня половых гормонов.
Основные черты гормональной регуляции беременности,
родов и лактации. После
оплодотворения яйцо перемещается в матку и развивающаяся бластоциста
(зародышевый пузырек) внедряется в ее стенку (см. разд. 13.10). Для имплантации
яйца необходимы прогестерон и эстрогены. После этого часть бластоцисты
(трофобласт) вместе с прилегающим участком эндометрия матки образует плаценту,
благодаря чему обеспечивается связь кровоснабжения матери и плода. В одной из
оболочек — хорионе — вырабатываются собственные гормоны — хорионический
гонадотропин (ХГ, у обезьян и человека) и плацентарный лактогенный
гормон (ПЛГ).
Хорионический гонадотропин — гликопротеин, близкий к
ЛГ, его роль состоит в поддержании функциональной активности желтого тела и усилении
секреции прогестерона на ранних этапах беременности. Плацентарный лактогенный
гормон имеет сходное строение молекулы с СТГ. Физиологическая роль ПЛГ состоит
во влиянии на процессы метаболизма при беременности.
Таким образом, важнейшей особенностью эндокринологии
репродуктивной системы у плацентарных млекопитающих (включая человека) является
образование плаценты, необходимой при внутриутробном развитии плода. В этом
временном образовании, обеспечивающем дополнительные гомеостатические механизмы
и тонус гладкой мускулатуры матки, вырабатываются собственные гормоны белковой
природы — ХГ, ПЛГ и релаксин (образуется в материнской части плаценты),
а также осуществляется частично синтез стероидов.
Высокий уровень прогестерона
при беременности препятствует разрушению эндометрия. К концу 1—го месяца
развития плода желтое тело дегенерирует. К этому времени плацента берет на себя
выработку прогестерона и эстрадиола, необходимых для осуществления
беременности. Плацента прекращает свое существование во время родов.
Хорионический гонадотропин
поступает в жидкости организма уже с 9—12 сут беременности. Поэтому для ее
ранней диагностики используют тесты с введением мочи рыбам в преднерестном
состоянии, самцам лягушки или грызунам. При наличии ХГ происходит овуляция или
спермиация у этих животных.
При родах обычно наблюдается падение
уровня прогестерона, а это увеличивает готовность матки к сокращению,
возрастает уровень окситоцина. Релаксин вызывает разрыхление лонного
сочленения. Важным фактором, влияющим на начало родов, является также усиление
секреции глюкокортикоидов плодом в конце беременности. Глюкокортикоиды
стимулируют образование эстрогена из прогестерона в плаценте, в результате чего
концентрация прогестерона падает, а концентрация эстрогена повышается. Следствием
этого служит выделение простагландина Е, что повышает чувствительность
матки к окситоцину и стимулирует ее сокращение.
При половом созревании под
влиянием эстрогенов происходит развитие молочной железы. С наступлением
беременности под влиянием повышения уровня эстрогена формируются дистальные
альвеолы и дольки железы. В этом процессе участвуют ряд гормонов — пролактин (у
человека также ПЛГ), инсулин, тироксин, кортизол. Секреция молока начинается
после родов, и его выделение стимулируется сосанием. При этом окситоцин
способствует сокращению миоэпителиальных клеток в альвеолах молочной железы.
Регуляция уровня полового
гормона у мужчин. Уровень мужских половых гормонов довольно постоянен и регулируется с
помощью обычного механизма отрицательной обратной связи (рис. 6.24). Повышение
уровня тестостерона тормозит секрецию ЛГ, по—видимому, путем торможения
выделения соответствующего рилизинг—гормона в гипофизотропной зоне гипоталамуса
(рис. 6.25).
Фолликулостимулирующий гормон регулирует
дифференцировку сустентоцитов (клеток Сертоли) семенников и образование
первичных сперматогониев. В этих клетках находятся рецепторы ФСГ, через которые
активируется выработка андрогенсвязывающего белка (АСБ). Комплекс
тестостерона с этим белком оказывает влияние на сперматогенез. В клетках
семенников предполагают выработку полипептида ингибина, который снижает
секрецию ФСГ и ЛГ—РГ.
|
|
|
Рис. 6.24 Регуляция секреции тестостерона и его действие |
|
|
|
Рис. 6.25 Регуляция уровня тестостерона и процесса
сперматогенеза ЛГ—РГ —
гонадолиберин; сплошными стрелками обозначено усиление секреции, пунктирными
— торможение по типу обратной связи. |
Патофизиология. При нарушении развития гамет возникает бесплодие. При
хромосомных аномалиях в одних случаях (ХО) не развивается ни мозговое,
ни корковое вещество первичной гонады, в других (XXY) появляется неправильное развитие
семенников при женском фенотипе. Одновременное развитие зачатков мужской и
женской гонад приводит к истинному гермафродитизму (у человека
наблюдается в редких случаях).
Нарушение секреции половых стероидов сопровождается
разнообразными патологическими отклонениями в органах половой сферы и во всем
организме. Чаще встречается гипофункция стероидогенной ткани. При этом
наблюдаются продолжительный рост, евнухоидное строение тела и другие нарушения.
6.4. ЭНДОКРИННЫЕ ЖЕЛЕЗЫ,
ФУНКЦИОНИРУЮЩИЕ БЕЗ ПРЯМОГО РЕГУЛЯТОРНОГО ВЛИЯНИЯ ГОРМОНОВ ГИПОФИЗА
Ряд эндокринных желез
синтезирует и выделяет гормоны без прямого регуляторного влияния гормонов
гипофиза. К этим гормонам относятся адреналин и норадреналин,
вырабатываемые в мозговом веществе надпочечника, минералокортикоид альдостерон,
синтезируемый в клубочковой зоне коры надпочечника, паратгормон,
образующийся в паращитовидных железах, кальцитонин, вырабатываемый в
ультимобранхиальных тельцах низших позвоночных (или С—клетках щитовидной железы
млекопитающих), а также гормоны поджелудочной железы — инсулин и глюкагон.
6.4.1.
Симпатоадреналовая система
Основными
гормонами симпатоадреналовой системы являются адреналин (эпинефрин) и норадреналин
(норэпинефрин). Оба они относятся к катехоламинам. Эти гормоны секретируются в
мозговом веществе надпочечника и в симпатических нервных окончаниях.
В
эмбриогенезе мозговое вещество надпочечника и симпатическая нервная система
развиваются из одного зачатка. Секреторные клетки мозгового вещества
окрашиваются красителями, содержащими соли хрома, в коричневый цвет и потому
называются хромаффинными. Разные клетки различаются по окраске:
темноокрашивающиеся вырабатывают норадреналин, более светлые клетки —
адреналин. Эти клетки представляют собою видоизмененные симпатобласты и
иннервируются преганглионарными нервными волокнами симпатической нервной
системы. Некоторые из них дифференцируются в нейроны.
У низших позвоночных
мозговое вещество в виде компактного образования отсутствует. Скопления
хромаффинных клеток разбросаны по ходу магистральных кровеносных сосудов и не
связаны тесно с тканью надпочечной железы, вырабатывающей кортикостероиды.
Соотношение секреции
адреналина и норадреналина в мозговом веществе надпочечника у разных видов
различно. Оно зависит также и от возраста. У человека адреналин составляет
около 80%. Нервными окончаниями выделяется преимущественно норадреналин,
являющийся медиатором (см. разд. 5.2). У крыс уровень секреции адреналина и
норадреналина составляет 1:1.
В синтезе катехоламинов
исходной аминокислотой является тирозин, причем норадреналин и дофамин, будучи
предшественниками адреналина, выполняют и самостоятельные функции. Катехоламины
обнаружены у всех позвоночных животных и у большинства беспозвоночных. Эти
соединения найдены даже у простейших, что свидетельствует о древности
катехоламинов и широком функциональном значении, в том числе и в механизмах
регуляции.
Адреналин
и норадреналин, выделяемые мозговым веществом надпочечника и окончаниями
симпатических нервных волокон, плохо проникают через гематоэнцефалический
барьер. Однако многие катехоламины образуются в мозгу. Синтезирующие их нейроны
называются адренергическими. Норадреналин, образующийся в головном
мозгу, не поступает в системный кровоток в значительных количествах в связи с
его захватом нервными окончаниями. Норадреналин, выделяемый симпатическими
нервными окончаниями, попадает в кровоток и, таким образом, обладает признаками
гормона, хотя его можно назвать и медиатором. Эффекты этих гормонов сложны и
многообразны, причем на одни органы—мишени адреналин и норадреналин действуют
сходным образом, на другие — по—разному (см. разд. 5.2.2). Секреция
катехоламинов, как и глюкокортикоидов, усиливается при различных стрессорных
ситуациях.
6.4.2. Гормональная регуляция водно—солевого
гомеостаза
В регуляции водно—солевого
равновесия в организме принимает участие ряд гормонов, которые можно
разделить на две основные группы: гормоны (табл. 6.6), регулирующие
концентрацию ионов N+, K+ и H+ (альдостерон, ангиотензин и
фермент ренин), и гормоны, влияющие на равновесие кальция и фосфатов
(паратгормон и кальцитонин).
Регуляция концентрации Na+ и К+. Альдостерон
вырабатывается в клубочковой зоне коры надпочечников высших позвоночных. У
большинства низших позвоночных альдостерон не образуется, и глюкокортикоиды в
значительной
|
Та б л и ц а 6.6 Гормоны, регулирующие водно—солевой обмен и другие функции
|
|
|
|
Рис.
6.26 Регуляция содержания кальция в крови
кальцитонином и паратгормоном |
|
|
|
Рис.
6.27 Гормоны щитовидной (1) и
паращитовидных (2) желез и их функции Кальцитонин вырабатывается С—клетками щитовидной
железы млекопитающих, являющихся гомологом ультимобранхиальных телец других
позвоночных. |
степени выполняют его функции (см. разд. 6.3.2).
Альдостерон начинает вырабатываться в интерреналовой железе в заметных
количествах с выходом позвоночных на сушу — у амфибий. Это связано с его важнейшей
ролью в гомеостазе электролитов и воды в организме. Альдостерон увеличивает
активный транспорт Na+ через клеточные мембраны. В
почках этот гормон усиливает реабсорбцию Na+ в канальцах и вызывает
экскрецию К+. Сходным образом альдостерон влияет на потовые, слюнные
и кишечные железы. Повышение секреции альдостерона происходит при снижении
содержания NaCI, усиленном потреблении калия и уменьшении объема плазмы
крови. Повышение выработки альдостерона может происходить с использованием
различных механизмов.
Непосредственное
влияние на функцию клеток, вырабатывающих альдостерон, оказывают изменения
концентрации Na+ и К+ в плазме.
Регуляция секреции альдостерона опосредуется системой ренин—ангиотензин,
которая обнаружена у большинства позвоночных и четко функционирует начиная с
амфибий. Ренин образуется юкстагломерулярными клетками, расположенными в
стенках афферентных сосудов почки. Под влиянием ренина, а затем
ангиотензинконвертирующего энзима из циркулирующего в плазме пептида
ангиотензиногена образуется ангиотензин II (AT II), который доставляется кровью
к коре надпочечника и усиливает секрецию альдостерона. В ряде работ описано
слабое регулирующее действие АКТГ на секрецию альдостерона и стимулирующее —
вазопрессина. AT II, действуя на мозг, усиливает жажду.
Благодаря
своей важной роли в поддержании концентрации Na+ и K+ в плазме и
объема жидкости в организме альдостерон участвует в нескольких регуляторных
цепях, обеспечивающих осмотический гомеостаз организма.
Регуляция
концентрации кальция и фосфатов. Поддержание гомеостаза кальция и фосфатов
необходимо для нормальной жизнедеятельности организма в связи с их важнейшей
ролью во многих процессах. Ионы кальция влияют на проницаемость клеточных мембран, активность ряда ферментов,
необходимы в процессе оплодотворения, при синаптической передаче, определяют
возбудимость нервно—мышечной системы и т. д. Фосфаты входят в состав
фосфолипидов, ферментов, нуклеиновых кислот.
В отдельные периоды жизни
возникают особенно большие потребности в кальции, например в период развития,
при образовании и откладывании яиц у птиц, при лактации, беременности и т. д. В
организме запасы кальция находятся в костях, чешуе и некоторых других органах.
В регуляции содержания
кальция и фосфатов основная роль принадлежит двум гормонам: паратгормону
и кальцитонину наряду с витамином Dз (рис. 6.26, 6.27).
Паратгормон образуется паращитовидными (околощитовидными)
железами, которые обнаружены у всех позвоночных, начиная с амфибий. Это
парные образования, тесно прилегающие к дорсальной поверхности щитовидной
железы (иногда с каждой стороны расположено по две отдельных железы).
Паратгормон представляет собой полипептид с молекулярной массой 8,5 кДа. Он был
первым гормоном, выделенным из паращитовидных желез. Как и кальцитонин, он
регулирует обмен кальция в организме, но реципрокно тиреоидному гормону. Так,
усиление секреции паратиреоидина вызывается гипокальциемией. Основными мишенями
гормона в организме млекопитающих являются клетки костной ткани, энтероциты
кишки и эпителий проксимальных почечных канальцев. В костной ткани гормон
способствует образованию цитратов кальция, вымываемых в кровь. В кишке и
почечных канальцах под его действием усиливается всасывание иона и выведение
фосфатов.
Костеобразующая функция
(пролиферация, дифференцировка остеоцитов, образование костного матрикса)
паратгормона опосредуется через синтез факторов роста и усиливается
гормональной формой витамина D и
эстрадиолом. Снижение секреции последних способствует развитию резорбции
костной ткани. Увеличение ионизированного кальция в плазме крови и клеточные
эффекты паратгормона на осцилляции Са2+ в нейронах вызывают
повышение возбудимости структур нервной системы и, в отличие от кальцитонина,
активацию аппетита.
Кальцитонин образуется в парных ультимобранхиальных тельцах,
обнаруженных у всех позвоночных (кроме круглоротых, костистых рыб и
млекопитающих). У млекопитающих (кроме муравьеда) тельца не оформлены, состоят
из так называемых кальцитониновых (С—клеток), врастающих в щитовидную железу.
Кальцитонин, вырабатываемый С—клетками, не поступает в полость фолликула как
йод—содержащие тиреоидные гормоны, а сразу выводится в кровь. Кальцитонин
является полипептидом с молекулярной массой около 3,6 кДа.
Кальцитонин, помимо С—клеток
щитовидной железы, синтезируется также в аорте, аденогипофизе, надпочечниках,
и, как модулятор, — в нервной системе. Основная функция гормона — регуляция
кальциевого гомеостаза. Гиперкальциемия является наиболее мощным фактором по
запуску секреции кальцитонина, снижающим уровень ионизированного кальция в крови.
Поскольку кальций может
находиться в плазме в виде водонерастворимых фосфатов и других солей, то и
гипокальциемические эффекты кальцитонина связаны с переводом кальция в
нерастворимую форму фосфатных солей, переносом и накоплением их в остеобластах
и остеоцитах. Кальцитонин увеличивает секрецию Са2+ почками и
уменьшает его всасывание в кишке, тогда как в отношении фосфатов гормон
оказывает противоположный эффект. Кальцитонин подавляет аппетит и жажду,
ограничивая поступление кальция извне.
Патофизиология. Заболевания, связанные с нарушением функции
эндокринных желез, регулирующих уровень кальция и фосфатов, связаны либо с их
гипофункцией, либо, напротив, с гиперфункцией. Заболевание, обусловленное
недостаточной продукцией паратгормона, — гипопаратиреоз —
характеризуется приступами тонических судорог, которые могут развиваться в
результате аутоиммунного разрушения секреторных клеток или частичного удаления
паращитовидных желез. Гиперпаратиреоз возникает при развитии опухолей
паращитовидных желез. В результате мобилизации фосфатов и кальция из кости
повышается уровень кальция в крови; костная ткань перерождается, усиливается
выделение фосфатов с мочой.
6.5. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА И ЕЕ ГОРМОНЫ
Поджелудочная
железа состоит из экзокринной и эндокринной частей, которые развиваются из
одного источника — энтодермы первичной кишки. В экзокринной части,
составляющей у человека 98% всей массы железы, вырабатывается пищеварительный
сок, который поступает в двенадцатиперстную кишку (см. разд. 11.2.3) и содержит
ферменты, необходимые для расщепления белков, жиров и углеводов. В эндокринной
части — панкреатических островках (Лангерганса) — синтезируются гормоны,
регулирующие метаболические процессы, в особенности углеводный обмен.
В процессе эволюции
эндокринная часть возникла раньше экзокринной, так что вначале поджелудочная
железа не имела компактного строения. У ланцетника в эпителии слизистой
оболочки кишки есть клетки, гомологичные экзокринной и эндокринной частям
поджелудочной железы. Эти клетки разобщены. У круглоротых (миноги) образуются
островки железистой ткани, отделяющиеся от эпителия кишечника. У костистых рыб
эндокринная ткань представлена островками (тельца Брокмана), обособленными от
экзокринной ткани поджелудочной железы. У других позвоночных животных эндокринная
ткань в виде мелких включений расположена среди экзокринной ткани поджелудочной
железы и составляет только 1—3% от ее массы.
Гормоны, вырабатываемые
эндокринной частью. В панкреатических
островках большинства позвоночных выявляют два основных типа железистых
клеток, вырабатывающих разные гормоны: инсулин и глюкагон.
Клетки, синтезирующие инсулин, называют (β— (или В—) клетками; клетки, вырабатывающие глюкагон,
— α— (или А—) клетками. Кроме них определен третий
тип клеток — δ—клетки, в которых синтезируется соматостатин
(рис. 6.28).
Р—клетки, синтезирующие
инсулин, обнаружены у всех позвоночных. У низших позвоночных (круглоротые,
хрящевые рыбы) α—клетки и глюкагон не
выявлены. У всех остальных позвоночных в панкреатических островках
синтезируются инсулин и глюкагон, основная функция которых состоит в регуляции
метаболических процессов; от этих гормонов в значительной степени зависит
уровень глюкозы в крови, необходимый для нормальной жизнедеятельности
организма.
Инсулин представляет собою полипептид с молекулярной массой
около 6 кДа. Он состоит из двух цепей, соединенных двумя дисульфидными
мостиками. Инсулин образуется из предшественника — проинсулина — под влиянием
протеаз. Активность проинсулина невелика (5% активности инсулина). Превращение
проинсулина в инсулин происходит в β—клетках.
Инсулин был первым полипептидным гормоном, синтезированным искусственно.
В настоящее время инсулин
(или инсулиноподобный гормон) обнаружен у многих беспозвоночных животных, что свидетельствует,
по—видимому, не только о его древности, но и важной роли в регуляции
метаболических процессов.
Глюкагон — полипептид, построенный из одной цепи с молекулярной
массой около 3,5 кДа. Кроме α—клеток
панкреатических островков глюкагон вырабатывается также в слизистой оболочке
кишечника (энтероглюкагон). Функция энтероглюкагона несколько отличается
от роли панкреатического глюкагона.
Инсулин является
анаболическим гормоном с широким спектром действия. Его роль состоит в
повышении синтеза углеводов, жиров и белков. Он стимулирует метаболизм глюкозы.
Под влиянием инсулина увеличивается проницаемость для глюкозы клеток миокарда,
скелетных мышц, что усиливает ток глюкозы внутрь клеток и ее обмен. Он
необходим для прохода аминокислот сквозь ГЭБ (см. разд. 3.27). Инсулин
стимулирует синтез гликогена в печени, снижает глюконеогенез (образование
глюкозы из аминокислот), влияет на обмен липидов, усиливая способность жировой
ткани и печени к накоплению их резервов в форме триглицеридов (рис. 6.29).
Инсулин активно взаимодействует с другими гормонами, как, например, гормоном
роста.
Действие глюкагона на
метаболические процессы осуществляется в печени и реализуется через
аденилатциклазу и цАМФ. Последний, в свою очередь, активизирует ферменты,
контролирующие скорость гликогенолиза, глюконеогенеза и липолиза. Основной
эффект гормона состоит в усилении гликогенолиза в печени, в чем глюкагон
является синергистом адреналина. По воздействию на уровень глюкозы в плазме
крови глюкагон является антагонистом инсулина.
Концентрация гормонов
поджелудочной железы в плазме крови зависит от поступления глюкозы с пищей,
скорости ее окисления и от уровня других гормонов, участвующих в регуляции
содержания глюкозы. При повышении содержания глюкозы в крови усиливается
секреция инсулина, при ее снижении
|
|
|
Рис. 6.28 Взаимоотношения между
инсулином и глюкагоном в регуляции обмена глюкозы |
|
|
|
Рис.
6.29 Действие инсулина и гормона
роста СТГ — соматотропный гормон. |
выделяется
больше глюкагона. Регуляция уровня гормона в крови осуществляется по механизму
обратной связи (рис. 6.30)
|
|
|
Рис. 6.30 Регуляция уровня гормона в крови по
механизму обратной связи |
Регуляция секреции гормонов осуществляется
симпатической и парасимпатической нервной системой. Помимо того, уровень
глюкозы, очевидно, изменяется и в самой поджелудочной железе, что используется
для регуляции секреторной активности клеток. Регуляция секреции инсулина
происходит и под влиянием ряда регуляторных пептидов, вырабатываемых в
желудочно—кишечном тракте. Присутствие в нем глюкозы вызывает выброс
энтероглюкагона. Этот гормон поступает с кровью к клеткам поджелудочной железы
и стимулирует секрецию инсулина. Инсулотропным действием обладают АКТГ,
вазопрессин и гормон роста.
Регуляция
секреции глюкагона осуществляется посредством рецепторов глюкозы в переднем гипоталамусе,
которые выявляют снижение глюкозы в крови. Возможно, в эту цепь взаимодействий включается
гормон роста гипофиза. Соматостатин, вырабатываемый δ—клетками, оказывает
ингибирующее влияние на выделение глюкагона. Энтероглюкагон также может
подавлять секрецию панкреатического глюкагона. Симпатическая стимуляция
усиливает секрецию глюкагона. Таким образом, система регуляции секреции
инсулина и глюкагона и связанного с функцией этих гормонов уровня глюкозы в
крови весьма сложна.
У млекопитающих главным источником энергии являются
углеводы, и инсулин играет весьма значительную роль в процессах регуляции их
метаболизма. У птиц в 10—20 раз более высоким является содержание глюкагона —
липолитического агента, так как основным источником энергии у этой группы
позвоночных являются липиды. При отклонениях уровня глюкозы в крови от нормы
наблюдаются явления гипо— или гипергликемии.
В
норме концентрация глюкозы в крови человека относительно постоянна и составляет
около 80—120 мг% (44,4—66,6 ммоль/л).
Патофизиология. При гипогликемии, т. е.
резком снижении уровня глюкозы, наблюдаются тахикардия, голод, возбуждение. В
результате гипогликемической комы может наступить смерть. Предотвращение этих
явлений возможно при вливаниях глюкозы и введении глюкагона. При уровне глюкозы
выше 180 мг% (99,9 ммоль/л) она выводится с мочой, что происходит при
ослабленной функции инсулина и является одним из проявлений сахарного
диабета. Это заболевание возникает в результате недостаточной выработки
инсулина β—клетками поджелудочной железы. Те же явления могут
наблюдаться в результате нарушения реакции (снижение числа рецепторов к
инсулину, снижение их аффинности (от лат. affinis — родственный, сродный) периферических тканей на
инсулин. В отсутствие гормона глюкоза медленно проникает в клетки мышц и
печени, т. к. не работают высокоэффективные инсулинзависимые транспортеры
глюкозы, запасы гликогена при этом быстро истощаются.
6.6. ГОРМОНЫ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА
Основной
функцией этих гормонов является влияние на моторику и секрецию различных
отделов пищеварительного тракта. Они секретируются во всех его частях, однако
наибольшее разнообразие типов клеток и синтезируемых ими гормонов описано в желудке
и двенадцатиперстной кишке. Как производные первичной кишки, оба отдела
функционально связаны с печенью и поджелудочной железой, что определяет и сходство
секретируемых ими гормонов. Однако различие рН жидкостных сред в разных отделах
тракта обусловило преобладание характерных для них изоформ тех или иных
гормонов. Рассмотрим некоторые из них.
Гормоны семейства
глюкагона. У человека и крыс
синтезируются в α—клетках поджелудочной
железы, у собак и кошек — в аналогичных клетках дна желудка, а также в
энтерохромаффинных (совместно с серотонином) и клетках L—типа подвздошной и
толстой кишки. Предшественник этих гормонов проглюкагон синтезируется в клетках
кишки, желудка, печени, сердца и головного мозга (где они выполняют функцию
нейромедиаторов или модуляторов). Основная функция состоит в увеличении
концентрации глюкозы в плазме крови. Этому способствует увеличение в кишке
всасывания, в почках — реабсорбции глюкозы. В печени гормон через увеличение
цАМФ стимулирует процессы гликогенолиза и глюконеогенеза. Рост внутриклеточного
уровня глюкозы интенсифицирует клеточное дыхание, обмен веществ и Са—зависимый
выход глюкозы в кровь. Связывание глюкагона с рецептором через активацию Gq—белков
приводит к деполяризации нейронов в мозговых центрах и запуску углеводного
аппетита и соответствующих тактик пищевого поведения.
В семейство пептидов гастрина
и холецистокинина входят несколько изоформ гормонов, различающихся по
числу аминокислотных остатков.
Гастрин секретируется в G—клетках привратниковой
(пилорической) части желудка, в двенадцатиперстной кишке (в железах и на концах
ворсинок), а также в G—клетках. панкреатических островков (Лангерганса).
Связывание гормона с рецептором сопряжено с активацией Gq—белка и фосфолипазы С
с последующим увеличением внутриклеточной концентрации Са2+. Это
определяет механизм действия гастринов: активация сокращения гладкомышечных
клеток и регулируемого Са2+—зависимого экзоцитоза — в секреторных.
Гормональные эффекты обусловлены и распределением рецепторов гастрина: в
слизистой оболочке кишки и экзокринной части поджелудочной железы гормон
активирует секрецию ферментов, участвующих в гидролизе белков. В желудке, где
начинается процесс переваривания белков, гастрины активируют секрецию гистамина
и гистаминзависимого образования НCl. Кроме
того, гастрин стимулирует выделение пепсиногена, конвертируемого в кислой среде
в пепсин, через рецепторы гладкомышечных клеток стенки пищеварительного тракта,
особенно локализованных в области миогенных пейсмекеров стенки желудка и
проксимальной части двенадцатиперстной кишки, где формируется паттерн моторики,
соответственно, желудка и кишки.
Гастрины участвуют в одном
из механизмов согласованной регуляции двигательной активности отделов
пищеварительного тракта, что особенно важно при переходе пищи из желудка в
тонкую кишку. Кальцийзависимое воздействие на моторику пищеварительного тракта
связано также с усилением гастрином секреции ацетилхолина из терминалей
нейритов метасимпатической нервной системы, поскольку ацетилхолин является
важным компонентом локального контроля перистальтики. Вызванная гастрином так
называемая «голодная» перистальтика (например, в начальной фазе длительного
голодания при протеолизе собственных белков организма) приводит к активации
многочисленных механорецепторов пищеварительного тракта и брыжейки с
последующим повышением возбудимости ЦНС, активацией центра голода гипоталамуса
и запуском пищевого поведения. Возникновению при этом селективного белкового
аппетита способствуют увеличение концентрации свободных аминокислот в
периферической крови и церебральном кровотоке и, кроме того, связывание
гастрина рецепторами ЦНС.
Гастрин, помимо пищеварительной системы,
синтезируется во многих структурах обонятельного мозга, коре больших полушарий,
латеральном гипоталамусе и комплексе ядер блуждающего нерва. Рефлекторная
секреция в этих структурах гастрина в ответ на запах или вкус белковой пищи (реальные
или воображаемые по памяти) может стать также причиной селективного аппетита,
пищевого поведения и голодной перистальтики.
Холецистокинин (панкреозимин) синтезируется в интестинальных клетках, в собственной
пластинке тонкой кишки, а также в белой пульпе селезенки. Широко распространен
пептид в нервной системе (в том числе и в метасимпатических сплетениях тонкой
кишки) как нейротрансмиттер. В структурах головного мозга медиаторами чаще
являются фрагменты холецистокинина из 8 и 4 аминокислотных остатков. Лиганд—рецепторное
связывание приводит к активации фосфоинозитольной системы внутриклеточных
посредников и Са—зависимому увеличению моторики гладкомышечных стенок протоков
— жёлчного пузыря и поджелудочной железы.
Желчегонный
эффект холецистокинина обусловил и его название (от греч. chole — жёлчь, kystis — пузырь, kineo — двигать). Через рецепторы экзокринных
панкреатических клеток гормон усиливает секрецию липаз, протеаз и частично
электролитов. Роль холецистокинина в переваривании липидов сочетается с его
ключевой функцией в церебральной регуляции липидного аппетита и насыщения.
Увеличение концентрации свободных жирных кислот и триглицеридов в плазме крови
в результате эффектов гормона оказывает тормозное влияние на моторику
пищеварительного тракта и снижает возбудимость структур ЦНС с выраженным
сомногенным эффектом. Последний усиливается иммуноактивирующим воздействием
холецистокинина, поскольку цитокины иммунокомпетентных клеток ингибируют
активность церебральных центров.
В
лимфоидных органах пищеварительного тракта гормон активирует синтез
иммуноглобулинов: максимально IgA, а также — IgG, IgM, IgE. Некоторые из них могут встраиваться в слизевые
наложения тонкой кишки, что усиливает защиту организма от агрессивных
воздействий внешней среды на уровне наибольшего всасывания питательных веществ
в кровь, оттекающую к печени. Активность лимфоцитов пейеровых бляшек,
расположенных в этих же отделах кишки, повышается под прямым влиянием
холецистокинина и опосредованно, через усиление экзоцитоза других гормонов.
Семейство секретина и вазоактивного интестинального
полипептида (ВИП) более обширно,
гормоны имеют частичную молекулярную гомологию. В молекуле секретина
содержится 27 или более аминокислотных остатков. Он секретируется в
двенадцатиперстной и тощей кишке (S—клетки), а также в адено— и нейрогипофизе и
структурах ЦНС. Связывание высокоаффинных рецепторов сопровождается активацией
аденилатциклазной системы вторичных посредников. Это приводит к выделению
дофамина в медиальном возвышении и увеличению секреции пролактина и
лютеинизирующего гормона из аденогипофиза. В клетках экзокринной части поджелудочной железы
секретин стимулирует выделение бикарбонатов и воды, контролируя таким образом
объем панкреатического сока. В меньшей степени гормон влияет на секрецию
ферментов. В печени секретин увеличивает объем выделяемой жёлчи и содержание в
ней бикарбонатов и ионов хлора. Через эти эффекты секретин регулирует
бикарбонатную буферную систему регуляции рН в проксимальном отделе тонкой
кишки.
Вазоактивный
интестинальный полипептид в пищеварительной системе является не только
распространенным гормоном и парагормоном, но и медиатором метасимпатических и
парасимпатических волокон, иннервирующих различные структуры. Гормон этот
выделяют эндокриноциты слизистой оболочки нижней трети пищевода, антрального
отдела желудка, тонкой и прямой кишки, а также D1—клетки островков
Лангеранса поджелудочной железы (максимальная секреция), эпителий и нейроны
дыхательной системы. Гормон секретируется в гипоталамо—гипофизарной системе.
Как нейротрансмиттер он чаще совместно расположен с субстанцией Р и
ацетилхолином в структурах холинергической системы мозга, где, как и в нервно—мышечном
синапсе, облегчает постсинаптическое действие ацетилхолина. Из многочисленных
эффектов гормона в пищеварительной системе можно выделить антигастриновые и
проглюкагоновые. Кроме того, через свои рецепторы гормон в основном подавляет
функции Т— и В—лимфоцитов, моноцитов и нейтрофилов на уровне
иммунокомпетентных структур.
Таким
образом, все рассмотренные гормоны участвуют в контроле функций
пищеварительного тракта и пищеварительных желез, расположенных вне его, в
регуляции обмена веществ и функций головного мозга, а также иммунокомпетентных
органов и клеток.
Гормоны
пищеварительных желез, расположенных вне тракта, помимо регуляции его функций,
имеют собственную функциональную специфику, определяющую и отличия в
гормонопоэзе.
Гормоны
слюнных желез. В слюнных железах эндокринная функция присуща клеткам протокового
отдела. Первым был открыт гормон паротин, секретируемый в ответ на
поступление в полость рта углеводов. Этот гормон стимулирует секрецию клетками
экзокринной части поджелудочной железы ферментов, участвующих в дальнейшем
процессе гидролиза углеводов в тонкой кишке. Позже в подчелюстных слюнных железах
мышей был выявлен ряд факторов роста, регулирующих развитие структур нервной
системы (фактор роста нервов и фактор роста глии) и эпителиальных
структур экто— и нейроэктодермального происхождения (эпидермальный фактор
роста).
Пролактин, секретируемый в слюнных
железах, как и гипофизарный, регулирует продукцию электролитов и белка слюны в
ацинарной и, возможно, протоковой части органа, определяя основные параметры
жидкости. Другие паротидные гормоны регулируют локальное кровообращение слюнных
желез, слизистой оболочки рта и носоглотки, их болевую чувствительность,
секрецию лизоцима слюны, а также активность лимфоидных органов (миндалин),
синтез иммуноглобулинов.
Таким
образом, гормоны слюнных желез регулируют углеводный обмен, рост и развитие
нервной системы, а также иммунную защиту внутренних органов пищеварительной и
дыхательной систем на «границе» с агрессивной внешней средой.
Гормоны
печени.
Печень как эндокринный орган начинает функционировать сразу после закладки в
эмбриогенезе, секретируя различные факторы роста.
Секреция
обусловлена, прежде всего, тем, что орган является мишенью для основных
ростовых гормонов — инсулина, соматотропина, гонадотропинов и вырабатывает соматомедины. Синтез в печени
активинов, ингибина и других веществ свидетельствует о возможном участии органа
в формировании и функционировании репродуктивной системы, в частности, в
эмбриогенезе. С этим согласуются представления о половом диморфизме
метаболической функции печени. У женщин под влиянием пролактина образуется
лактогенный фактор печени, вызывающий лактацию.
Как
и поджелудочная железа, печень под влиянием панкреатических гормонов
продуцирует множество пищеварительных ферментов, а также гормонов желудка и
кишки, попадающих в печень с кровью, оттекающей от тонкой кишки. Большое количество
рецепторов в стенках сосудов печени и паренхиме способствуют интегральной
оценке таких параметров этой крови, как рН, осмотическое и онкотическое
давление, температура, концентрация глюкозы, свободных жирных и аминокислот.
Следует заметить, что рецепторные структуры сенсорных нервных волокон
обеспечивают рефлекторную совместную регуляцию функций печени, поджелудочной
железы, пищеварительного тракта и других физиологических систем организма.
Однако локально эти же факторы крови, непосредственно влияя на клетки печени,
воздействуют на такие функции органа, как термогенез, барьерная функция и
регуляция осмотического давления крови.
6.7. ГОРМОНЫ СЕРДЕЧНО—СОСУДИСТОЙ СИСТЕМЫ
Гормоны
сердечно—сосудистой системы регулируют объем жидкости и осмотическое давление
на разных уровнях организма: клеточном, тканевом, органном, системном. Насосную
функцию сердечно—сосудистой системы они стабилизируют посредством изменения
артериального давления, частоты сердечных сокращений, объема крови, сосудистого
тонуса, вазомоторных реакций. В капиллярах гормоны регулируют проницаемость
воды, ионов натрия, кальция и других осмотически активных веществ.
К числу структур сердечно—сосудистой
системы, синтезирующих гормоны, относятся сердце, эндотелий и гладкие мышцы
сосудов, плазма и клетки крови. Кроме того, сходные комплексы гормонов,
регулирующих те же параметры жидкостных сред организма, выявлены в кишке,
слюнных железах и других структурах, имеющих заполненные жидкостью полости. В
том числе они секретируются и в циркумвентрикулярных органах головного мозга,
регулируя объем ликвора, а также в сосудодвигательных центрах и центрах
питьевого поведения.
Представление
о сердце как об эндокринном органе возникло в начале 70—х гг. XX века на
основании открытия А. А. Галояном и соавторами кардиопептидов. Затем из ушек
правого предсердия был выделен первый представитель другого семейства гормонов
сердца: атриальный натрийуретический пептид (АНП), или гормон.
Натрийуретические
пептиды. Молекула АНП у
млекопитающих состоит из 27—28 аминокислот, однако известны и другие изоформы,
более распространенные у низших позвоночных и беспозвоночных. В настоящее время
известно, что у крыс и человека в сердце АНП секретируется популяцией
миоэндокринных клеток, которые Са2+— и механозависимо выделяют его
при растяжении правого предсердия и ушек венозной кровью. Предполагается, что
миоэндокринные клетки имеют механочувствительные Са2+—каналы в
плазмалемме. В
сердце крыс АНП секретируется и в отсутствие растяжения предсердия. Показана
также секреция родственного АНП гормона — натрийуретического пептида
желудочков сердца.
Из семейства
натрийуретических гормонов наиболее консервативным является С—тип, молекула
которого состоит из 22 аминокислот. Он синтезируется, главным образом, в
головном мозгу и почках. У позвоночных животных в плазме крови концентрация
гормона незначительна. К этому же семейству относятся гормон почек уродилатин
и мозговой натрийуретический пептид. Для структуры молекулы всех
натрийуретических гормонов характерно наличие кольца из 17 аминокислот.
Сходными эффектами являются активация гуанилатциклазы плазмалеммы, усиление
натрийуреза и сопряженного диуреза, регуляция артериального давления и компенсация
сердечной недостаточности. Значительное перекрытие функций натрийуретических
гормонов определяется не только сходством структуры их молекул, но и
перекрестной аффинностью к рецепторам.
Натрийуретические гормоны
являются связующим звеном между почками и сердцем, регулируя не только
экскрецию жидкости, но и перераспределение ее в организме сердечно—сосудистой
системой. Так, предотвращая возможное механическое повреждение сердца при
увеличении объема венозного возврата, АНП усиливает сокращения кардиомиоцитов.
Воздействие натрийуретических гормонов на миогенные пейсмекеры приводит к
увеличению частоты сердечных сокращений. Изгнанию крови из сердца способствует
и цГМФ—зависимая дилатация гладкомышечных структур стенки аорты. Снижение
артериального давления, увеличение диуреза и Na—уреза приводят к последующему
уменьшению венозного возврата в сердце.
Для АНП и в разной степени
для других натрийуретических гормонов характерно участие в регуляции объема
жидкости в малых и больших полостях организма, будь это полости желудочков
сердца или головного мозга, желудок, полость фолликула яичников или просвет
семенных канальцев и т. п. Те же эффекты определяют участие АНП в регуляции
объема клеток, как это показано для астроглии: гормон уменьшает их объем путем
подавления входа воды или увеличением ее выхода из клетки через регуляцию
активности Na+/H+—обменника, К+— и
Cl——каналов.
В центрах гипоталамуса
натрийуретические пептиды как медиаторы или гормоны подавляют (цГМФ— и NO—зависимо)
возбудимость центра жажды и снижают солевое предпочтение и жажду. Это
согласуется с общей направленностью эффектов гормонов этого семейства на
уменьшение объема жидкости в организме. Кроме того, установлено влияние АНП на
гормонопоэз в аденогипофизе. Оно может опосредоваться двояко: либо через
контроль микроциркуляции в медиальном возвышении, где оканчиваются содержащие
АНП аксоны либо в капиллярном сплетении аденогипофиза (портальный кровоток).
Атриопептины. Ранее отнесенные к
фрагментам молекулы АНП, атриопептины (кардиопептины) образуют другое семейство
кардиальных гормонов. Секретируемые при росте осмотического давления крови, они
выделяются из сердца и увеличивают системное артериальное давление. Кроме того,
для атриопептина III показано антидиуретическое действие.
Высокое содержание кардиопептинов
в паравентрикулярном, супраоптическом и преоптических ядрах гипоталамуса, в
циркумвентрикулярных органах указывает на возможность участия этих гормонов не
только в регуляций объема ликвора и микроциркуляции в структурах головного
мозга, но и в коррекции сосудодвигательными центрами и центрами регуляции жажды
объема жидкости в организме. При этом
реципрокное влияние натрийуретических гормонов и атриопептинов на секрецию
нейрогипофизарного вазопрессина может иметь место в других вазопрессин—секретирующих
структурах ЦНС. К ним, например, относятся ядра перегородки, собственное ядро
терминальной полоски, обонятельный мозг и другие. Следовательно, это может
определять влияние гормонов названных семейств на жажду и питьевое поведение,
сон и бодрствование, внутричерепное давление, память и общий уровень
возбудимости ЦНС. Показано прямое подавление, солевого аппетита и возбудимости
ЦНС при внутримозговом введении кардиопептинов.
В сердце секретируется также
релаксин — один из гормонов надсемейства инсулина. Как и инсулин, он
состоит из двух цепей А и В, связанных дисульфидным мостиком. У крыс
релаксин выделяется кардиомиоцитами правого предсердия и оказывает позитивный
хроно— и инотропный эффекты на сердце, увеличивая также системное артериальное
давление. В семенниках релаксин клеток Сертоли способствует поддержанию
оптимальной вязкости семенной жидкости. При родах, расслабляя связки лобкового
симфиза, гормон обеспечивает увеличение просвета родовых путей и успешное прохождение
по ним плода.
Эндотелиальные
клетки сосудов также выделяют ряд гормонов через базальную и апикальную
мембраны. Среди них тромб океаны, обладающие локальным вазомоторным
эффектом, лейкотриены и простагландины. Имеются и другие гормоны,
локально регулирующие тонус и просвет сосудов, их проницаемость, слипание и
активность иммунокомпетентных клеток, мигрирующих через стенки сосудов. В
последнее время привлекли внимание эндотелины, оксид азота, супероксид
кислорода и Н2O2. Эти вещества секретируются также в некоторых
эндокринных железах и, как медиаторы, нейронами разных отделов нервной системы.
Как и производные ненасыщенных жирных кислот, они обладают вазомоторными
эффектами. Кроме того, многие из этих гормонов являются источником кислорода,
что особенно важно при гипоксии. Последнее подтверждается усиленной секрецией NO, супероксида и гидроперекиси не только при гипоксии,
но и при действии других стрессорных факторов. Последующий локальный ацидоз
приводит к вазодилатации, синтезу адгезивных белков эндотелия и клеток крови,
трансэпителиальной миграции иммунокомпетентных клеток. Кроме того,
внутриклеточный ацидоз способствует эндоцитозу и адгезии к клеткам эндотелия
метастазирующих клеток.
Эндотелины. Эти гормоны были впервые выделены из эндотелия в
1988 г. Молекула эндотелина представляет собой пептид из 22 аминокислот.
Активность эндотелинов во всех тканях—мишенях определяет их кольцевая структура
и гидрофобные аминокислоты в С—терминали. Изоформы гормона ЕТ—1, ЕТ—2 и ЕТ—3
различаются по нескольким аминокислотам в кольцевой структуре, тогда как состав
С—конца молекулы постоянен. Транскрипция и трансляция про—ЕТ—1 в клетках
эндотелия активируются тромбином и вазопрессином.
Клетки
эндотелия — не единственный источник эндотелинов. Максимальные концентрации ЕТ—1
определяются в тканях легких и гипофизе, а ЕТ—3 в адено— и нейрогипофизе. Известны два типа рецепторов
эндотелинов: ETRA и ETRB, имеющих перекрестную
аффинность к ЕТ—1, —2, —3. В гладкомышечных клетках сосудов локализованы оба
типа рецепторов, тогда как в эндотелии, главным образом, ETRB. Кроме того, эти
рецепторы найдены в клетках легких, сердца, мозга, почках и надпочечниках.
Вазомоторные эффекты ЕТ—1 могут иметь разную направленность. Прямое действие
гормона через ETRA на гладкомышечные клетки
сосудов вызывает Са2+—зависимую вазоконстрикцию.
Запуск опосредованной
вазодилатации осуществляется при связывании с ETRB клеток эндотелия: гормон вызывает увеличение синтеза
NO и простагландина. Последние, выделяясь из эндотелия,
вызывают расслабление гладкомышечных клеток. Вазомоторные эффекты ЕТ—1
дополняются пролиферацией эндотелия и фибробластов, снижением агрегации
тромбоцитов, увеличением в сердце секреции АНП, активацией симпатической
нервной системы, что обусловило ино— и хронотропные влияния гормона на сердце.
В почках ЕТ—1 подавляет вызванный вазопрессином антидиурез, усиливает диурез и
натрийурез и снижает секрецию ренина.
Как медиаторы нервной
системы эндотелины являются одним из наиболее значимых факторов регуляции
мозгового кровотока, перераспределяя его между структурами с разной степенью
активности. Этим определяется их участие в некоторых формах поведения и
гормонопоэзе в гипофизе, где эндотелины изменяют секрецию вазопрессина,
окситоцина, пролактина, гонадотропинов.
Оксид азота (NO). Это
соединение является широко распространенным гормоном и медиатором в эндотелии,
гладких мышцах сосудов, макрофагах и нейтрофилах. Оно образуется под влиянием
энзима NO—синтеазы (NOS). Активация
NOS в сосудах и клетках крови происходит Са2+—зависимо
под влиянием растяжения стенки сосуда и при гипертензии может вызвать синтез NO. Механизмы опосредования действия перечисленных
факторов на увеличение Са2+ в клетке позволяют предполагать участие
в активации NOS—зависимого синтеза NO
механочувствительных Са2+—каналов или фосфоинозитольной системы
трансдукции гормонального сигнала.
Оксид азота обладает
выраженным вазодилататорным эффектом, обусловленным снижением рН. Как
нейротрансмиттер NO вызывает «неадренергическое,
нехолинергическое» торможение в метасимпатической нервной системе и ЦНС, а
также длительную синаптическую депрессию в мозжечке. Известно, что в ЦНС
возбуждающие аминокислоты, например, глутамат, активируют выделение NO из пресинаптической терминали и, таким образом,
включают звено отрицательной обратной связи, поскольку NO подавляет их секрецию.
NO может выполнять функцию
внутриклеточного посредника. Так, в нейронах NO блокирует действие цитохром—С—оксидазы —
терминального энзима в митохондриальной дыхательной цепи. Это может быть одной
из причин нейродегенеративных изменений, характерных для эффектов NO. Вазодилатация и снижение рН под влиянием оксида
азота, супероксида кислорода и гидроперекиси облегчает синтез адгезивных
белков, адгезию и трансэпителиальную миграцию лейкоцитов.
Ангиогенины. Эндотелий секретирует также и ряд факторов роста,
для которых одной из характерных функций является ангиогенез. К ним относятся васкулотропин,
монобутирин, тромбоспондин. В разной степени эти факторы участвуют в
пролиферации эндотелия, образовании трубки сосуда, синтезе коллагенов,
фибронектина, интегринов и других адгезивных белков, определяющих межклеточные
контакты в эндотелии, образование базальной мембраны и адгезию (прилипание) к
ней эндотелия. По—видимому, комплексы ангиогенинов могут быть органоспецифичны
и зависеть от типа сосуда и его диаметра.
Гормоны эндотелия,
обладающие реципрокным эффектом на гладкие мышцы сосудов, последовательно и
взаимосвязанно активируют синтез гормонов другой группы или их рецепторы.
Клетки эндотелия секретируют ряд хемотаксических факторов, что обеспечивает
адгезию, а также миграцию иммунокомпетентных клеток из сосуда в ткань. Сходство
комплексов цитокинов и арахидонатов, секретируемых клетками эндотелия и крови,
обеспечивает функциональное взаимодействие всех компонентов сосудистой системы
и системы крови в регуляции гемостаза и фибринолиза, рН плазмы, объема
локального кровотока, проницаемости капилляров и других параметров.
6.8. ГОРМОНЫ ПЛАЗМЫ И КЛЕТОК КРОВИ
Эти гормоны представлены синтезируемыми в плазме гормонами
двух систем: ренин—ангиотензиновой и калликреин—кининовой.
Гормоны ренин—ангиотензиновой системы. Они явились первыми, для которых был доказан синтез
в плазме крови. В основе их образования лежат ферментативные реакции каскадного
протеолиза. Синтезируемый в печени проренин под влиянием эстеразной субъединицы
фактора роста нервов превращается в активную сериновую протеазу крови — гормон ренин.
Изоформы ренина найдены во многих структурах: в гонадах, эфферентных артериолах
почечных клубочков, в гипофизе и клетках крупноклеточных ядер гипоталамуса.
Секреция ренина и его предшественника активируется паратгормоном, глюкагоном,
катехоламинами, тромбоксанами, простагландинами, снижением внеклеточного объема
жидкости. Подавление его секреции осуществляется ростом концентрации
внеклеточного калия, натрия, кальция, хлора (т. е. осмотически активных ионов),
уменьшением диаметра афферентных артериол почек и ростом внеклеточного объема
жидкости.
Высшие висцеральные центры в этом случае осуществляют
контроль за гормональной активностью через нисходящие пути, а также через
гормоны гипоталамо—гипофизарной системы: пролактин — через регуляцию
осмотического давления и водно—солевого обмена, кортикотропин — через усиление
секреции глюкокортикоидов, которые облегчают синтез ангиотензиногена в печени и
регулируют водно—солевой и углеводный обмены, катехоламинов, активирующих
секрецию вазопрессина и подавляющих синтез ренина в почках и пролактина в ЦНС.
В головной мозг гормоны ренин—ангиотензиновой системы
могут поступать к рецепторам клеток—мишеней из плазмы крови и ликвора как
медиаторы из пресинаптических окончаний. Они увеличивают возбудимость и через
катехоламин—, дофамин— и серотонинергические системы мозга участвуют в
регуляций памяти. Этому способствует и активация ангиотензином II (AT II) секреции вазопрессина. Оба гормона регулируют
секрецию ликвора и внутричерепное давление, жажду и питьевое поведение, однако
секреция вазопрессина преимущественно связана с изменением осмотического
давления плазмы крови, a AT II — ее объема.
Отмечены различия и в регуляции поведения: для
эффекта AT II на фоне сильной жажды характерно сочетание
питьевого поведения с подавлением чувства страха. В этих же условиях
вазопрессин способствует реализации питьевого поведения через активацию поисковой
деятельности и локомоций. Участвуя в реализации питьевой мотивации, AT II подавляет субдоминантное половое поведение. В
условиях оборонительной доминанты гормон усиливает моторную активность и
реакции избегания.
Увеличивая на периферии сосудистый тонус, гормоны
ренин—ангиотензиновой системы повышают системное артериальное давление. Этому
способствуют синтез AT II в
собирательных трубочках и юкстагломерулярном аппарате почек, где гормон
регулирует локальный кровоток, проницаемость и реабсорбцию электролитов и воды. Это
связано с вазоконстрикцией эфферентных артериол клубочков под влиянием AT II,
что приводит к усилению их кровенаполнения и увеличению объема первичной мочи,
росту проницаемости К+. В гломерулярной зоне коры надпочечников,
используя аналогичный механизм, AT II усиливает синтез
альдостерона. Гиперсекреция гормонов ренин—ангиотензиновой системы или же
недостаточная секреция и активность гормонов—антагонистов может быть одной из
причин почечной гипертензии.
Калликреин—кининовая
система. Калликреин
как сериновая протеаза плазмы крови осуществляет протеолиз предшественника
кининов — кининогена печени. Кроме того, калликреин известен как один из
ключевых факторов гемостаза. Семейство кининов невелико и включает всего два
гормона с достаточной для воздействия продолжительностью существования. Один из
них тонин, секретируемый в слюнных железах, другой — брадикинин,
источники секреции которого имеются практически во всех структурах организма,
где он может играть роль нейротрансмиттера и паракринного гормона.
Известны
три типа рецепторов брадикинина: Вг1, Вг2, ВгЗ. Они локализованы в гладких
мышцах сосудов, бронхов и трахеи, пищеварительного тракта, эндотелия, сенсорных
нейронов, макрофагов и полиморфоядерных нейтрофилов. На клетки гладких мышц
брадикинин преимущественно оказывает расслабляющее влияние. Это связано с
активацией К+—АТФ—чувствительных каналов, гиперполяризующих гладкие
мышцы сосудов с последующей вазодилатацией. Кроме того, локальные вазомоторные
эффекты сопряжены с активирующим действием гормона на хемотаксис (движение,
обусловленное различиями концентраций вещества) иммунокомпетентных клеток, их
активацией, а также с увеличением проницаемости сосудов. В почках это
обусловливает влияние брадикинина не только на локальный кровоток, но и на
почечную фильтрацию, благодаря дилатации афферентных артерий гломерул почек.
Как медиатор ноцицептивных сенсорных нейронов
брадикинин осуществляет первичный, срочный запуск защитных реакций в месте
повреждения:
гиперемию, хемотаксис и миграцию в поврежденные ткани
иммунокомпетентных клеток, фагоцитов. Связанный с этими эффектами локальный
пирогенез усиливает активацию мигрантов и снижает жизнедеятельность
«агрессоров». Эти же эффекты в определенных центрах нервной системы могут
определять участие брадикинина в запуске механизма сократительного термогенеза
(дрожи), терморегуляторного поведения и в других доминантно активированных
структурах. Среди эффектов брадикинина известно увеличение свертываемости
крови, выделение гистамина из тучных клеток кожи, легких, базофилов. Митогенный
эффект брадикинина направлен на регенерацию тканей.
В
почках гормоны калликреин—кининовой системы образуются в тубулярной системе
(гормоны ренин—ангиотензиновой системы — в корковом слое). Это позволяет
брадикинину прямо и опосредованно через секрецию простагландинов увеличивать
диурез и натрийурез.
Гормоны
обеих систем плазмы крови (ренин—ангиотензиновой и калликреин—кининовой) в
определенной мере являются антагонистами, реципрокно регулируя локальные
вазомоторные реакции. Возможно, они входят в число факторов, формирующих
функциональную дифференцированность сосудов на ангиотомы разных метамеров тела.
Взаимодействие двух систем гормонов обеспечивает смену типов вазомоторных
реакций в процессе гомеостатирования артериального давления. Клетки крови
вырабатывают также комплексы цитокинов и других гормонов (гистамина,
серотонина), регулирующих функции кроветворной системы. Пролиферация и
дифференцировка разных линий стволовых
клеток: эритроидной, лимфоидных и других контролируется в зависимости от стадии
их эволюции вариабельными комплексами гормонов.
В
целом, гормоны сердца, сосудов, плазмы и клеток крови взаимодействуют в
регуляции функций кардиоваскулярной системы, контролируя объем жидкости в
организме и крови в системе, артериальное и венозное системное давление, а
также локальный кровоток. Важным эффектом действия гормонов системы является
перераспределение крови между работающими и неработающими в данный момент
органами. Локальная секреция в этих же органах брадикинина, эндотелинов, NO облегчает действия гормонов сердечно—сосудистой
системы, поступающих с кровотоком.
6.9.
ГОРМОНОПОЭЗ И ОСНОВНЫЕ МЕХАНИЗМЫ ТРАНСДУКЦИИ ГОРМОНАЛЬНОГО СИГНАЛА
По химической структуре молекул гуморальные агенты
весьма разнообразны. Их основные группы представлены аминокислотами или
производными аминокислот (например, производные триптофана — индоламины,
тирозина — йодтиронины), белками и пептидами (гормоны гипофиза), а также
производными липидов (стероиды, ненасыщенные жирные кислоты и их метаболиты).
Функции гормонов могут также выполнять моноамины, глюкоза ионизированный
кальций, супероксид кислорода, оксиды азота и углерода, АТФ и другие вещества.
В зависимости от структуры молекулы и типа ткани пути гормонопоэза одного
гормона и уровни его регуляции могут различаться. Для белков и пептидов этапы
представлены экспрессией гена, синтезом и процессингом мРНК, синтезом молекулы
предшественника гормона и выведением молекулы из клетки. Комплекс вне— и
внутриклеточных факторов может определить уровень экспрессии гена
соответствующего гормона (полной или селективной) через активацию
транскрипционных факторов, регуляцию сборки комплекса инициации транскрипции
гена и т. д.
«Точкой
приложения» действия вне— и внутриклеточных факторов, определяющих быстрое
изменение секреции гормона, является механизм везикулярного и невезикулярного
экзоцитоза. Первый из них зависит от уровня ионов Са2+ в цитоплазме
и цистернах Гольджи, второй — от трансмембранного градиента рН. «Упаковка»
молекул гормона (чаще препро— или прогормона) в экзоцитозные везикулы
происходит при участии Са2+, Са—связывающих белков секрето— и
хромогранинов, частично попадающих с прогормоном в одну и ту же
везикулу. Эти полифункциональные кислые белки связывают также протеазы
осуществляющие протеолиз прогормона с образованием активной формы гормона
уже в экзоцитозной везикуле, транспортируемой к плазмалемме.
Поскольку транспорт
секреторных гранул везикул идет за Счет гидролиза ГТФ встроенными в их мембрану
мономерами ГТФ—связывающими белками то возможна также регуляция гормональных
молекул посредством изменения конфигурации ГТФ в клетке. Увеличение выхода Са2+
из того или иного депо под влиянием внеклеточного фактора может суммироваться с
предшествующим пиком свободного Са2+. Этим объясняется вероятностный
характер выделения гормона из клетки под влиянием одного и того же лиганда.
Гормон, синтезируемый в
клетке, может выделяться и другим способом невезикулярно. Так, для трансформирующего
фактора роста альфа, эпидермального фактора роста и фактора некроза опухолей
известно, что невезикулярное выделение гормона происходит путем протеолиза
молекул предшественников, которые встраиваются как интегральные белки в
плазмалемму.
Процессинг гормона в большинстве случаев не
заканчивается на клеточном уровне. В сосудах протеазы плазмы крови осуществляют
каскадный протеолиз молекул белковых и пептидных гормонов. Наличие энзимов и
протеолиз молекулы гормона как лиганда в сосудистой системе указывает на
сходство последней с громадной синаптической щелью, где эндокриноцит железы
является аналогом пресинаптической структуры, а клетки органа—мишени с
соответствующими рецепторами — постсинаптической. Поскольку эндотелий и другие
ткани сосуда выделяют энзимы и собственные гормоны, осуществляют
трансэпителиальный транспорт веществ, сосуд представляет собой также
функциональную аналогию протока эндокринных желез, не обладающих собственной
протоковой системой (гипофиз, щитовидная железа).
В
плазме крови протеолиз молекулы может быть заблокирован специальными
субъединицами гормона, защищающими его активный центр (например, в молекуле фактора
роста нервов), или белками—транспортерами. Последние синтезируются в печени
и транспортируют йодсодержащие гормоны щитовидной железы, стероиды и некоторые
белковые гормоны. Помимо того, возможен синтез гормона и его транспортера в
одной клетке. Например, гормон окситоцин и белок—носитель нейрофизин
кодируются разными экзонами одного гена и синтезируются в одних
окситоцинергических нейросекреторных клетках гипоталамуса. Белки—носители можно
рассматривать и как депо соответствующих гормонов в плазме крови, т. к. они
гомеостатируют оптимальный уровень активной формы гормона в сосудистом русле. В
ликворе протеазы отсутствуют, поэтому структура и активность нейропептидов в
нем сохраняется дольше, нежели в плазме крови.
Образование
гормонов липидной природы происходит с участием липидов мембран: холестерина,
ненасыщенных жирных кислот и их метаболитов. В стероидогенных тканях (коре
надпочечников) дальнейший синтез осуществляется под влиянием стероидных гидроксилаз,
специфичных для определенных групп гормонов. В этом случае в митохондриях
осуществляется энзимозависимое превращение холестерола в прегненолон, а
затем в прогестерон. Последний относится к гестагенам (или прогестинам)
и является прогормоном для глюко— и минералокортикоидов, андрогенов и
эстрогенов. Синтез гормонов каждой из групп осуществляется под влиянием
определенных ферментов, характерных для соответствующего типа
гормонпродуцирующих клеток надпочечников или гонад.
Исключительная
роль в гормонопоэзе отводится арахидоновой кислоте. Она выделяется
фосфолипазами из фосфолипидов мембраны и молекулы диацилглицерола. В
иммунокомпетентных клетках метаболизм арахидоновой кислоты идет последовательно
с образованием группы эндоперекисей классических простагландинов.
Ключевым энзимом этого пути метаболизма арахидоновой кислоты является 5—циклогеназа.
Считается, что арахидоновая кислота и ее производные являются по преимуществу
парагормонами, однако в плазме крови простагландины могут также транспортироваться
специфическими анионными белками.
В
эндокриноцитах, клетках эпителия, иммуннокомпетентных клетках возможен синтез и
выделение Одновременно нескольких веществ. Так, β—клетками поджелудочной
железы секретируются инсулин, ГАМК и ряд пептидных гормонов. В G—клетках
желудка — гастрин, кортикотропин, гормон роста и пролактин.
Известная Са2+— и потенциал—зависимость экзоцитоза этих гормонов
позволяет по аналогии с нейронами говорить о существовании феномена
«когормонов» и для гормон—продуцирующих клеток.
Механизмы действия гормонов
наиболее удобно рассмотреть на примере трех эндокринных клеток, секретирующих
гормоны в межклеточное пространство в непосредственной близости от капилляров
(рис. 6.31).
Рецептором называют молекулу (или их комплекс),
способную к концентрационно зависимому связыванию лиганда (гормон, медиатор) и
передаче сигнала об этом событии с его усилением и изменением (трансдукцией) к
внутриклеточным структурам. Взаимодействие гормона с внутриклеточным рецептором
представляется следующим образом (рис. 6.31). Гормон попадает в клетку через
плазматическую мембрану и взаимодействует с рецептором. Гормон—рецепторный
комплекс переносится в ядро и действует на синтез ДНК или же изменяет скорость
транскрипции и синтез информационной (матричной) РНК (мРНК). Увеличение или
уменьшение количества мРНК влияет на синтез белка в процессе трансляции, что
приводит к изменению функциональной активности клетки.
Активность рецептора
характеризуется сродством (специфичностью связывания) к лиганду и способностью
воздействовать на эффекторные механизмы клетки прямо или через молекулы—посредники.
Большинство известных рецепторов является белками, фосфо— или гликопротеинами,
имеющими один участок связывания определенного лиганда.
Для каждого из гормонов
известны несколько типов рецепторов, локализованных преимущественно в клетках
разных органов—мишеней. Это во многих случаях связано со сменой механизма
трансдукции гормонального сигнала или системы инактивации рецептора. Например,
глутамат, наиболее распространенный возбуждающий нейротрансмиттер, через метил—П—аспартат
(NMDA)—рецептор, ионный канал, вызывает быстрые реакции нейронов.
Другой тип рецепторов глутамата, метаботропический (mGluR), сопряжен с ГТФ—связывающими
белками и опосредует более медленные реакции через системы внутриклеточных
посредников.
Эффекты лиганд—рецепторного взаимодействия в
значительной степени определены локализацией рецептора, который может
находиться в плазмалемме и внутриклеточных мембранах, цитозоле и нуклеоплазме
(рис. 6.32). При
|
|
|
Рис. 6.31 Механизм
действия гормонов |
|
|
|
Рис. 6.32 Механизм
действия стероидных гормонов Ра и Рб — две субъединицы рецептора; Г —
гормон. |
эндоцитозе лиганд—рецепторного
комплекса гормон может попадать в клетку и эффекты мембранного уровня
дополняются внутриклеточными.
Известно,
что одновременно на клетку могут действовать многие вещества, взаимодействуя с
разными рецепторами и определяя таким образом вероятностный характер итоговой
реакции. Однако существует множество факторов, увеличивающих вероятность
определенного функционально значимого ответа клетки через выделение и усиление
наиболее значимого сигнала, регламентацию длительности его воздействия и определение
последовательности событий на мембране и в клетке. К таким факторам,
действующим на уровне мембраны, относят локальные значения: потенциала
мембраны, градиентов рН, осмотического давления и ионов.
Избирательному
усилению действия одного из сигналов может способствовать и увеличение числа
определенных рецепторов под влиянием повторяющихся воздействий данного гормона
либо вследствие предварительного воздействия другого. Например, эстрадиол
влияет на экспрессию генов и синтез рецепторов к окситоцину и базальному
фактору роста фибробластов, что затем приводит к повышению эффективности
действия этих гормонов. Увеличение числа рецепторов приводит к образованию их
групп (кластеров) благодаря латеральной диффузии молекул в плазмалемме,
действию белков кластрирования, рецептор—зависимому фосфорилированию белковых
факторов кластеризации. Для рецепторов факторов роста в таких кластерах
показана возможность взаимного фосфорилирования. Сходная кластеризация описана
и для хемочувствительных ионных каналов, активируемых гормонами. По механизмам,
опосредующим эффекты связывания лиганда и рецептора, выделены три основные типа
рецепторов, локализованных в клеточной мембране.
Рецепторы
I типа
представлены хемочувствительными ионными каналами, одна из субъединиц которого
обладает способностью связывать лиганд. Так, для медиатора нервной системы и
парагормона многих эндокринных желез ГАМК известен рецептор А—типа, α—субъединица
которого имеет консервативный трансмембранный домен М II, содержащий ряд
остатков аминокислот Thr и Ser и составляющий основу Cl——канала или водной поры. Его
другие субъединицы выполняют рецептивные функции. В результате лиганд—рецепторного
взаимодействия ионы хлора входят в клетку и гиперполяризуют мембрану, а
сопряженный транспорт воды участвует в регуляции объема и осмотического
давления в клетке.
Рецепторы
II типа —
интегральные белки с семью трансмембранными доменами. Участок внутриклеточного
С—конца молекулы рецептора и одна из внутриклеточных петель (чаще третья)
сопряжены с одной из трех (а) субъединиц ГТФ/ГДФ—связывающего (G)
белка
клеточной мембраны. Связывание гормона приводит к рецептор—зависимой активации
внутриклеточных факторов, обусловливающих замену ГДФ на ГТФ в неактивном
комплексе ГДФ/α—субъединица. При этом две другие субъединицы G—белка
((β и γ) диссоциируют от комплекса и могут воздействовать на ионные
каналы мембраны. Другая группа внутриклеточных факторов (ГТФаз—активирующие
белки, GAP) активирует энзиматические
свойства α—субъединицы, и она как ГТФаза отщепляет фосфатную группу от
ГТФ. Выделяемая при этом энергия идет на фосфорилирование энзимов, а также
белков цитоскелета и других белков.
Разные
изоформы α—субъединицы гетеротримерных G—белков клеточных мембран
воздействуют на определенные энзимы, запуская соответствующие каскады
посредников. Таким образом осуществляется передача, усиление и трансформация
сигнала, кодируемого гормоном или другим лигандом.
|
|
|
Рис. 6.33 Механизм
проведения гормонального сигнала в клетке при участии вторичных посредников Gs
— Gs—белок, G1 — Gi—белок, Gq — Gq—белок; ИФЗ — инозитолтрифосфат, КМ —
кальмодулин, Ф — фосфат; α1, α2, β — субтипы рецепторов. |
В аденилатциклазной системе рецептор—зависимая
активация Gs—белка приводит к активации энзима мембраны аденилатциклазы,
которая конвертирует АТФ в цАМФ (рис. 6.33). Последняя фосфорилирует
цитоплазматические белки. Один из них — цАМФ—зависимая протеинкиназа А
(РКА), каскадно—фосфорилирующая по остаткам Ser и Thr молекулы других белков,
выполняющих разнообразные функции.
Рецептор—зависимая активация Gi—белка (его G2i
изоформы) приводит к подавлению активности аденилатциклазы. Фосфорилирование
α—субъединицы G2i по Ser144 (серин—треониновой
протеинкиназой С, активированной, например, действием гормона вазопрессина)
блокирует тормозные эффекты Gi в гепатоцитах и
тромбоцитах. Аденилатциклазную систему вторичных посредников могут подавлять
также фосфодиэстераза, превращающая цАМФ в быстро гидролизируемый мономер,
и лиганды, активирующие гуанилатциклазную систему.
В гуанилатциклазной системе соответствующий энзим,
конвертирующий ГТФ в цГМФ, представлен двумя пулами: мембранной и цитоплазматической
гуанилатциклазами. В плазмалемме энзим может быть компонентом рецептора
(например, рецептора атриального натрийуретического гормона) или сопряжен с G—белком.
Цитозольная гуанилатциклаза также обладает рецепторными функциями,
акцептируя такое вещество, как оксид азота (NO). В обоих случаях лиганд—рецепторное
взаимодействие приводит к активации энзима и увеличению внутриклеточной
концентрации цГМФ. Последняя, как и цГМФ—зависимая протеинкиназа G
(PKG), подавляет активность аденилатциклазы и рецептор—зависимое
увеличение уровня Са2+ проницаемость К+ каналов и
увеличивает вход ионов К+ в клетку, способствуя гиперполяризации
плазмалеммы. Содержание цГМФ в цитоплазме регулируется разными механизмами,
одним из которых является активация фосфодиэстеразы.
В запуске фосфоинозитидной системы участвуют Gq—белки,
активирующие мембранные изоформы фосфолипазы. С (ФЛС бета) и Са2+—ионные
каналы плазмалеммы. Энзим является фосфоинозитидспецифичным и превращает
инозитолдифосфат мембраны в трифосфат. Другим продуктом гидролиза является
диацилглицерол, имеющий в боковой цепи арахидоновую кислоту. Вход Са2+
в клетку изменяет конформационную структуру рецепторов в мембранах
внутриклеточных депо катиона. При взаимодействии с инозитолтрифосфатом рецептор
приобретает функции Са2+—чувствительного Са2+—канала,
через который ион выходит из депо в цитоплазму. При увеличении концентрации
свободного Ca2+ в цитоплазме он акцептируется многими Са—связывающими
белками.
Среди Са2+—связывающих белков важен кальмодулин
(СаМ), молекула которого, акцептируя Ca2+, способна активировать специфические
киназы. Среди них наиболее полифункциональна СаСаМ—зависимая киназа II,
фосфорилирующая Na+/Н+ обменник и
играющая одну из ключевых ролей в секреторном процессе и регуляции концентрации
внутриклеточного Са2+ Воздействие ряда гормонов на тонус и
сокращение гладких и поперечнополосатых мышц через систему Gq—белков
обусловлено активацией Са—связывающих сократительных белков. Известная роль Ca2+
в регуляции рН цитозоля, транспорта и цитоскелета также подчеркивает важность
фосфоинозитидной системы, регулируемой через Gq—белки, сопряженные с
рецепторами.
Арахидонатная система вторичных посредников, связанная
с выделением из фосфолипидов мембраны и метаболизмом арахидоновой кислоты,
активируется другой группой G—белков — Gpia. Арахидоновая кислота
участвует в гиперполяризации клеточных мембран через ингибирование
деполяризующих Na+— и медленных Са2+—каналов,
а также через активацию гиперполяризующих К+—каналов. Ингибирование
GAP—белков арахидоновой и фосфатидиловой кислотами дополняет перечень их
тормозных эффектов в отношении других систем вторичных посредников.
Рецепторы III типа характерны для инсулина, факторов роста и цитокинов.
Они представляют собой рецептор и энзим одновременно, поскольку внеклеточный
домен интегральной молекулы содержит последовательность аминокислотных
остатков, связывающих определенный лиганд, а цитозольный С—конец содержит
области (домены) с киназными свойствами. Эти особенности рецептора обеспечивают
быстроту передачи сигнала о связывании гормона на внутриклеточные структуры.
Благодаря кластеризации мономерных рецепторов или же существованию стойких гомо—
или гетеродимерных молекулярных конструкций интенсивность воздействия лиганда
усиливается.
Энзиматические домены у рецепторов пролиферативных
гормонов представлены по преимуществу протеинтирозинкиназами (РТК), а у
рецепторов цитокинов могут быть и серин—треониновыми. Связывание гормона
приводит к изменению конформационной структуры и аутофосфорилированию молекулы
рецептора. Это позволяет ему затем фосфорилировать мембранные белки: энзимы,
другие типы рецепторов, ионные каналы, G—белки (соответственно по Туr или по
Ser и Thr), и изменять их активность. Кроме того, возможно
фосфорилирование цитозольных протеинкиназ с иными свойствами, а также других
энзимов и транскрипционных факторов. Совокупность этих белков представляет
систему трансдукции, обусловливающую полиэффекторные и быстрые воздействия
гормона.
В настоящее время для рецепторов факторов роста и
цитокинов также описаны системы внутриклеточных посредников.
В запуске тех или иных клеточных реакций, будь это
процессы синтеза, клеточного цикла или апоптоза, могут участвовать разные
системы внутриклеточной трансдукции сигнала. Внутриклеточные рецепторы
связывают те гормоны, которые посредством эндоцитоза, диффузии или мембранных
транспортеров могут поступать в клетку (рис. 6.34).
Гормон—рецепторный комплекс переносится в ядро и действует на синтез ДНК, изменяя скорость транскрипции и количество мРНК. Увеличение или уменьшение количества мРНК влияет на синтез белка в процессе трансляции, что приводит к изменению функциональной активности клетки.
Для оксида азота, например, гормона или трансмиттера,
характерно связывание с цитозольной гуанилатциклазой, представляющей
собой его рецептор. Цитозольные рецепторы гормонов стероидной природы,
ретиноидов и йод—содержащих тиреоидных гормонов представляют собой сложные
макромолекулы гликофосфопротеинов. Гормон—связывающий домен является
протеинкиназой, активируемой после связывания гормона и фосфорилирующей
транскрипционные факторы.
|
|
|
Рис. 6.34 Взаимодействие гормона с внутриклеточным
рецептором |
Расположенный ближе к N—концу рецептора ДНК—связывающий
домен имеет «выпетления» аминокислотных последовательностей, соединенных с
атомом цинка (так называемые «цинковые пальцы»). В цитоплазме они «закрыты» белками
теплового шока, транспортирующими лиганд—рецепторный комплекс в ядро. В
ядре цинковые пальцы обеспечивают узнавание специфического для данного
рецептора участка связывания с ДНК и взаимодействие с ним. Он представляет
собой сдвоенную (прямую или инвертированную) гормон—респонсивную нуклеотидную
последовательность в области промотора определенного гена. Чаще с ней
связывается сдвоенный лиганд—рецепторный комплекс. Следующий за этим запуск
процесса транскрипции гена может быть усилен, если образуется не гомодимер, что
характерно для стероидов, а гетеродимер (например, рецептора тироксина и цис—ретиноевой
кислоты).
Гормон—респонсивная
нуклеотидная последовательность может не только стимулировать, но и подавлять
экспрессию гена (например, рецептор глюкокортикостероидов ингибирует ген
кортиколиберина). Сходное действие описано и для мономера рецептора тироксина в
отсутствие гормона, тогда как связывание лиганда и последующая димеризация
комплекса приводит к противоположному эффекту.
Таким
образом, гормоны, как и трансмиттеры, через разные типы рецепторов систем
внутриклеточной трансдукции сигнала более или менее быстро реализуют свои
эффекты на уровне клеточной мембраны, органелл и цитоплазмы, а также ядра.
Специфика условий синтеза рецепторов и гормонов в разных тканях обусловливает
различие в них типов рецепторов к одному лиганду и, соответственно, возможность
разных эффектов.
Для поддержания гомеостаза и осуществления основных
жизненных функций в эволюции возникли две основные системы: нервная и эндокринная,
— работающие во взаимодействии между собой при осуществлении интегративной
деятельности.
Гормоны вырабатываются в
эндокринных железах, не имеющих выводных протоков, или в группах клеток с
эндокринной функцией в пределах разных органов и поступают в циркулирующие
жидкости организма. Для гормонов характерны дистантное действие и способность
вызывать специфическую активность, воздействуя на рецепторы эффекторных органов
и тканей—мишеней в низких концентрациях.
В нервной системе беспозвоночных и позвоночных
животных находятся нейросекреторные клетки, в которых вырабатываются
гормоны, регулирующие различные функции организма и стимулирующие синтез и
секрецию гормонов эндокринными железами.
У позвоночных животных регулирующее влияние ЦНС на
физиологическую активность эндокринных желез осуществляется через
нейросекреторные центры гипоталамо—гипофизарной системы.
Висцеротропные гормоны — это олигопептиды,
поступающие в основном в общую циркуляцию. Антидиуретический гормон
(вазопрессин) оказывает влияние на функцию почек, на уровень кровяного давления
и имеет ряд других эффектов, окситоцин влияет на гладкую мускулатуру матки,
секрецию молока.
Гипофизотропные гормоны (олигопептиды) поступают в
основном в ток портальной крови. Либерины (рилизинг—гормоны) оказывают
стимулирующее влияние на функцию железистых клеток гипофиза, статины
(ингибирующие факторы) тормозят их функцию. В гипоталамусе вырабатываются шесть
либеринов и три статина.
Гипофиз состоит из двух основных компонентов: нейрогипофиза и
железистой части, или аденогипофиза. В клетках аденогипофиза под действием
гипофизотропных факторов гипоталамуса вырабатываются гормоны, оказывающие
тропное действие на периферические железы.
Эффекторные гормоны (три из семи) оказывают непосредственное влияние на
органы— или ткани—мишени. К ним относятся гормон роста, влияющий на растущие
органы и ткани, пролактин, регулирующий развитие и функцию молочной железы, меланоцитостимулирующий
гормон, действующий на функцию пигментных клеток—меланофоров. Тропные
гормоны гипофиза (четыре из семи) влияют на эндокринные железы II порядка,
стимулируя их функцию. Кортикотропин регулирует синтез и секрецию
кортикостероидов корой надпочечника. Тиреотропный гормон оказывает
стимулирующее влияние на щитовидную железу, в которой происходит выработка
трийодтиронина (T3) и тироксина (Т4). Гонадотропные гормоны стимулируют
секрецию половых стероидов стероидогенной тканью гонад. Функция системы
гормональных взаимодействий осуществляется с использованием механизма обратной
связи.
Кроме гормонов, образующихся в гипофизе и в
эндокринных железах II порядка, в организме вырабатываются гормоны, синтез
которых не зависит от непосредственного регулирующего влияния гипофиза. К этим
гормонам относятся адреналин и норадреналин, синтезируемые в
мозговом веществе надпочечников, паратгормон, образующийся в
паращитовидных железах, кальцитонин, вырабатываемый в
ультимобранхиальных железах (С—клетки щитовидной железы млекопитающих), а также
ряд гормонов поджелудочной железы.
В отсутствие регуляции со стороны гипоталамуса и
гипофиза для обеспечения гомеостаза и поддержания на оптимальном уровне всех
параметров внутренней среды организма в систему регуляции включаются гормоны—антагонисты
и различные метаболиты (глюкоза, жирные кислоты, ионы и т. д.).
В желудочно—кишечном тракте вырабатываются пептиды,
выполняющие роль гормонов. В настоящее время для ряда гормонов установлена
множественная локализация синтеза, так, например, гастрин и холецистокинин,
являющиеся гормонами желудочно—кишечного тракта, обнаружены в мозгу; значение
подобных явлений требует дальнейшего анализа. В процессе эволюции гормоны, по—видимому,
возникли до образования эндокринных желез. В дальнейшем произошло развитие
сложной системы нейро—гормональных взаимодействий, в состав которой вошли
нейросекреторные элементы с вырабатываемыми ими гормонами, а также гормоны
специализированных эндокринных желез. В результате образовался единый механизм
регуляции, обеспечивающий деятельность организма.
Бакл Дж. Гормоны
животных. М., 1986.
Балаболкин
М. И. Эндокринология. М., 1989.
Биохимия
гормонов и гормональной регуляции / Отв. ред. Н. А. Юдаев. М., 1976.
Држевецкая
И. А. Основы физиологии обмена веществ и эндокринной системы. М.,
1994.
Елецкий Ю.
К.. Яглов В. В. Эволюция структурной организации эндокринной части
поджелудочной железы позвоночных. М., 1978.
Мицкевич М.
С. Гормональные регуляции в онтогенезе животных. М., 1978.
Потемкин В.
В. Эндокринология. М., 1999.
Розен В. Б. Основы
эндокринологии. М., 1994.
Смиттен
Н.А. Симпато—адреналовая система в фило— и онтогенезе
позвоночных. М., 1972.
Физиология
человека. В 4 т. М., 1985. Т. 4. Обмен веществ. Пищеварение. Выделение.
Эндокринная секреция. М., 1986.
Физиология
эндокринной системы / Отв. ред. В. Г. Баранов. Л., 1979. (Руководство по
физиологии).
Чернышева М. П. Гормоны животных: Введение
в физиологическую эндокринологию. СПб., 1995.
Шмидт—Ниельсен К. Физиология животных.
Приспособление и среда. В 2 кн. М., 1982.
Эволюционная физиология. В 2—х
ч. / Отв. ред. Е. М. Крепе. Л., 1983. Ч. 2. (Руководство по физиологии).