15 ФИЗИОЛОГИЯ СТАРЕНИЯ
IV в. до н. э. —
Аристотель (Древняя Греция) отметил связь между продолжительностью жизни
организмов и протяженностью периода их роста (соотношение 5—6 : 1).
II в. — Вей Поян (Wei Po—Yang, Китай) первым высказал идею о
существовании «философского камня»,
который должен превращать другие металлы в золото и давать человеку вечную
молодость. Этот эликсир алхимики искали на протяжении многих веков.
XVII в. — X. Гюйгенс (Ch. Huygens, Нидерланды) впервые рассчитал
среднюю продолжительность жизни.
1817 — Дж. Паркинсон (J. Parkinson, Великобритания) дал описание
болезни пожилых людей, внешние проявления которой— тремор головы и конечностей,
нарушение походки и речи (болезнь Паркинсона).
1825 — Б. Гомпертц (В. Gompertz, Великобритания) показал, что
смертность растет с возрастом в геометрической прогрессии и дал математическое
выражение этой зависимости.
1860 — У. Мейкем (W. Makeham, Великобритания) сформулировал
уравнение, описывающее динамику смертности. Это уравнение (Гомпертца—Мейкема) и
сейчас широко применяется в геронтологии.
1882 — А. Вейсманн (A. Weismann, Германия) предположил, что продолжительность жизни
обусловлена ограниченной способностью соматических клеток к размножению.
1889 — Ш. Браун—Секар (Ch. Brown—Sequard, Франция) в опытах на себе показал,
что введение вытяжек из семенников животных приводит к временному омоложению.
1903 — И. И. Мечников (Россия) в «Этюдах о
природе человека» причиной старения назвал отравление организма продуктами
жизнедеятельность кишечной микрофлоры.
1904 — О. Вернер (О. Werner, Германия) описал прогерию взрослых
(синдром Вернера) — наследственное заболевание, проявляющееся тем, что задолго
до наступления пожилого возраста формируются характерные для старческого
организма нарушения (катаракта, атрофия эпидермиса и скелетных мышц, сахарный
диабет и т. д.).
1907 — А.
Альцгеймер (A. Alzheimer, Германия) описал старческое слабоумие (болезнь
Альцгеймера).
1908 — М. Рубнер
(М. Rubner, Германия), сравнивая животных разных видов, обнаружил обратную
зависимость между продолжительностью жизни и интенсивностью метаболизма.
1912 — А. Каррель (A. Carrel, Франция) заявил, что клетки
многоклеточного организма могут размножаться in vitro неограниченно (потенциальное
бессмертие соматических клеток), отвергнув гипотезу Вейсманна.
1940 — А. А. Богомолец (СССР) первопричину старения определил как изменение
соединительной ткани, связанное с потерей коллоидами своих свойств.
1955 — Ф. Верцар (F. Verzar, Швейцария) создал теорию поперечных сшивок:
причиной старения являются дисульфидные мостики, возникающие в макромолекулах и
ограничивающие их функции.
1956 — Д. Харман
(D. Harman, США) создал теорию свободных
радикалов, повреждающих ДНК и тем самым вызывающих старение.
1959 — Л. Силард (Сцилард, L. Szilard, США) предложил теорию, согласно
которой причиной старения является радиационное повреждение хромосом.
1964 — Л. Хейфлик (L. Hayflick, США) показал, что клетки,
полученные из многоклеточного организма (фибробласты человека), in vitro претерпевают ограниченное число
делений, после чего погибают (возврат к взглядам Вейсманна).
1969 — Р. Уолфорд (R. Walford, США) создал иммунологическую
теорию старения: программированные изменения клеток иммунной системы
детерминируют максимальную продолжительность жизни.
1990—е — Бурное развитие исследований,
направленных на продление активной жизни человека. При Российской академии наук
создается Геронтологическое общество, возникают специализированные кафедры,
центры и институты, проводятся Всероссийские съезды и Международные конгрессы
геронтологов и гериатров.
Задачей биологии старения является
выяснение первичных механизмов, установление их взаимосвязи в процессе
жизнедеятельности организма, определение возрастных особенностей адаптации
организма к окружающей среде.
15.1. ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ И ПРЕДМЕТ ФИЗИОЛОГИИ СТАРЕНИЯ
Человек — единственное существо,
знающее о неизбежности своей смерти. Его естественное неприятие этой мысли
привело к бесчисленным попыткам найти эликсир бессмертия. Первый по времени
появления из известных литературных источников — «Легенда о Гильгамеше» (Шумер,
ок. 2000 г. до н. э.) — посвящен именно этому сюжету. Вместо достижения
бессмертия человечество добилось значительного увеличения средней
продолжительности жизни. Если в доисторические времена она равнялась
примерно 20 годам, от Средних веков до XIX в. — 30, то к началу XX в. успехи медицины
(главным образом — в предупреждении инфекционных болезней), увеличили среднюю
продолжительность жизни человека до 45 лет. Сейчас в благополучных обществах
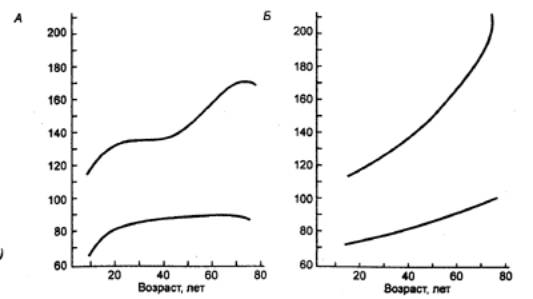
она составляет примерно 75 лет для мужчин и 80 — для женщин (рис. 15.1).
Таким образом, в некоторых странах
продолжительность жизни за последние полтора столетия возросла в 2,5 раза, и
возникла новая проблема — старение населения. Так, в США уже сейчас возраст 3
млн граждан превышает 85 лет, и ожидается, что
к 2020 г. их будет вдвое больше.
|
|
|
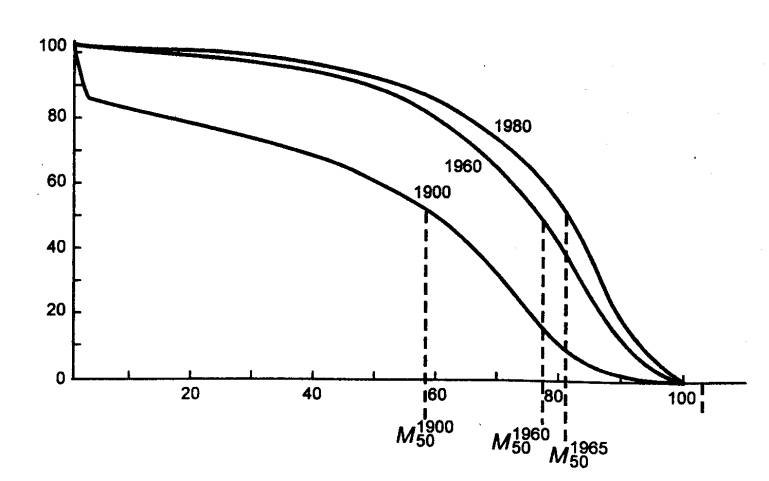
Рис. 15.1 Увеличение продолжительности жизни в XX веке (женщины, жительницы
развитых стран) Кривая
выживаемости составлена в процентах от числа всех родившихся. М50 — средняя
продолжительность жизни, то есть возраст, в котором половина родившихся еще
жива. Видно постепенное увеличение этого показателя по мере повышения
качества жизни. |
Целью физиологии старения и гериатрии (от греч. geron — старик и iatreia — лечение) является обеспечение человеку возможности активной
жизни до 80 лет.
Согласно классификации возрастов ВОЗ, «старостью» называется
только промежуток жизни между 75—м и 90—м годами жизни. До достижения 75—летнего
возраста человек именуется «пожилым».
Заметим, что наибольшая продолжительность жизни среди
животных составляет от 60—80 (слон) до 150 лет (черепахи). Продолжительность
жизни животных часто выражается экспоненциальной зависимостью (рис. 15.2).
Теоретически предметом физиологии старения является только
здоровый организм человека или животного. Все случаи хронических заболеваний
исключаются. Однако смерть от старости, если она вообще имеет место, явление
очень редкое: практически каждый организм умирает от приобретенных болезней, но
не от самого факта старения и изнашивания. Подсчитано, что если бы были
устранены заболевания сердечно—сосудистой системы и рак, то половина людей
могла бы дожить почти до 100 лет. На этом основан второй, реалистический,
подход, в соответствии с которым физиология старения изучает всех индивидов,
достигших преклонного Возраста.
Теории старения. Единой теории старения до сих пор не создано (табл. 15.1).
Существующие теории (которые правильнее было бы называть гипотезами)
объединяются в две большие группы — генетическую и негенетическую.
Сторонники первых считают, что причина старения — в изменении информации,
передаваемой от ДНК к синтезируемым в организме белкам. Другая, негенетическая,
группа теорий утверждает, что синтез белковых и прочих молекул в течение всей
жизни происходит в основном правильно и только потом эти молекулы повреждаются
в результате воздействия факторов внешней среды;
накопление
таких повреждений и составляет суть процесса старения.
Генетические теории. Один из вариантов генетической теории предполагает
существование специальных генов старения. В соответствии с этими взглядами,
суть процесса старения — не в нарушении генетической информации, а в том, что в
определенный момент жизни экспрессируются соответствующие гены и начинается
осуществление изначально заложенной программы старения.
Подобное предположение можно обосновать тем, что удлинение
индивидуальной жизни организмов при ограниченности пищевой базы вида
препятствовало бы развитию новых организмов и тем самым задерживало бы процессы
изменчивости и приспособления вида к меняющимся условиям внешней среды. Впервые
подобную мысль высказал А. Вейсманн в 1891 г. Ранее он предложил искать причины
старения на клеточном уровне.
У человека описано наследственное заболевание — прогерия
(от греч. progeros — преждевременно состарившийся) взрослых, или
синдром Вернера, при котором задолго до наступления пожилого возраста
формируются такие характерные для старческого организма нарушения, как
катаракта, артериосклероз, сахарный диабет, злокачественные опухоли, поседение
и атрофия кожи. Синдром Вернера можно рассматривать как генетическую
Таблица 15.1
Теории старения
|
Теория |
Главная
идея |
Современное
состояние |
|
Измененных
белков |
Происходящие
со временем претрансляционные изменения в молекулах меняют их конформацию и ферментативную
активность, работа клетки нарушается |
Подтверждена,
точный механизм неясен |
|
Соматических
мутаций |
Соматические
мутации изменяют генетическую информацию и снижают эффективность работы
клетки до уровня ее гибели |
В нескольких
случаях не подтверждена, но образование опухолей по крайней мере отчасти —
результат соматических мутаций |
|
Повреждения
и восстановления ДНК |
В клетке
есть механизмы, восстанавливающие ДНК после ее повреждений. По мере старения
эффективность восстановления снижается |
Подтверждена,
точно роль этих механизмов не известна |
|
Катастрофы ошибок |
Нарушение
транскрипции и/или трансляции снижает эффективность работы клетки до уровня
ее гибели. |
Не подтверждена,
но в измененном виде соответствует некоторым фактам |
|
Дисдифферен—циации |
Нарушение
механизмов активации/репрессии генов приводит к синтезу ненужных белков, что
снижает эффективность работы клетки до уровня ее гибели |
Вероятна |
|
Окислительного
повреждения, или свободных радикалов |
Продолжительность
жизни обратно пропорциональна степени окислительного повреждения и прямо
пропорциональна активности антиоксидантной защиты. |
Подтверждена
в некоторых случаях, возможна — и во многих других |
|
Накопления
отходов (метаболи—тов) |
Отходы
обмена веществ (метаболиты) накапливаются в клетке и снижают эффективность
ее работы до уровня гибели, если они не удаляются или не растворяются при
делении клетки |
Возможна,
особенно в новой интерпретации, но мало вероятна |
|
Посттрансляционных
изменений в белках |
Со
време.нем происходит химическая модификация важных молекул (например,
коллагена), что нарушает функции клетки и снижает эффективность работы организма
до уровня его гибели. Поперечные сшивки в молекулах белка — часть этого
механизма |
Подтверждена |
|
«Носилось
и износилось» |
Повреждения
тканей происходят ежедневно в процессе нормальной жизни. Они нарушают работу
организма до уровня его гибели |
Подтверждена
в ограниченном числе случаев (например, потеря зубов ведет к голоданию). В
измененном виде стали частью других теорий |
|
Метаболические
теории |
Продолжительность
жизни обратно пропорциональна величине основного обмена |
В исходном
виде опровергнуты, превращенные в теорию свободных радикалов, возможно,
верны |
|
Генетические
теории |
Изменения
в экспрессии генов вызывают соответствующие изменения в клетках.
Предполагается участие множества меха— внутри— и
межклеточном уровнях. |
Подтверждены,
но нет единого генетического механизма |
|
Апоптоза |
Программированное
самоубийство клеток вызывается внеклеточными командами Старые
клетки несут на себе белки, но фаги, опознают их и уничтожают. |
Подтверждена.
Неспособность вызвать или подавить апоптоз, возможно, ответственна за многие
заболевания. Роль в здоровом старении неясна Подтверждена
для ограниченного числа случаев |
|
Нейроэндокринные теории |
Нарушения в клетках, выполняющих специфические интегративные функции,
ведут к нарушению гомеостаза, старению и смерти |
Подтверждены для старения женской репродуктивной системы и других
случаев. Возможно подходят и для многих |
|
Иммунологические теории |
Продолжительность жизни зависит от специальных генов иммунной системы,
одни аллели продляют ее, другие — сокращают. Эти же гены, возможно,
регулируют и нейроэндокринную систему. Нарушение этих механизмов снижает
эффективность работы организма до уровня его гибели |
Вероятны |
модель преждевременного старения.
При детской прогерии (синдроме Гилфорда) признаки старения появляются
еще до периода полового созревания, а смерть наступает до 30—летнего возраста от
заболеваний сердечно—сосудистой системы.
Представление о существовании генетической программы
старения подтверждается еще и тем, что нормальные диплоидные клетки
человеческого организма (например, фибробласты) in vitro могут претерпевать только ограниченное
(несколько десятков) число делений. Есть также данные о том, что in vitro клетки человека (долгоживущего
существа) претерпевают больше делений, чем клетки мыши (короткоживущего), и что
чем старше донор, тем к меньшему количеству делений способны его клетки.
Однако, если этим и можно обьяснить процесс старения, смерть от старости имеет
другие причины: клетки даже очень старых людей способны делиться еще примерно
20 раз (что намного превышает продолжительность предстоящей жизни человека).
Различные факторы внешней среды
способны вызвать изменения в молекулах ДНК. Среди таких факторов первое место
занимают ионизирующие излучения: естественные (космические и от
скоплений радиоактивных элементов в земной коре) и искусственные. Свободные
радикалы, образование которых происходит в организме постоянно, также
способны повреждать ДНК. Существуют и другие мутагенные факторы — физические и
химические (например, курение). Считается, что именно курение является причиной
того, что мужчины живут в среднем на несколько лет меньше, чем женщины.
В молодом организме эффективно
работает система ферментов, предназначенных для восстановления возникающих в
ДНК дефектов. В старости эффективность этой системы снижается. В результате из
определенных участков ДНК исчезают метильные группы. Накопление «ошибок» в
молекулах ДНК приводит к синтезу «неправильных» белков, в том числе ферментов
со сниженной активностью, и появлению нежелательных белков, например, таких,
которые способствуют развитию злокачественных опухолей.
Негенетические теории. В течение жизни индивида молекулы,
из которых состоит его организм, повреждаются. Наиболее важны изменения в
белках и углеводах. Так, в белках происходит окисление некоторых аминокислотных
остатков, гликолизирование (присоединение боковой углеводной цепи) и
образование поперечных сшивок (дисульфидных мостиков), усиливающих
межмолекулярные связи и ограничивающих функции белковых молекул. Эти
модификации молекул с возрастом накапливаются: например, содержание окисленных
белков в коже старых крыс может достигать 30—50% .Нарастает количество «сшитых»
белков в головном мозгу. При прогерии содержание окисленных белков в организме
молодых людей достигает того же уровня, что и у 80—летних.
Структурные модификации белков—ферментов
приводят к нарушению их функций. Протеиназы, предназначенные для разрушения
окисленных белков, сами модифицируются, и активность их падает. Возникает
дефицит пероксид—дисмутазы и каталазы, которые должны
инактивировать возникающие свободные радикалы. Избыток свободных радикалов
дополнительно повреждает клеточные мембраны. Накопление ошибок в структуре
белков препятствует делению клеток.
Накопление свободных радикалов
приводит к деструктивному окислению длинноцепочечных углеводородных соединений
в клеточных мембранах, в результате чего меняются их свойства, например,
снижается текучесть мембран синаптосом. Происходящее в течение жизни изменение
молекул снижает прочность молекул и нарушает их функции.
Неоднократно предпринимались попытки
объединить обе основные группы теорий старения. Первый вариант объединения
сводился к тому, что под действием внешних и внутренних повреждающих факторов
нарушается структура молекул ДНК и РНК, в результате чего происходит синтез
«неправильных» (незапрограммированных генетически) белков, в том числе ферментов
(РНК—полимераз); они в свою очередь обусловливают синтез «неправильных» молекул
РНК и так далее, по механизму порочного круга. Сам по себе этот процесс не
приводит к смерти организма: когда количество «неправильных» молекул РНК
достигает критического уровня, включается механизм самоингибирования и
возникает состояние равновесия между синтезами «правильных» и «неправильных»
молекул. Второй вариант: в течение жизни происходит окисление белков, в том
числе и ферментов, ответственных за поддержание структуры ДНК. В результате в
ДНК накапливаются ошибки, что приводит к появлению «неправильных» белковых
молекул и т. д.
Главным признаком наступления
старости является снижение способности адаптироваться к изменению среды —
физической и социальной. В стабильной среде трудно отличить старый организм от
молодого. Различия проявляются в ответах на действие стрессоров —
температурных, пищевых, эмоциональных, социальных и др. Ответ старческого
организма замедлен и не достигает той же величины, что у молодого. Другой
важнейший признак наступления старости — снижение репродуктивной функции.
Опорно—двигательный аппарат и двигательные функции. Минерализация костной ткани в
старческом организме уменьшается — развивается сенильный остеопороз (от
лат. senilis — старческий и греч. osteon — кость и poros — отверстие) (рис. 15.3). Кости
становятся более хрупкими, частота переломов возрастает. Особенно часты у
старых людей возникающие при падениях переломы лучевой кости (в так называемом
«типичном месте» — у лучезапястного сустава) и шейки бедренной кости.
Последний на долгие месяцы ограничивает физическую активность человека, что
часто приводит к гипостатической
|
|
|
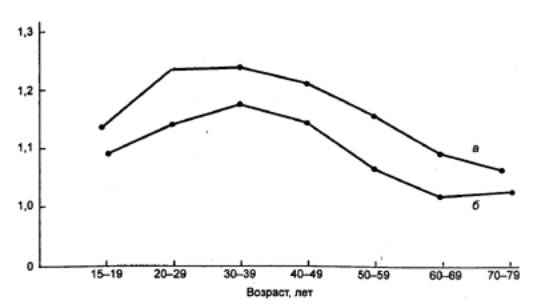
Рис. 15.3 Возрастные изменения плотности костной ткани (мг/мм3)
предплечий у женщин Значения
для правого предплечья (а) постоянно выше, чем левого (б), видимо, в
результате более частого упражнения правой руки у правшей, составляющих в
популяции большинство. |
(застойной) пневмонии и смерти.
Возрастные изменения в обмене кальция можно задержать, разумно ограничивая
потребление пищи.
В глубокой старости изменения в
хрящах проявляются деформацией суставов, особенно коленных, что приводит к
искривлению нижних конечностей. Усиливается искривление позвоночника с
образованием выпуклости, обращенной кзади (кифоз). Нарушение нервной регуляции
движений (например, при развитии болезни Паркинсона — см. ниже) в совокупности
с изменениями в костной системе делают походку шаткой и неуверенной. Точные
движения пальцев рук нарушаются. Появляется тремор — дрожание головы и кистей.
Кровь и внутренняя среда организма. Уже в зрелом возрасте начинается
замещение костного мозга жировой и соединительной тканями. К старости
количество активных клеток костного мозга уменьшается вдвое. Ослабление
эритропоэза проявляется снижением количества ретикулоцитов в периферической
крови. Снижаются также количество эритроцитов, содержание в них гемоглобина и
АТФ. Часто наблюдается дефицит факторов кроветворения:
витамина B12 (кобаламина), фолиевой кислоты и
железа. Лейкопоэз с возрастом изменяется меньше, чем эритропоэз. Частичная
инволюция лимфоидной ткани заметна в миндалинах, селезенке, лимфатических
узлах. Общее содержание белков в плазме крови остается почти неизменным, но
нарушается баланс между альбуминами (их количество снижается) и глобулинами
(растет), что проявляется увеличением скорости оседания эритроцитов (СОЭ).
Активность свертывающей системы крови с возрастом увеличивается
(растет содержание фибриногена и фактора VIII). Только отчасти это
компенсируется активацией противосвертывающей системы — снижением количества
тромбоцитов и ростом содержания гепарина. Соответственно возрастает вероятность
тромбозов, эмболии и ишемических инсультов.
Иммунная система. Согласно одной из теорий, старение
— это комплекс генетически запрограммированных, осуществляемых через посредство
гипоталамуса изменений в иммунной системе. Наиболее заметные сдвиги происходят
в реакции гиперчувствительности замедленного типа, резистентности к опухолевым
клеткам, вирусам и простейшим. Все это повышает риск возникновения
злокачественных опухолей, инфекционных, аутоиммунных и других заболеваний.
Психическое напряжение и особенно депрессия также сопровождаются ослаблением иммунитета.
В большей степени страдает клеточный
иммунитет. Снижается эффективность деятельности иммунных клеток, но не общее
число лимфоцитов, гранулоцитов или фагоцитирующая функция нейтрофилов. Т—клетки
— наиболее
|
|
|
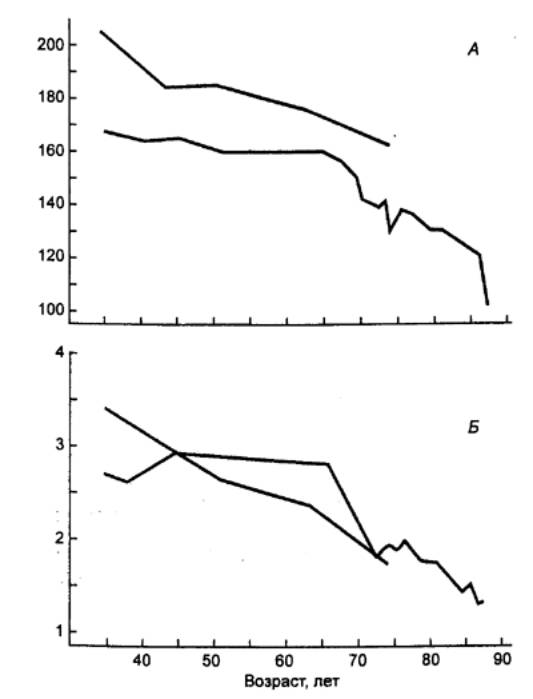
Рис. 15.4
Возрастные изменения физической работоспособности А — максимальная частота сердечных сокращений (ударов/мин); Б — максимальное потребление
кислорода (л/мин) при выполнении пробы на велоэргометре. Двое мужчин
регулярно выполняли эту пробу на протяжении 40—50 лет. |
|
|
|
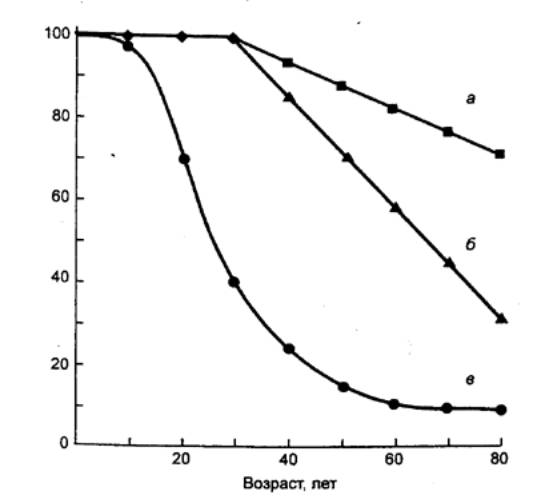
Рис. 15.5 Возрастное снижение
сердечного индекса (а), физической работоспособности (б) и аккомодационной
способности глаз (в) человека, в процентах от исходного уровня |
чувствительный к старению компонент
иммунной системы. Ослабление их функции происходит параллельно инволюции
вилочковой железы (тимуса). Секреция гормонов тимуса, необходимых для
созревания Т— и В—лимфоцитов, начинает снижаться уже с третьего
десятилетия жизни. В 50 лет тимус имеет массу менее 15% от таковой в раннем
взрослом периоде. Повышается активность естественных киллеров.
Гуморальный иммунитет с возрастом меняется
меньше, чем клеточный, и В—клетки функционируют относительно нормально.
Некоторые изменения в них, возможно, вызваны нарушением функции Т—хелперов.
Снижается содержание иммуноглобулинов классов А и G. Уменьшен ответ антителообразования
на новые антигены, но не на повторное проникновение их в организм. Ослабление
системы иммунного надзора приводит к увеличению концентраций циркулирующих в
крови аутоантител и комплексов «антиген—антитело». Эти сдвиги
коррелируют с повышением смертности.
Сердечно—сосудистая система. В сердце мышечные волокна частично
замещаются соединительной тканью, вблизи клеточных ядер откладывается
специфический бурый пигмент — маркёр старости — липофусцин. Клетки
проводящей системы сердца частично замещаются коллагеном, что приводит к
нарушению передачи возбуждения. Возникновение эктопических очагов
возбуждения нарушает сердечный ритм. Склероз коронарных (венечных) сосудов
сердца снижает кровоснабжение миокарда, что при выполнении физических нагрузок
проявляется снижением максимальной частоты сердечных сокращений (рис. 15.4),
ударного (систолического) объема и сердечного выброса (минутного объема
кровообращения, или дебита сердца), а также сердечного индекса (рис. 15.5).
Восстановление сердечного ритма после физических нагрузок происходит медленнее,
чем в молодом возрасте.
В стенке артерий эластические
волокна и гладкие мышцы частично
|
|
|
Рис.
15.6 Систолическое (верхние кривые)
и диастолическое (нижние кривые) кровяное давление (мм pm.cm.) у мужчин (А) и женщин (Б) различного возраста |
замещаются коллагеном, что проявляется
снижением упругости сосудистой стенки. Проницаемость капилляров также падает.
Ослабляются рефлексы, регулирующие просвет сосудов. Растет общее периферическое
сопротивление сосудистой системы и артериальное давление (рис. 15.6). Однако
феномен гипертензии пожилого возраста нельзя полностью обьяснить только
снижением эластичности сосудов: подобные изменения сосудов происходят у всех
людей, но гипертонической болезнью страдает лишь 2/3 пожилых.
Формирование атеросклеротических бляшек (очаговых утолщений
внутренней оболочки артерий) способствует тромбозу с особенно тяжелыми
последствиями в случае поражения сосудов сердца и головного мозга. Скорость
развития атеросклероза определяется взаимодействием генетических факторов,
питания и физической активности человека.
Система органов дыхания. Остеохондроз грудной клетки ограничивает ее
экскурсии. Масса легких не уменьшается (рис. 15.7), но уменьшение числа
эластических волокон снижает растяжимость и упругость легочной ткани. Скопление
слизи в бронхах и ухудшение ее выведения увеличивает сопротивление дыхательных
путей потоку воздуха. Альвеолы расширяются, часть перегородок между ними
исчезает. Перечисленные изменения уменьшают вентиляцию альвеол и жизненную
емкость легких. Функциональная остаточная емкость легких и объем мертвого
пространства увеличиваются. Снижается число легочных капилляров. Это
проявляется учащением дыхания в покое, снижением максимального минутного объема
дыхания при физических нагрузках и, соответственно, величины переносимых
нагрузок (см. рис. 15.4, 15.5).
Питание, пищеварение и обмен веществ. В старческом возрасте в результате
стирания и выпадения зубов нарушается процесс жевания, что отражается на
полноте переваривания некоторых компонентов пищи и приводит к отказу от
потребления необходимых организму продуктов, требующих пережевывания, например,
сырых овощей. Нарушение слюноотделения проявляется ощущением сухости во рту и
затруднением проглатывания пищевого комка. I В эпителии пищевода происходят
атрофические изменения. Нарушается его перистальтика и процесс проталкивания
пищи в желудок. Тонус кардиального сфинктера снижается, что приводит к
желудочно—пищеводному рефлюксу (забросу желудочного содержимого обратно в
пищевод) и сопровождается неприятными ощущениями.
Слизистая оболочка желудка постепенно атрофируется. Его
моторная и секреторная функции ослабляются, в частности, уже в зрелом возрасте
снижается секреция соляной кислоты.
Атрофические изменения происходят и в поджелудочной железе
(см. рис. 15.7). Снижается активность панкреатического сока — протеолитическая,
липолитическая и амилолитическая.
Масса печени (см. рис. 15.7) и величина кровотока в ней
уменьшаются. Интенсивность синтеза белков в печени и содержание их в плазме
крови снижаются. Это увеличивает риск возникновения отеков. Активность
печеночных ферментов падает, что проявляется более медленным расщеплением и
выведением из организма лекарственных веществ. В жёлчном пузыре из—за снижения
его тонуса происходит застой жёлчи, что часто сопровождается образованием
конкрементов (камней).
|
|
|
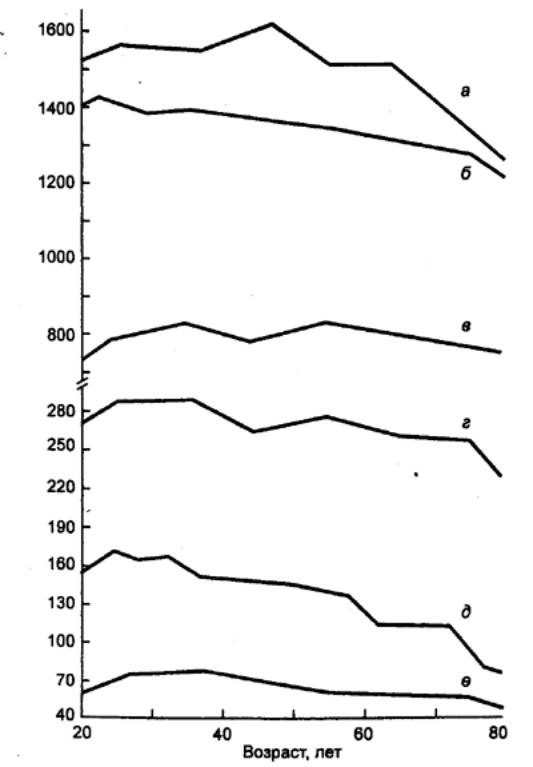
Рис. 15.7
Изменение массы органов (г) в зависимости от возраста человека а — печень, б —
головной мозг, в — легкие, г — почки, д — селезенка, е —
поджелудочная железа. |
Тонус стенки тонкой кишки с возрастом уменьшается, ее длина
возрастает. Количество микроворсинок и интенсивность пристеночного
пищеварения падают. Регенерация слизистой оболочки кишки замедляется. Снижается
всасывание некоторых пищевых веществ, в том числе водорастворимых витаминов.
Задержка пищи компенсирует снижение интенсивности пищеварительных процессов.
В толстой кишке также происходит
ослабление моторной функции и ее рефлекторной регуляции, что приводит к
длительным запорам. Их развитию противодействуют грубая пища и физическая
активность. В глубокой старости развиваются недостаточность сфинктеров с
соответствующими последствиями.
Менее эффективная утилизация жиров
приводит к увеличению доли липидов в организме. Усиливается свободнорадикальное
окисление липидов. Уровень холестерина и липопротеидов низкой и очень
низкой плотности в плазме крови растет, соответственно снижается доля липопротеидов
высокой плотности. Все это значительно увеличивает вероятность образования
атеросклеротических бляшек. Снижение эффективности эндокринной части
поджелудочной железы затрудняет утилизацию глюкозы и увеличивает риск развития
сахарного диабета.
Обмен энергии и терморегуляция. Старение снижает эффективность всей
системы терморегуляции. Оценка температуры внешней среды и собственного тела
становится менее точной, замедляется и ослабевает ответ теплопродукции
(сократительного термогенеза) и теплоотдачи (потоотделения и реакции
перераспределения кровотока) на изменение температуры окружающей среды.
Снижается величина основного обмена (примерно на 20%), физическая активность и
средняя температура тела (иногда бывает ниже 35 °С). Субъективно пожилые люди
хуже переносят снижение температуры окружающей среды, чем ее повышение.
Выделение. По мере старения организма
уменьшаются: масса почек (см. рис. 15.7), число нефронов (примерно на 1/3),
почечный кровоток, скорость клубочковой фильтрации, концентрационная
способность и клиренс многих веществ, в том числе лекарственных.
У мужчин после 60 лет нередко развивается аденома
(доброкачественная опухоль) предстательной железы (простаты), которая
постепенно сдавливает мочеиспускательный канал и препятствует выведению мочи,
вынуждая больного подвергнуться хирургической операции.
Стенки мочевыводящих путей теряют эластичность, емкость их
возрастает, соответственно растет вероятность рефлюкса мочи и восходящего
распространения инфекции. Снижение растяжимости мочевого пузыря приводит к
тому, что позывы к мочеиспусканию учащаются. Регуляция сфинктеров ослабевает,
что проявляется частичным недержанием мочи.
Кожа. В коже происходят облитерация (заращение) артериол и дилатация вен.
Количество анастомозов растет за счет снижения числа активных капилляров.
Кровоснабжение кожи ухудшается. В сочетании с пролиферацией эпителия это делает
кожу сухой, морщинистой и дряблой. Снижение эластичности и бактерицидных
свойств кожи увеличивает вероятность ее травмирования. На участках, открытых
солнцу, развиваются клоны мутантных клеток, вызывающие появление пигментных
пятен. Волосы редеют, теряют пигмент (седеют) и выпадают. Ногти растут
медленнее, утолщаются и становятся ломкими.
Репродукция. После 50 лет сперматогенез ослабевает, концентрация
тестостерона в крови снижается. Главные возрастные изменения происходят
непосредственно в яичках, но у многих пожилых мужчин обнаруживаются нарушения и
в гипоталамо—гипофизарной регуляции половых желез.
Способность к оплодотворению (подвижность сперматозоидов)
теряется значительно раньше, чем способность произвести половой акт. Перерывы
между половыми актами становятся дольше, хотя у некоторых индивидов угасание
половой функции происходит удивительно поздно. Главная причина импотенции
пожилых — атеросклероз артерий и изменения в венозной системе половых органов.
Психогенные нарушения у них редко становятся главной причиной снижения
потенции, но часто присоединяются в качестве вторичного фактора. В последние
годы созданы медикаменты, поддерживающие потенцию и в пожилом возрасте,
например виагра. Снижение уровня тестостерона не приводит к изменениям
внешности и психики, подобным тем, которые отмечаются при раннем нарушении
функции мужских половых желез (евнухоидизме).
У женщин в возрасте около 50 лет происходит климакс:
менструации становятся слабыми и нерегулярными, затем исчезают вовсе, овуляции
прекращаются, желтое тело не образуется, концентрации эстрогенов и прогестерона
падают. Развивается атрофия вульвы, влагалища и уретры, часто возникают
доброкачественные опухоли (миомы) матки. Климакс сопровождается нестабильностью
сосудистого тонуса («приливы»), потливостью, неустойчивостью настроения,
раздражительностью, иногда преходящей депрессией. Эти явления могут длиться в
течение нескольких лет до и после последней менструации. На седьмом десятилетии
жизни происходит инволюция матки.
Эндокринная система. Процесс старения сопровождается многочисленными нарушениями
функций эндокринной системы. Часто трудно определить, что является причиной
этих нарушений — собственно старость или нераспознанные болезни, ее
сопровождающие.
У старых животных концентрации большинства гормонов снижены,
что прослеживается на всех уровнях эндокринной системы: рилизинг—факторов
гипоталамуса, тропных и эффекторных гормонов. Еще более разница между молодым и
старым организмами заметна при сравнении не базальных уровней секреции, а
реакций эндокринных желез на внешнее воздействие. Так, гипофиз старых крыс
отвечает на действие рилизинг—факторов гипоталамуса (либеринов) секрецией
меньшего количества тройных гормонов. Чувствительность желез—мишеней к тропным
гормонам также ослабевает. Подобные изменения прослежены в гипоталамо—гипофизарно—надпочечниковой
и гипоталамо—гипофизарно—тиреоидной системах.
Искусственно восполняя
недостающие в гипофизе старых крыс вещества, можно задержать или обратить
вспять ослабление репродуктивной функции, развитие опухолей и инволюцию
вилочковой железы (тимуса).
Еще одна причина
ослабления эндокринной регуляции — возрастные изменения структуры гормонов и,
соответственно, их активности. Так, по мере старения меняется молекулярная
масса и снижается активность тиреотропина (ТТГ). Возрастные изменения
происходят и на рецепторном уровне — снижается способность клеток—мишеней
отвечать на воздействие гормонов. Следующий уровень возрастных изменений —
пострецепторный механизм вторичных посредников: например, меняется ответ
мобилизации кальция на действие гормонов и нейротрансмиттеров. Искусственным
введением кальция в клетку в некоторых случаях удается предотвратить снижение
ее ответа на гормоны. Возможно, это подсказывает новую стратегию терапии.
Происходят изменения и в связывании кальция в клетке.
По мере старения
организма всасывание кальция в кишке и реабсорбция фосфора в почках снижаются.
В ответ растет секреция паратирина (паратгормона) и уменьшается
содержание (витамин D)—гормона (1,25—дигидроксикальциферола).
Резорбция кальция из костной ткани усиливается. В результате уровень кальция в
крови остается неизменным. Эффективность регуляции обмена кальция падает:
ослабляется чувствительность стенки кишки к (витамин D)—гормону, паращитовидных желез — к
концентрации кальция в крови, почек — к паратирину (снижается количество
паратириновых рецепторов).
В старости усиливается
образование катехоламинов в симпатической части автономной нервной системы. С
другой стороны, ослабляются эффекты, передаваемые воздействием катехоламинов на
адренорецепторы. Все это суживает диапазон возможных ответов на экстремальные
воздействия внешней среды. Возможно, дополнительные количества катехоламинов
нужны для лучшей утилизации нутриентов: действуя на адипоциты, катехоламины
усиливают липолиз. Через (β—адренорецепторы печени они активируют и
гликогенолиз.
В старости происходят
изменения в регуляции обмена глюкозы. Количество β—клеток в поджелудочной железе
уменьшается. В ответ на рост концентрации глюкозы они высвобождают в кровь
меньшее количество инсулина. Обратная связь, подавляющая выброс глюкозы печенью
(при повышений ее концентрации в крови), действует медленнее. Активность
инсулина падает, соответственно, нарушается поглощение глюкозы мышцами.
Результатом этих изменений является снижение толерантности к глюкозе, а иногда
и развитие сахарного диабета.
По мере старения
ослабляется стероидогенез. Главная причина этого—недостаток в надпочечниках
субстрата для него. При этом эфиры холестерина присутствуют в клетках коры
надпочечников, но запасенный холестерин не расщепляется в достаточной степени
или не транспортируется ближе к митохондриям, где его утилизация должна
начаться отсечением боковых ветвей. В ответ растет активность энзимов,
отсекающих эти цепи.
Сенсорные системы. Изменения липидов роговицы приводят
к появлению у ее края помутнения (старческой дуги). Эластичность хрусталика
снижается, что ограничивает диапазон аккомодации: после 55 лет он составляет
менее 2 дптр — старческая дальнозоркость (пресбиопия) (см. рис. 15.5).
Прозрачность хрусталика снижается, иногда он мутнеет (катаракта).
Прозрачность стекловидного тела также снижается. Закупорка венозного синуса
склеры (шлеммова канала) нарушает циркуляцию влаги. Дистрофия сетчатки снижает
остроту зрения вдаль:
после 80 лет — до 0,6, после 85 — до 0,3. Слабеют световая, цветовая и
контрастная чувствительность. К этим изменениям могут добавляться глаукома
(повышение внутриглазного давления) и атрофия зрительного нерва.
Способность воспринимать и
обрабатывать слуховую информацию также снижается. Растет жесткость базилярной
мембраны улитки, атрофируется спиральный орган, дегенерирует сосудистая
полоска, отмирает часть нейронов спирального ганглия. Атрофия волокон слухового
нерва меняет его частотные характеристики. Атрофические изменения происходят и
в продолговатом мозгу, и в нейронах слуховой зоны коры больших полушарий. В
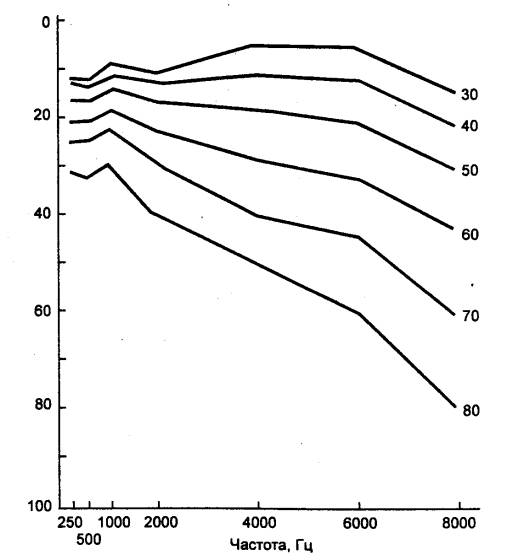
результате снижается восприятие высоких частот (выше 2 кГц) — старческая
тугоухость (пресбиакузис) (рис. 15.8) и затрудняется понимание речи. Изменения
в звукопроводящей системе (остеопороз слуховых косточек и атрофия суставов
между ними — отосклероз) имеют меньшее значение.
|
|
|
Рис.
15.8 Возрастные изменения уровня
слышимости (дБ) звуков различных частот. Справа — возраст (лет) |
Снижается число вкусовых луковиц,
особенно в передней части языка, что приводит к ослаблению ощущений: сначала —
сладкого, потом — кислого и горького. Образование слюны уменьшается. В далеко
зашедших случаях вкусовая чувствительность утрачивается настолько, что пища
теряет вкус, аппетит пропадает, процесс питания нарушается.
Атрофия слизистой оболочки полости
носа и дегенерация обонятельных нейронов ослабляют восприятие запахов.
Снижаются и все прочие виды
чувствительности: болевая, температурная, тактильная, вибрационная и
соматическая. В очень глубокой старости в коже отмечается уменьшение числа
телец Пачини и Мейсснера.
Центральная нервная система и
психические функции.
Большая часть изменений в мозгу происходит между 50 и 60 годами, но некоторые
заметны только после 70. Масса мозга (см. рис. 15.7) и количество нейронов в
мозгу к старости снижается. Атрофия части нейронов происходит в коре больших
полушарий и в базальных ядрах. Наиболее выражен этот процесс в черном веществе
и голубоватом пятне: потеря может составить 30—40% нейронов, что проявляется
шаткостью походки и нарушением точности движений. При болезни Паркинсона здесь
теряется до 70% клеток, и это приводит к резкому нарушению двигательных
функций, в том числе к появлению тремора головы и конечностей. В гиппокампе —
части лимбической системы, ответственной за
|
|
|
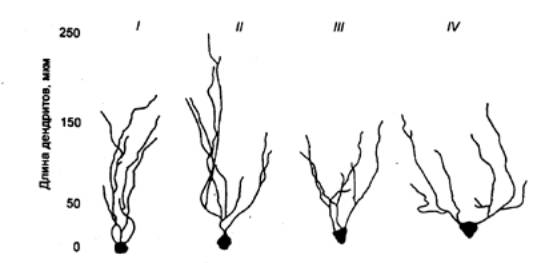
Рис.
15.9 Гибель одних нейронов мозга отчасти
компенсируется удлинением дендритов других. После 80 лет длина дендритов
вновь уменьшается Представлены
нейроны гиппокампа здоровых людей в возрасте 50—60 (I), 70—80 (II) и после 90
лет (Ш), а также при болезни Альцгеймера (IV). |
обучение, память и эмоции, — за
вторую половину жизни утрачивается 20% нейронов. В гипоталамусе, мозжечке,
стволовых структурах и спинном мозгу количество нервных клеток меняется
незначительно. Если же в гипоталамусе — высшем центре автономной (вегетативной)
регуляции — происходят существенные изменения, они могут проявиться в виде
коронарной недостаточности, гипертензии, сахарного диабета и других
патологических процессов.
Потери нейронов в
некоторых областях мозга, возможно, отчасти компенсируются увеличением
количества связей между оставшимися клетками. В гиппокампе людей в возрасте от
40—50 до 70 лет обнаружено удлинение дендритов (рис. 15.9). Число астроцитов
(способных выделять факторы роста нейронов и их отростков) в это время также
увеличивается. После 80 лет дендриты вновь укорачиваются. Возрастные изменения
в липидах миелина приводят к истончению миелиновой оболочки, что проявляется в
изменении скорости и эффективности проведения нервных импульсов. Концентрация
медиаторов синаптической передачи (нейротрансмиттеров) и скорость самой
передачи снижаются. Значительный дефицит дофамина в мозгу — один из
главных компонентов патогенеза болезни Паркинсона.
На молекулярном уровне
в стареющем мозге отмечены изменения, послужившие основой для теорий старения
(см. рис. 15.9): замедление фосфорилирования макромолекул, метилирования ДНК и
гистонов, а также замедление репарации поврежденных молекул ДНК. В опытах на
грызунах активацией антиоксидантной системы удавалось снизить в мозгу уровень
окисленных белков, восстановить (до уровня молодых) активность некоторых
ключевых ферментов и способность животных проходить успешно лабиринт.
Электроэнцефалография
стареющего мозга показывает увеличение доли низкочастотных колебаний.
Различные рефлексы у пожилых людей
ослаблены, их пороги повышены, латентный период удлинен. При заболеваниях
нервной системы, а в глубокой старости и у здоровых людей, могут проявляться
патологические рефлексы (автоматизмы и др.). У животных по мере старения
нарушается способность к образованию условных рефлексов: снижаются сила,
уравновешенность и подвижность нервных процессов.
В старости ухудшаются все три основных процесса памяти:
запоминание, хранение и воспроизведение информации. Больше страдает
кратковременная память. В связи с этим способность к обучению снижается. В
качестве компенсации человек вместо механического запоминания больше использует
логическое. Приобретенный опыт во многом компенсирует снижение логических
способностей. Некоторые же люди сохраняют в старости способность к запоминанию
и обучению почти полностью. Если они затрудняются быстро вспомнить место или
время прошлых событий, то через несколько часов делают это. В отсутствие спешки
пожилые способны выполнять тесты на умственную деятельность (кроме самых
сложных, например, математических) так же хорошо, как и молодые. Нарушения
умственной деятельности может не происходить до глубокой старости. Некоторые ученые
продуктивно работали и после 80 лет.
Общая продолжительность сна и доля в
нем парадоксального сна снижаются. Человек чаще просыпается. Недостаточность
ночного сна он стремится возместить сном дневным.
Темперамент (тип высшей нервной деятельности) с
возрастом остается прежним, но характер меняется. Усиливаются
обидчивость, тревожность и эгоцентризм. Ипохондричность пожилых людей часто
проявляется в повышенной склонности к приему различных лекарств и в потребности
подробно обсуждать состояние своего здоровья. Ухудшение здоровья усиливает
депрессию и вызывает появление суицидных настроений. Главное проявление
старческой психики — снижение способности к адаптации в меняющихся социальных
условиях. В качестве средства защиты старые люди часто стараются отдалиться от
мира, обьясняя это тем, что они не одобряют новых порядков по моральным
соображениям.
Для поддержания интеллектуальных
способностей особенно важна сохранность мозгового кровотока. Кровоснабжение
мозга у здоровых людей с возрастом не снижается. Различные заболевания,
появляющиеся главным образом в пожилом и старческом возрасте (например,
атеросклероз), могут приводить к локальному нарушению кровотока в одной из
областей мозга, что влечет за собой гибель многих нейронов. Стойкое сужение
сосуда вызывает ишемический инсульт. Разрыв сосуда и кровоизлияние в ткань
мозга приводят к геморрагическому инсульту.
Когда на нормальный процесс старения
наслаиваются результаты болезней Альцгеймера, Паркинсона и множественных
инсультов, наступает состояние старческой деменции (слабоумия). Этим
страдают 5% людей в возрасте от 65
до 75 лет. В следующем десятилетии жизни число больных возрастает уже до 20%.
После 85 лет, по некоторым данным, только половина людей сохраняет здравый ум.
Человек теряет способность считать, читать и писать. Его эмоции и память на
недавние события слабеют. Речь становится бессвязной.
Часто причиной старческого слабоумия
является болезнь Альцгеймера. В 21—й хромосоме пожилого человека
мутирует ген, кодирующий предшественник β—амилоидного белка.
Мутантная форма ускоряет отложение β—амилоида в межклеточном пространстве
и в сосудах мозга. В гиппокампе и других важных для процессов обучения
структурах цитоплазма нейронов заполняется пучками спиральных белковых
филаментов — нейрофибриллярными клубками. Изменения цитоскелета мешают
передаче нервных импульсов. В интерстиции гиппокампа появляются старческие
бляшки — агрегаты β—амилоидных белков. Накопление β—амилоидных белков изолирует лимбическую систему
и ассоциативные зоны коры от остального мозга, что приводит к ухудшению памяти,
абстрактного мышления и речи. Развитие болезни Альцгеймера также связывают с
возрастными изменениями в гипоталамо—гипофизарно—адреналовой системе. В
частности у таких больных отмечены изменения в нейронах, содержащих кортикотропин—рилизинг
фактор. Сенсорные, двигательные и гомеостатические функции организма при этой
болезни долгое время регулируются не менее эффективно, чем в здоровом
организме. Однако в далеко зашедших, случаях могут наступить судороги и смерть.
Многие факты
относительно β—амилоидных белков еще ждут своего объяснения. Непонятно,
почему эти белки, долгие годы присутствуя в мозгу, остаются инертными и только
в старости повреждают нейроны. Возможно, (β—амилоидные белки способствуют
образованию в мозгу каких—то других веществ, способных нарушать работу
нейронов. Возможно, они делают нейроны и глию более восприимчивыми к
воздействию других повреждающих факторов. β—амилоидные белки
обнаруживаются только в головном мозгу, тогда как их предшественник может
синтезироваться и вне мозга. В одних областях (например, в гиппокампе) они
откладываются в больших количествах, а в мозжечке—в очень малых (или не
откладываются вовсе). Пока не удалось ответить на вопрос, препятствует ли
высокая умственная активность образованию и отложению в мозгу β—амилоидных
белков.
Частичная деструкция
богатых липидами наружных мембран нейронов приводит к образованию особого
липопротеида — липофусцина, который в виде гранул откладывается в цитоплазме
нейронов. Образованию липофусцина способствует дефицит токоферола (витамина Е).
Неясно, нарушают ли гранулы липофусцина функции нейронов или они просто маркеры
долгожительства.
Профилактика преждевременного
старения основана на рациональном питании и достаточном уровне физической
активности человека. После 50 лет человек должен ограничить поступление
углеводов с пищей, особенно моно— и дисахаридов.
Потребление больших количеств
очищенных углеводов усиливает обмен катехоламинов и повышает риск развития
гипертензии. Умеренное ограничение потребления поваренной соли также полезно
для профилактики гипертензии. Количество жиров в пище должно быть снижено,
необходимые липиды организм должен получать в виде растительных и рыбных
продуктов, богатых ненасыщенными жирными кислотами.
Крысы, которых содержат на
сокращенном рационе и вынуждают к регулярной физической активности, лучше
научаются прохождению лабиринта, живут на 30% дольше, и у них обнаруживают
меньше функциональных, биохимических и иммунологических изменений, свойственных
старости. Однако такой рационально ограниченной диеты человек должен
придерживаться большую часть жизни. Резкое ограничение питания в старости может
только ускорить проявления старения, в частности развитие слабоумия.
Одновременно следует повысить
содержание в суточном рационе незаменимых аминокислот (до 1,2—1,5 г полноценных
белков на 1 кг массы тела) и кальция — за счет молочных продуктов (для задержки
развития остеопороза). Потребление витамина Е (токоферола) задерживает развитие
возрастных изменений в мозгу грызунов, однако его влияние на старение мозга
человека пока не доказано. Для сохранения интеллектуальных способностей пожилым
людям рекомендуют особую умеренность в потреблении алкоголя и седативных
средств.
Физическая активность, витамины—антиоксиданты (С, Е, Р—каротин)
и микроэлементы (например, цинк), своевременная коррекция психической
депрессии, ограничение потребления алкоголя задерживают старение иммунной
системы и уменьшают риск инфекционных заболеваний.
Пищевые волокна, содержащиеся в овощах и фруктах, снижают
вероятность возникновения сахарного диабета и стимулируют двигательную функцию кишечника. Овощи и фрукты
обеспечивают стареющий организм достаточным количеством витаминов.
В связи с возрастной инволюцией центральных органов иммунной
системы (вилочковая железа) и нейроэндокринной системы (шишковидное тело)
актуальным является вопрос о восстановлении утраченных ими функций. С этой
целью из названных органов были выделены и внедрены в медицинскую практику
пептидные препараты тималин и эпиталамин, которые эффективно
предотвращают преждевременное старение и в эксперименте способствуют продлению
жизни животных до верхнего видового предела. В последние годы на основе этих
препаратов были искусственно синтезированы пептиды вилон и эпиталон,
обладающие еще более высокой геропротекторной активностью.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Согласно генетической теории,
старение вызывается либо экспрессией специальных генов, либо тем, что в течение
жизни в молекулах ДНК накапливаются повреждения от воздействия ионизирующих
излучений, свободных радикалов и других факторов. В результате синтезируются
«неправильные» белки с нарушенными функциями.
Негенетическая теория утверждает,
что синтез белков происходит правильно, и только потом они повреждаются под
действием тех же факторов; накопление таких повреждений и составляет суть
процесса старения. В белках накапливаются «поперечные сшивки» — дисульфидные
мостики, ограничивающие функции молекул. Активность ферментов, предназначенных
для репарации дефектов в ДНК, снижается.
Главный признак старости — снижение
способности адаптироваться к изменению среды. Результаты старения проявляются в
замедленных и ослабленных ответах на действие стрессоров — температурных, пищевых,
эмоциональных, социальных и прочих. Другой важнейший признак старости — утрата
репродуктивной функции. Сперматогенез ослабевает, концентрация тестостерона в
крови снижается. У женщин прекращаются менструации.
Минерализация костной ткани в
старческом организме уменьшается — развивается остеопороз. Костный мозг
замещается жировой и соединительной тканями. Снижается количество эритроцитов и
содержание гемоглобина. Происходит частичная инволюция лимфоидной ткани.
Активность свертывающей системы крови возрастает. Увеличивается вероятность
тромбозов, эмболии и инсультов.
Снижается резистентность к
опухолевым клеткам, вирусам и простейшим. В большей степени страдает клеточный
иммунитет. Снижается иммунный ответ.
В сердце мышечные волокна частично
замещаются соединительной тканью. Снижается ударный объем и сердечный выброс. В
артериях эластические волокна и гладкие мышцы частично замещаются коллагеном,
упругость их стенки снижается. Усиливается образование катехоламинов. Растет
артериальное давление. Уровни холестерина и липопротеидов низкой и очень низкой
плотности в плазме крови увеличиваются, на стенках сосудов образуются
атеросклеротические бляшки, вызывая тромбоз сосудов.
Растяжимость и упругость легочной
ткани уменьшаются. Сопротивление току воздуха возрастает. Уменьшается
вентиляция альвеол и жизненная емкость легких. Снижается способность переносить
физические нагрузки.
Моторная и секреторная функции
желудка ослабляются. Снижается активность панкреатического сока и жёлчи. В
жёлчном пузыре образуются камни. Ухудшается всасывание некоторых пищевых
веществ. Ослабляется двигательная функция толстой кишки, возникают запоры.
Падает эффективность
эндокринной части поджелудочной железы, увеличивается риск развития сахарного
диабета. Эффективность системы терморегуляции ослабевает, снижается величина
основного обмена. Концентрационная способность почек и клиренс многих веществ
снижаются. У мужчин нередко развивается аденома предстательной железы,
препятствующая выведению мочи.
Кровоснабжение кожи
ухудшается, снижение ее эластичности и бактерицидных свойств увеличивает
вероятность травмирования.
Уровни большинства
гормонов в крови снижаются. Взаимодействие гормонов с клеточными рецепторами
ослабевает.
Чувствительность
сенсорных систем снижается, часть нейронов мозга погибает. Точные движения
нарушаются, появляется тремор. Миелиновые оболочки истончаются, скорость
проведения возбуждения уменьшается. В мозге накапливаются агрегаты β—амилоидных
белков. В цитоплазме нейронов откладывается липофусцин. Страдает кратковременная
память. Снижается способность к социальной адаптации. Иногда развивается
болезнь Альцгеймера — старческое слабоумие.
Средняя продолжительность жизни в развитых странах
приближается к 80 годам. Возникает потребность обеспечить пожилым и старым
людям возможность активной жизни. Профилактика старения основана на
рациональном питании, достаточном уровне физической и умственной активности
человека и применении лекарств — геропротекторов.
Анисимов В. Н., Соловьев М. В. Эволюция концепций в геронтологии.
СПб., 1999.
Биология старения / Отв. ред. В. В.
Фролькис. Л., 1982.
Бутенко Г. М., Войтенко В. П. Генетические и иммунологические
механизмы возрастной патологии. Киев, 1982.
Гаврилов Л. А., Гаврилова Н. С. Биология продолжительности жизни.
М., 1991.
Дильман В. М. Четыре модели медицины. Л.,
1987.
Зomuн A. И., Зотина Р. С. Феноменологическая теория
развития, роста и старения организма. М., 1993.
Конопля Е. Ф., Гацко Г. Г.. Милютин
А. А. Гормоны и
старение. Мембранные механизмы гормональной регуляции. Минск, 1991.
Котельников Г. П., Яковлев О. Г.,
Захарова Н. О.
Геронтология и гериатрия. Самара, 1997.
Лоркушко О. В., Чеботарев Д. Ф.,
Калиновская Е. Г. Гериатрия в терапевтической практике. Киев, 1993.
Мелентьев А С., Гасилин В. С., Гусев
Е. И. и др.
Гериатрические аспекты внутренних болезней. М.,1995.
Морозов В. Г., Хавинсон В. X. Пептидные биорегуляторы (25—летний
опыт экспериментального и клинического
изучения). СПб., 1996.
Морозов В. Г., Хавинсон В. X.,
Малинин В. В. Пептидные тимомиметики.
СПб., 2000.
Практическая гериатрия: Руководство для
врачей / Под ред. Г. П. Котельникова, О. Г. Яковлева Самара, 1995.
Фролькис В. В., Мурадян X. К. Экспериментальные пути продления
жизни. Л., 1988.
Фролькис В. В., Мурадян X. К. Старение. Эволюция и продление
жизни. Киев, 1992.
Хавинсон В. X., Морозов В. Г. Препараты эпифиза и тимуса в
геронтологии. СПб., 1992.