12 ПИЩЕВАРИТЕЛЬНАЯ
СИСТЕМА
1662 — Р. де Грааф (R. de Graaf, Голландия) предложил метод
наложения фистулы протока поджелудочной железы.
1753 — Р. Реомюр (R. Reaumur, Франция) скармливал хищным птицам
перфорированные металлические футляры, заполненные мясом. Доказал факт
химической обработки пищи в желудке.
1757 — М. И. Шейн (Россия) издал первый,
учебник на русском языке, в котором описаны органы пищеварения и их функции.
1783 — Л. Спалланцани (l. Spallanzani, Италия) повторил опыты Реомюра и
усложнил их. Для получения желудочного сока перфорированные футляры заполнял
губкой. Полученный сок добавил в сосуды с мясом и наблюдал его растворение.
1824 — В. Пру (W. Prout, Франция) доказал наличие в желудочном соке соляной
кислоты.
1833 — У. Бомон (W. Bomon, США) наблюдал за пищеварением в
желудке человека через свищ, образовавшийся вследствие ранения.
1836 — Т. Шванн (Th. Schwann, Германия) выделил из желудочного
сока вещество, которое в концентрированном состоянии растворяло белки, и назвал
его пепсином. 1844 г. положил начало экспериментальному изучению
внешнесекреторной функции печени. Выводил у животных наружу всю желчь, наблюдал
быстрое исхудание и гибель животных.
1842 — В. А. Басов (Россия) предложил метод изучения желудочного
содержимого посредством создания «искусственного входа в желудок» — операция
гастростомии.
1851 — К. Людвиг (К. ludwig, Германия) открыл секреторные нервы
слюнных желез.
1879 — Р. Гейденгайн (R. Heidenhain, Германия) провел операцию по
формированию желудочка на большой кривизне желудка, иннервация блуждающим
нервом при этом не сохранялась.
1879 — И. П. Павлов (Россия) впервые предложил метод наложения постоянной
фистулы протока поджелудочной железы на собаках.
1882 — Л. Велла (l. Vella, Италия) предложил метод для
изучения динамики кишечного сокоотделения в хроническом опыте. В кожную рану
выводились концы изолированного отрезка тонкой кишки.
1894 — И. П. Павлов предложил операцию по
выделению желудочка на большой кривизне желудка с сохраненной иннервацией.
Сделал вывод о стимулирующем влиянии блуждающего нерва на секрецию ферментов.
1894 — И. Л. Долинский (Россия) в
лаборатории И. П. Павлова впервые показал, что введение в двенадцатиперстную
кишку разбавленного раствора соляной кислоты вызывает секрецию поджелудочной
железы.
1895 — Д. Л. Глинский (Россия) в лаборатории И. П. Павлова
предложил операцию по наложению хронической фистулы на слюнную железу.
1899 — И. П. Павлов, Е. О. Шумова—Симановская
(Россия) разработали оригинальную методику получения чистого желудочного сока —
опыт «мнимое кормление».
1902 — У. Бейлисс, Э. Старлинг (W. Bayliss, E. Starling, Великобритания) показали, что
внутривенное введение собаке кислых экстрактов слизистой оболочки
двенадцатиперстной кишки вызывает выраженную панкреатическую секрецию.
Действующий фактор был назван секретином. Позднее ими был открыт другой гормон
— гастрин.
1904 — И. П.
Павлов — Нобелевская премия за работы в области физиологии пищеварения.
1924 — Н. И. Красногорский (СССР) предложил специальную
капсулу для собирания слюны из стенонова протока.
1924 —Е.С. Лондон и др. (СССР) для изучения кишечной
секреции предложил методы, состоящие в наложении на кишечник одной или
нескольких фистульных трубок, которые позволяли направлять химус то в отверстие
фистулы, то в нижележащие части кишки.
1927 — И. П. Павлов обнаружил тормозящее
влияние коры головного мозга на гипоталамические центры слюноотделения.
1950 — У Пенфилд (W. Penfield,
Канада) во время нейрохирургических операций на людях проводил электрическую
стимуляцию коры мозга вокруг центральной борозды и наблюдал слюноотделение,
глотание, жевание, движение губ и языка.
1957 — А. М. Уголев (СССР) открыл пристеночное (мембранное) пищеварение.
1960 — И. Т. Курцин и К. М. Быков (СССР) доказали, что при
нарушении деятельности коры больших полушарий путем «сшибки» положительных и
отрицательных условных пищевых рефлексов происходит нарушение функций органов пищеварения.
1960—1980
А. Пирс и Дж. Полак (A. Pearse, J. Polak, Великобритания) обнаружили множество гормонов
желудочно—кишечного тракта. Сформулировали концепцию APUD—системы.
1971 — П. К. Анохин и К. В. Судаков
(СССР) создали нейрофизиологическую теорию голода, аппетита и насыщения.
Потребности организма в энергии,
пластическом материала и элементах, необходимых для формирования внутренней
среды, удовлетворяются пищеварительной системой.
12. 1. СТРУКТУРНО—ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ПИЩЕВАРИТЕЛЬНОЙ
СИСТЕМЫ
В структурном и функциональном
отношении пищеварительную систему подразделяют на эффекторную
(исполнительную) и регуляторную (управляющую) части. Первая объединяет
клеточные элементы, осуществляющие процессы сокращения (гладкомышечные клетки),
секреции (секреторные клетки), мембранного гидролиза и транспорта (кишечные
клетки — энтероциты). Вторая состоит из нервных и эндокринных элементов,
осуществляющих нейрогуморальную регуляцию деятельности пищеварительной системы.
12.1.1. Эффекторная часть пищеварительной системы
Исполнительные элементы
пищеварительной системы (аппарата) объединены в пищеварительный канал (трубку)
с примыкающими к нему компактными железистыми образованиями (слюнные и
поджелудочная железы, печень). Все это обозначают термином желудочно—кишечный
(пищеварительный) тракт (рис. 12.1, 12.2).
Функции желудочно—кишечного тракта направлены на достижение конечного
результата деятельности пищеварительной системы, которым является гидролиз
пищевых веществ (белков, углеводов, жиров) до мономеров (аминокислот,
моносахаридов, моноглицеридов и жирных кислот) и транспорт их из
пищеварительного канала во внутреннюю среду организма. Физико—химические
процессы, обеспечивающие указанный конечный результат, составляют сущность пищеварения
(переваривания пищевых веществ) и всасывания. Эти процессы реализуются
при участии секреторной и моторной функций желудочно—кишечного тракта.
|
|
|
Рис. 12.1
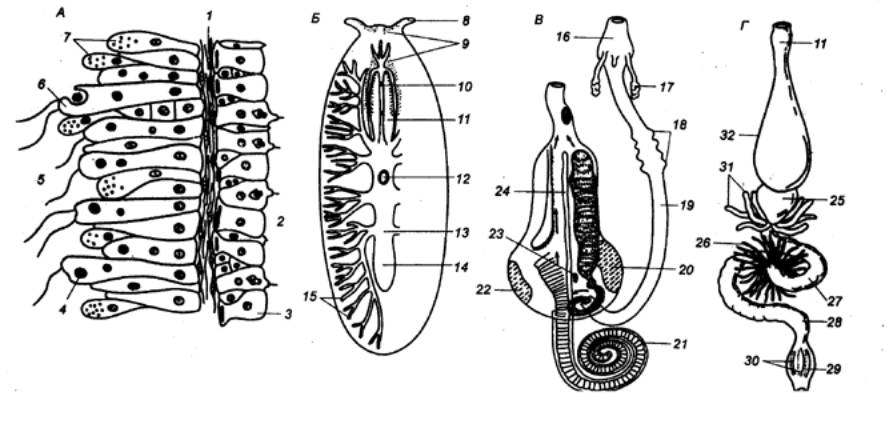
Пищеварительная система беспозвоночных
А— кишечнопостные (разрез через стенку тела гидры); Б — отряд
многоветвистые (система пищеварения плоского червя); В—моллюски (переднежаберные брюхоногие);Г — насекомые
(таракан), 1—мезоглия, 2— внешняя среда, 3— интерстиальная клетка,
4 — пищеварительная вакуоль, 5 — гастральная полость, 6— мышечные клетки
энтодермы, 7— ферментативные железистые клетки, 8— щупальце, 9 — глаза, 10—
рот, 11—глотка, 12— адгезивная бляшка, 13— боковое ответвление кишечника, 14— основной отдел кишечника,
15— ответвления кишечника, 16—
ротовая полость, 17— слюнные железы, 18— пищеводные железы, 19 — пищевод 20 —
гастральный щит, 21— слепой отросток, 22— зона сортировки, 23 — проток
пищеварительной железы, 24— главный тифлозоль, 26— мальпигиевы сосуды, 27 — средняя кишка, 28 — задняя
кишка, 29 – прямая кишка, 30— ретальные подушечки, 31 — слепые отростки желудка, 32 — зоб. |
|
|
|
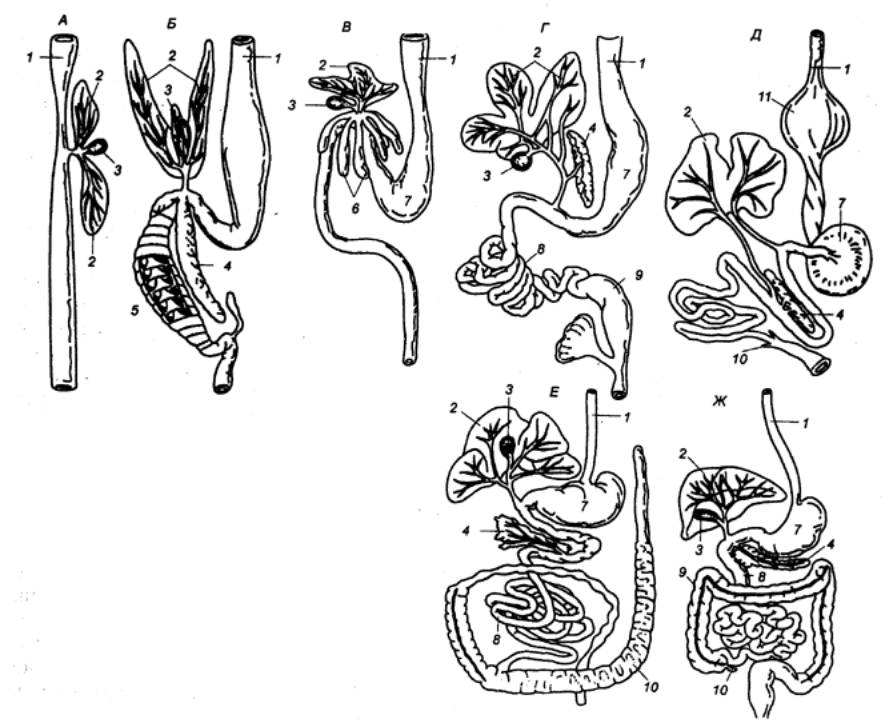
Рис. 12.2 Пищеварительная
система позвоночных А — круглоротые (миксина); Б — пластиножаберные рыбы (акула); В — костистые рыбы (окунь); Г — земноводные (лягушка); Д — птицы (голубь); Е — млекопитающие (кролик); Ж —
млекопитающие (человек). 1 — пищевод, 2 — печень, 3 — желчный пузырь;.4 — поджелудочная железа; 5 — спиральный клапан, 6 — пилорические придатки; 7 — желудок; 8 — тонкая кишка; 9 — толстая кишка; 10
— слепая кишка; 11 —
зоб. |
Секреторные клетки желудочно—кишечного тракта
продуцируют пищеварительные ферменты, обеспечивающие гидролитическое
расщепление (переваривание) белков, углеводов, жиров и нуклеиновых кислот.
Гидролиз пищевых веществ начинается в просвете желудочно—кишечного тракта и
заканчивается на мембране кишечных клеток, где происходит сопряжение процессов
пищеварения и всасывания.
Моторная функция желудочно—кишечного тракта направлена на механическую
обработку потребляемой пищи, перемешивание его содержимого, обеспечивающее
контакт перевариваемых веществ с гидролитическими ферментами, на продвижение
содержимого тракта по пищеварительному каналу и выведение наружу экскрементов.
Активность гладкомышечных элементов необходима также для выведения секрета
печени и поджелудочной железы в просвет желудочно—кишечного тракта.
12.1.2. Регуляторная часть пищеварительной системы
В регуляторной части пищеварительной
системы различают местный и центральный уровни. Местный уровень
регуляции обеспечивается энтеральной нервной системой (часть метасимпатической
нервной системы, см. разд. 5.4.3) и диффузной эндокринной системой желудочно—кишечного
тракта. Центральный уровень регуляции пищеварительной системы включает
ряд структур ЦНС (спинного мозга и ствола мозга), которые входят в состав
пищевого центра.
Пищевой центр наряду с координацией
деятельности желудочно—кишечного тракта осуществляет регуляцию пищевого поведения.
Формирование целенаправленного пищевого поведения происходит с участием
гипоталамуса, лимбической системы и коры головного мозга. Промежуточным между
местным и центральным уровнями регуляции пищеварительной системы является ганглионарный,
включающий симпатические ганглии, которые располагаются вне желудочно—кишечного
тракта и центральной нервной системы.
Центральный и местный уровни
регуляции пищеварительной системы связаны эфферентными проводниками,
относящимися к симпатическому и парасимпатическому отделам вегетативной нервной
системы, которые проходят в составе блуждающих, чревных и тазовых нервов. В
этих же нервах проходят афферентные волокна, передающие информацию от сенсорных
элементов желудочно—кишечного тракта на ганглионарный и центральный уровни
регуляции пищеварительной системы.
Энтеральная нервная система. Энтеральная нервная система
представляет собой комплекс связанных между собой микроганглионарных
образований, располагающихся интрамурально, в толще стенок желудочно—кишечного
тракта. Она является частью метасимпатической нервной системы и анатомически
представлена рядом нервных сплетений, из которых наибольшее значение в
регуляции функций желудочно—кишечного тракта имеют межмышечное
(миэнтеральное, ауэрбахово) и подслизистое (мейсснерово) сплетения.
В их составе имеются чувствительные (сенсорные), эффекторные и вставочные
нейроны.
Энтеральная нервная система
(энтеральная часть метасимпатической нервной системы) в физиологическом смысле
является самостоятельной интегративной системой, обладающей структурными и
функциональными свойствами, характерными для нейронных сетей центральной
нервной системы. В ней насчитывается до 108 нейронов. Ее сенсорные
нейроны воспринимает информацию с механо—, хемо—, термо— и других рецепторов
желудочно—кишечного тракта, кодируют ее и доставляют в интегрирующие системы,
образованные интернейронами интрамуральных ганглиев — местом локализации
метасимпатической нервной ситемы. Объединенные синаптическими контактами в
сети, интернейроны обрабатывают сенсорную информацию и посылают команды к
эффекторным нейронам (возбуждающим или тормозным), образующим общий конечный
путь к исполнительным системам. К эффекторам как объектам регуляции со стороны
энтеральной части метасимпатической нервной системы относятся не только гладкие
мышцы, секреторные клетки и энтероциты, но также кровеносные сосуды,
эндокринные и иммунные клетки.
По электрофизиологическим свойствам,
изученным с применением вне— и внутриклеточных электродов, нейроны энтеральной
части метасимпатической нервной системы подразделяются на несколько типов.
Клетки с пачечным типом активности
характеризуются спонтанно возникающими, регулярными группами спайковых
потенциалов. Эти стабильно разряжающиеся нейроны не имеют синаптических входов
от других нейронов и выполняют функцию пейсмекеров (осцилляторов). Полагают,
что эти фоново—активные клетки генерируют опорный сигнал, обеспечивающий
координацию активности функциональных элементов нервных сетей. Вторая группа
спонтанно—активных нейронов с пачечным типом разрядов характеризуется
неодинаковыми межпачечными интервалами и циклически возникающими периодами
сплошной спайковой активности. Эти нейроны имеют холинергические рецепторы и
активируются находящимися с ними в паре нейронами—осцилляторами.
Кроме нейронов с пачечным типом активности в энтеральной
части метасимпатической нервной системы имеются нейроны, генерирущие одиночные
спайки. Последние возникают непрерывно и имеют относительно низкую частоту;
отсутствует их группирование в определенные паттерны. Нейроны данного типа
чувствительны к ацетилхолину и другим агонистам Н—холинорецепторов, что
свидетельствует о наличии у этих нейронов холинергического входа. Частота
спайков снижается при действии норадреналина; этот эффект опосредован α—адренорецепторами.
Указанные свойства свидетельствуют о том что клетки, генерирующие одиночные
спайки, могут быть эффекторными холинергическими нейронами.
В миэнтеральном сплетении имеются нейроны, отвечающие
увеличением частоты разрядов на механическое раздражение (механочувствительные
нейроны), которые подразделяются на медленноадаптирующиеся,
быстроадаптирующиеся и нейроны тонического типа.
По электрофизиологическим характеристикам, полученным при
внутриклеточной регистрации, нейроны энтеральной части метасимпатической
нервной системы подразделяются на 4 типа: S/1, АН/2, 3 и 4.
Нейроны типа S/1 генерируют потенциалы действия по
механизму активации—инактивации натриевых и калиевых каналов. Спайки
блокируются тетродотоксином. Эти нейроны способны проявлять спонтанную
активность. При электрической стимуляции они генерируют повторные спайки.
Нейроны АН/2 типа генерируют спайки с участием не только
натриевого и калиевого, но и кальциевого тока. Электрическая стимуляция
вызывает в нейронах АН/2 спайковые потенциалы, восходящая часть которых обусловлена
вхождением в клетку ионов натрия и кальция. Нисходящая часть спайка связана, по—видимому,
с активацией калиевых каналов; она заканчивается выраженной гиперполяризацией,
которая длится от 10 до 15 мс и отражает задержку инактивации калиевых каналов.
Отличительной чертой
потенциалов действия, генерируемых нейронами типа АН/2, является
продолжительная гиперполяризация, которая начинается через 45—80 мс после
положительного постспайкового потенциала и длится до 30 с. Амплитуда
гиперполяризации суммируется, если подряд возникают два и более потенциала
действия. Считают, что указанная следовая гиперполяризация обусловлена
повышением кальцийзависимой калиевой проводимости и является механизмом,
посредством которого автоматически достигается уменьшение клеточной
возбудимости и ограничение частоты потенциалов действия. Нейромедиаторы и
гормоны способны уменьшать следовую гиперполяризацию, в результате чего клетка
приобретает способность генерировать повторные потенциалы действия с большей
частотой.
Нейроны типа 3
характеризуются тем, что они не генерируют спайковый потенциал в ответ на
деполяризующий ток. При действии Н—холинергического стимула в них возникает
медленный возбуждающий постсинаптический потенциал (ВПСП), который не приводит
к появлению спайков.
Нейроны типа 4,
как и АН/2 нейроны, имеют высокий потенциал покоя. Для них характерно
возникновение при электрическом раздражении межганглионарных соединений
спайковых потенциалов, электротонически распространяющихся с отростков на тело
клетки.
Нейроны энтеральных
ганглиев отвечают на электрическую стимуляцию возникновением быстрого или
медленного постсинаптического потенциала, который может быть возбуждающим
(ВПСП) или тормозным (ТПСП).
Полагают, что быстрые
ВПСП обусловлены действием ацетилхолина на Н—холинорецепторы. Медленно
развивающаяся деполяризация (медленный ВПСП) сопровождается повышением
возбудимости нейрона, который начинает непрерывно генерировать импульсы в
течение нескольких секунд после прекращения действия стимула. В нейронах типа
АН/2 при этом исчезает постспайковый гиперполяризационный потенциал. Основным
кандидатом в медиаторы медленного ВПСП является серотонин. Это заключение
основано на ряде доказательств, основными из которых являются следующие.
В миэнтеральном
сплетении имеются нейроны, синтезирующие серотонин, который выделяется
из нервных окончаний при трансмуральной электрической стимуляции кишки.
Миэнтеральные нейроны обладают механизмом обратного захвата серотонина, который
прекращает его влияние на постсинаптическую мембрану. Кроме того, серотонин при
действии на нейроны типа АН/2 вызывает медленный ВПСП такого же типа, как и
ВПСП, возникающий при трансмуральной электрической стимуляции. И, наконец,
показано, что на теле нейронов, генерирующих медленный ВПСП, имеются терминали серотонинергических
нервных волокон.
Наряду с холинергическими нейронами
и адренергическими нервными окончаниями в интрамуральных ганглиях выявлены
нейроны, содержащие серотонин, гистамин, ГАМК. Кроме того, в нейронах
энтеральной части метасимпатической нервной системы обнаружен целый ряд пептидов:
холецистокинин, динорфин, энкефалины, галанин, гастрин—рилизинг пептид
(бомбезин млекопитающих), нейропептид Y, нейротензин, соматостатин,
субстанция Р, нейрокинин А (вещество К), вазоактивный
интестинальный полипептид (ВИП) и пептид, родственный гену кальцитонина.
Наряду с названными нейронами
иммунореактивность к нейропептидам проявляют и отростки экстрамуральных нервных
клеток, вступающие в стенку желудочно—кишечного тракта. Так, у морской свинки
адренергические нервы, идущие к сосудам минуя интрамуральные ганглии, содержат
нейропептид Y, а адренергические волокна, снабжающие ганглии подслизистого сплетения
наряду с норадреналином содержат соматостатин. Чувствительные волокна, идущие к спинальным ганглиям, содержат
субстанцию Р и пептид, родственный гену кальцитонина.
Каждый из нейронов энтеральной части
метасимпатической нервной системы может содержать более чем один пептид. Так, в
под слизистом сплетении 29% от общего количества нейронов составляют клетки, в
которых наряду с холинацетилтрансферазой содержатся нейропептид Y, холецистокинин и соматостатин; в 11% клеток вместе с
холинацетилтрансферазой обнаружена субстанция Р. В миэнтеральном
сплетении сочетания нейропептидов, содержащихся в одном и том же нейроне, являются
еще более разнообразными. В тонкой кишке морской свинки обнаружены 4 популяции
нейронов, одна из которых содержит ВИП совместно с динорфином, а три других —
тот же комплекс, но в сочетании с другими пептидами: гастрин—рилизинг пептидом
энкефалином и нейропептидом Y, энкефалином, гастрин—рилизинг пептидом и холецистокинином.
Желудочно—кишечный тракт млекопитающих содержит примерно
такое же количество нейронов, как и спинной мозг. С участием энтеральной
нервной системы реализуются местные рефлексы, замыкающиеся на уровне
интрамуральных ганглиев (см. разд. 5.4.3). Последние участвуют также в
реализации сигналов, поступающих по экстрамуральным нервным проводникам
(постганглионарным симпатическим и преганглионарным парасимпатическим), которые
включены в эфферентную часть дуги экстрамуральных рефлексов, замыкающихся на
уровне симпатических ганглиев, спинного или продолговатого мозга.
Желудочно—кишечный тракт получает экстрамуральную
холинергическую иннервацию по парасимпатическим волокнам блуждающего и тазового
нервов. Эти волокна являются аксонами преганглионарных нейронов, лежащих
соответственно в дорсальном моторном ядре продолговатого мозга и в сакральном
(крестцовом) отделе спинного мозга. Тазовые нервы снабжают прямую кишку и
другие дистальные отделы толстой кишки, блуждающие нервы — все остальные отделы
желудочно—кишечного тракта.
Управляющие сигналы, идущие из
центральной нервной системы по преганглионарным парасимпатическим волокнам,
поступают не к отдельным интрамуральным нейронам желудочно—кишечного тракта, а
к системе метасимпатических нейронов, в которой интегрируется информация,
поступающая из центральной нервной системы и из самого желудочно—кишечного
тракта.
Интрамуральные холинергические нейроны выполняют в энтеральной части метасимпатической
нервной системы двоякую функцию. Холинергические моторные нейроны,
воздействующие на эффекторы желудочно—кишечного тракта через посредство М—холинорецепторов,
являются конечным звеном передачи возбуждающих влияний. Холинергические интернейроны
обеспечивают Н—холинергическую активацию возбуждающих (холинергических
моторных) нейронов и неадренергических тормозных нейронов, нейромедиатором
которых могут быть NO, АТФ и ВИП.
Интрамуральные холинергические нейроны включаются в
реализацию экстрамуральных рефлексов желудочно—кишечного тракта и замыкающегося
на уровне микроганглиев миэнтерального сплетения перистальтического рефлекса.
Кроме того, указанные нейроны опосредуют эффекты ряда нейропептидов энтеральной
части метасимпатической нервной системы. Наряду с субстанцией Р и
холецистокинином, стимулирующими холинергические нейроны, имеются нейропептиды,
угнетающие их активность. Преобладающим эффектом эндогенных опиоидов мет— и
лейэнкефалина в отношении нейронов миэнтерального сплетения, в том числе и
холинергических, является подавление их возбудимости.
Нейромедиатор холинергических нейронов ацетилхолин
осуществляет свои эффекты, действуя на Н— или М—холинорецепторы. Он активирует
метасимпатические нейроны, что сопровождается кратковременным (в миллисекундном
диапазоне времени) или длительным (в течение нескольких секунд) уменьшением
мембранного потенциала. Кратковременная деполяризация блокируется антагонистами
Н—холинорецепторов и является коррелятом быстрого ВПСП, длительная —
результатом активации М—холинорецепторов и соответствует медленному ВПСП.
В соответствии с современными представлениями о молекулярных
механизмах действия ацетилхолина, Н—холинорецепторы оказывают прямое
воздействие на ионную проницаемость клеточной мембраны. У этих рецепторов
«узнающий участок», с которым связывается ацетилхолин, и ионный канал
локализованы в одной и той же макромолекуле. Соединение ацетилхолина с
рецептором вызывает конформацию этой молекулы, что приводит к открытию ионного
канала. Мускариновый холинорецептор в отличие от никотинового управляет ионным
каналом не прямо, а через систему внутриклеточных реакций.
В обычных условиях передача информации с холинергических
интернейронов на эффекторные нейроны происходит через посредство Н—холинорецепторов.
Имеющиеся на теле нейрона, наряду с никотиновыми, мускариновые рецепторы могут
выступать в роли модуляторов межнейронной передачи, влияя на быстрые ВПСП.
На нервных окончаниях эффекторных холинергических нейронов
имеются пресинаптические М—холинорецепторы. При активации избытком ацетилхолина
в синаптическом соединении рецепторы этого типа тормозят по механизму
отрицательной обратной связи выделение нейромедиатора из холинергических
нервных окончаний. Этот механизм служит для поддержания оптимальной
концентрации ацетилхолина в нейроэффекторном соединении. Указанный феномен
аутоингибирования выделения холинергического нейромедиатора имеет место не
только в нейроэффекторных, но и в межнейрональных соединениях. В последнем
случае активация пресинаптических М—холинергических рецепторов ацетилхолином
приводит к подавлению быстрых ВПСП.
Адренергическая иннервация желудочно—кишечного тракта осуществляется нейронами,
располагающимися в экстрамуральных (пара— и превертебральных) ганглиях.
Информация из центральной нервной системы поступает к ним по аксонам
преганглионарных нейронов, тела которых лежат в боковых рогах серого вещества
спинного мозга в его грудо—поясничном отделе. Нейромедиатором преганглионарных
нейронов является ацетилхолин, постганглионарных — норадреналин.
Аксоны постганглионарных (адренергических) нейронов
оканчиваются в основном на интрамуральных ганглиях межмышечного
(миэнтерального) и под слизистого сплетений, и лишь сравнительно небольшое
число нервных волокон подходит непосредственно к эффекторным клеткам.
Исключение составляют сфинктерные зоны желудочно—кишечного тракта, циркулярные
мышцы которых получают обильную адренергическую иннервацию. Адренергические
волокна располагаются также вокруг кровеносных сосудов, образуя плотное
периваскулярное сплетение. Полагают, что в нервных сплетениях желудочно—кишечного
тракта отсутствуют тела адренергических нейронов; здесь проходят лишь нервные
волокна, которые являются аксонами постганглионарных нейронов. Как исключение,
отмечено наличие небольшого числа интрамуральных катехоламинсодержащих нейронов
в проксимальном отделе толстой кишки морской свинки.
Методом флуоресцентной гистохимии
выявлены многочисленные нервные окончания адренергической природы, окружающие
энтеральные метасимпатические ганглии. Электронномикроскопически показано
наличие здесь аксо—аксональных соединений с везикулами, характерными для
адренергического синапса. Это указывает на наличие тесной функциональной связи
между симпатической нервной системой и энтеральной частью метасимпатической
нервной системы. Проявлением этой связи является пресинаптическое
адренергическое торможение. Показано, что норадреналин подавляет быстрый ВПСП,
вызванный электрической стимуляцией миэнтерального нервного сплетения и
обусловленный активацией холинергических нейронов. Вместе с тем он не влияет на
изменение мембранного потенциала, вызываемое экзогенным ацетилхолином, который
действует преимущественно постсинаптически, на М—холинорецепторы эффекторных
клеток.
Эти данные свидетельствуют о том, что
норадреналин, действуя пресинаптически, тормозит выделение ацетилхолина из
нервных окончаний. Норадреналин способен также осуществлять пресинаптическое
торможение выделения серотонина соответствующими нейронами. Об этом
свидетельствует тот факт, что норадреналин блокирует медленный ВПСП, вызванный
электрической стимуляцией, но не влияет на аналогичный потенциал, вызванный
экзогенным серотонином. Источником адренергических влияний на желудочно—кишечный
тракт являются не только постганглионарные нейроны симпатической нервной
системы, но и их аналог — мозговой слой надпочечников, содержащий хромаффинные
клетки. Последние продуцируют катехоламины (в основном адреналин), которые
поступают в систему кровообращения. Норадреналин в симпато—адреналовой системе
выступает в роли нейромедиатора, а адреналин, действующий на клетки—мишени
через систему кровообращения, является гормоном.
В функциональном отношении клетки энтеральной нервной
системы являются или возбуждающими, или тормозными. Основными возбуждающими
нейронами являются холинергические. Торможение в энтеральной нервной системе
может быть связано с тормозным адренергическим воздействием на холинергический
нейрон, активирующий эффекторную клетку. Торможение, которое обусловлено
вовлечением других механизмов, обозначают как неадренергическое
нехолинергическое. По современным представлениям, неадренергическое
нехолинергическое торможение обусловлено выделением из окончаний
соответствующих энтеральных нейронов NO, АТФ и ВИП. Основным кандидатом в
нейромедиаторы нехолинергического возбуждения в энтеральной части
метасимпатической нервной системы является субстанция Р.
Диффузная эндокринная система. Наряду с нейронной сетью в
желудочно—кишечном тракте имеются эндокринные клетки, располагающиеся в
эпителиальном слое слизистой оболочки и в поджелудочной железе, которые
содержат моноамины и вещества пептидной природы (гастроинтестинальные гормоны).
Разбросанность эндокринных клеток по желудочно—кишечному тракту (табл. 12.1)
позволила обозначить всю их совокупность термином диффузная эндокринная
система (APUD—система). Подобные клетки обнаружены также в легких, коже,
щитовидной железе, гипофизе, мозговом слое надпочечников, в симпатических
ганглиях, однако по количеству клеток и разнообразию их типов желудочно—кишечный
тракт занимает среди них первое место.
Таблица 12.1
Типы и
локализация эндокринных клеток пищеварительного тракта и образуемые ими
продукты
|
Типы клеток |
Образуемые продукты |
Место расположения клетки |
|||||
|
Поджелудочная железа |
Желудок |
Кишечник |
|||||
|
Фундальная часть |
Антральная часть |
Тонкая кишка |
Толстая кишка |
||||
|
проксимальный отдел |
дистальный отдел |
||||||
|
ЕС |
Серотонин, субстанция Р, энкефалины |
Мало |
+ |
+ |
+ |
+ |
+ |
|
D |
Соматостатин |
+ |
+ |
+ |
+ |
Мало |
Мало |
|
В |
Инсулин |
+ |
— |
— |
— |
— |
— |
|
РР |
Панкреатический полипептид (ПП) |
+ |
— . |
— |
— |
— |
— |
|
А |
Глюкагон |
+ |
— |
— |
— |
— |
— |
|
Х |
Неизвестны |
— |
+ |
— |
— |
— |
— |
|
ECl |
Неизвестны (серотонин? гистамин?) |
— |
+ |
— |
— |
— |
— |
|
G |
Гастрин |
— |
— |
+ |
+ |
— |
— |
|
CCK |
Холецистокинин (ХЦК) |
— |
— |
— |
+ |
Мало |
— |
|
S |
Секретин |
— |
— |
— |
+ |
Мало |
— |
|
GIP |
Желудочный. ингибирующий пептид (ЖИП) |
— |
— |
— |
+ |
Мало |
— |
|
M |
Мотилин |
— |
— |
— |
+ |
Мало |
— |
|
N |
Нейротензин |
— |
— |
— |
Мало |
+ |
Редко |
|
l |
Глюкагоноподобный пептид, глицентин |
— |
— |
— |
Мало |
+ |
+ |
|
GRP |
Гастрин—рилизинг пептид |
— |
Мало |
+ |
+ |
— |
— |
|
VIP |
Вазоактивный интестиальный пептид (ВИП) |
|
|
|
|
|
|
Типы клеток, их
локализация и содержащиеся в них пептиды приведены в табл. 12.1. Некоторые из
них аналогичны пептидам, содержащимся в нейронах энтеральной нервной системы
(см. выше). В ряде клеток (EC1, EC2) наряду с пептидами обнаружен серотонин. В
слизистой оболочке желудка имеются клетки (ECl), содержащие гистамин. Последний
синтезируется также в тучных клетках слизистой оболочки кишки.
Высвобождение
гастроинтестинальных гормонов из соответствующих клеток происходит при действии
на них ацетилхолина, катехоламинов, других регуляторных пептидов, при
механическом и химическом воздействиях на эндокринные клетки из просвета
желудочно—кишечного тракта.
Регуляторное влияние (табл.
12.2) на клетки—мишени диффузная эндокринная система желудочно—кишечного тракта
осуществляет двумя путями: эндокринным и паракринным. При эндокринном пути
физиологически активное вещество, высвобождаясь из клетки, попадает в
кровеносные капилляры,
Таблица 12.2
Некоторые желудочно—кишечные гормоны
|
Гормон |
Секретирующая ткань |
Ткань—мишень |
Основное действие |
Факторы, стимулирующие
секрецию |
|
Гастрин |
Желудок и двенадцатиперстная
кишка |
Секреторные клетки и мышцы желудка |
Образование и секреция НСl; стимуляция подвижности желудка |
Активность блуждающего нерва пептиды и белки, находящиеся в
желудке |
|
Холецистокинин— панкреозимин (ХЦК—ПЗ)* |
отдел тонкой кишки |
Желчный пузырь |
Сокращение желчного пузыря |
Жирные кислоты в двенадцатиперстной кишке |
|
Поджелудочная железа |
Секреция панкреатического сока |
|||
|
Секретин |
Двенадцатиперстная кишка |
Поджелудочная железа;секреторные
клетки и мышцы желудка |
Секреция воды и NaHCO3;
угнетение моторной активности желудка |
Пища и сильные кислоты в желудке
и тонкой кишке |
|
Желудочный ингибирующий пептид
(ЖИП) |
Верхний отдел тонкой кишкки |
Слизистая оболочка и мускулатура
желудка |
Угнетение активности желудка; стимуляция
дуоденальных желез |
Моносахариды и жиры в
двенадцатиперстной кишке |
|
Вазоактивный интестинальный
пептид (ВИП)* |
Двенадцатиперстная кишка |
— |
Усиление панкреатического сока; угнетение
желудочной секреции |
Жиры в двенадцатиперстной кишке |
|
Энтероглюкагон |
Двенадцатиперстная кишка |
Тонкая кишка, поджелудочная железа |
Угнетение моторной активности и
секреции |
Углеводы в двенадцатиперстной кишке |
|
Энкефалин* |
Тонкая кишка |
Желудок, поджелудочная железа,
кишка |
Стимуляция секреции НСl; угнетение секреции ферментов
поджелудочной железой и моторной активности кишки |
|
|
Соматостатин* |
Тонкая кишка |
Желудок; кишка; чревные
артериолы |
Угнетение секреции НСl; секреции поджелудочного сока, моторной активности кишки и кровотока
в чревных сосудах |
|
* Пептиды обнаружены также и в тканях ЦНС и известные как нейропептиды. В число нейропептидов, не включенных в данный список, но
идентифицированных как в головном мозгу, так и в кишечной ткани, входят субстанция р, нейротензин, бомбезин, инсулин, панкреатический полипептид и
кортикотропин.
проходит портальную систему печени, малый круг кровообращения и, лишь
попав в большой круг, с артериальной кровью приносится к клеткам—мишеням. При паракринном
пути вещество, выделившееся в межклеточное пространство, не попадает в
кровеносное русло, а действует на рядом находящуюся клетку—мишень. Существенную
роль в регуляции функций желудочно—кишечного тракта, играют, по—видимому,
простагландины групп Е и F.
12.1.3. Интеграция
нейромедиаторных и гормональных факторов в пищеварительной cистеме
Нейрогуморальная регуляция
пищеварительной системы имеет многофакторный характер: эффекторные
клетки желудочно—кишечного тракта могут подвергаться нейрогенным влияниям,
которые опосредованы нейронами, содержащими нейромедиаторы с различной
химической структурой, а также воздействию целого ряда веществ гормональной
природы. Нервные и эндокринные элементы пищеварительной системы взаимосвязаны и
объединяются в нейроэндокринные регуляторные контуры (цепи).
Принципиально возможные связи между нервными и эндокринными элементами
пищеварительной системы иллюстрирует схема, представленная на рис. 12.3.
|
|
|
Рис. 12.3 Пути передачи информации в регуляторных контурах
пищеварительной системы: с нейрона на нейрон (А), на эффекторную (Б) или эндокринную (В)
клетку, с эндокринной клетки паракринным (Г) . или эндокринным (Д) способом
на нейрон, эффекторную клетку или эндокринную клетку другого типа 1 — нейрон, 2 —
эндокринная клетка, 3 — секреторная или мышечная клетка, 4 — кровеносный сосуд. |
Функциональная интеграция регуляторных воздействий в
пищеварительной системе может проявляться в различных эффектах. Так, при
поступлении нейрогенного или гормонального стимула к нейрону или другим
возбудимым клеткам возможна инициация или модуляция их активности. В первом
случае стимул выполняет роль триггера, запускающего активность покоящихся
клеток, во втором — он изменяет уровень активности функционирующих клеток. При
кооперативных (совместных) воздействиях нейрогенных или гормональных факторов
на эффекторную клетку может проявляться потенцирование или ингибирование
функциональных эффектов. Потенцирование имеет место в том случае, когда величина
эффекта, вызываемого совместным действием двух стимулов, превышает сумму
эффектов, вызываемых каждым стимулом в отдельности. Термином ингибирование
обозначают уменьшение эффекта, вызываемого одним стимулом при одновременном
действии другого.
В регуляции функций пищеварительной системы большое
значение, как и в других физиологических системах, имеет механизм обратной
связи.
Структурно—функциональная
организация пищеварительной системы, характерная для высших животных и человека,
сформировалась в результате длительного эволюционного развития. В современном
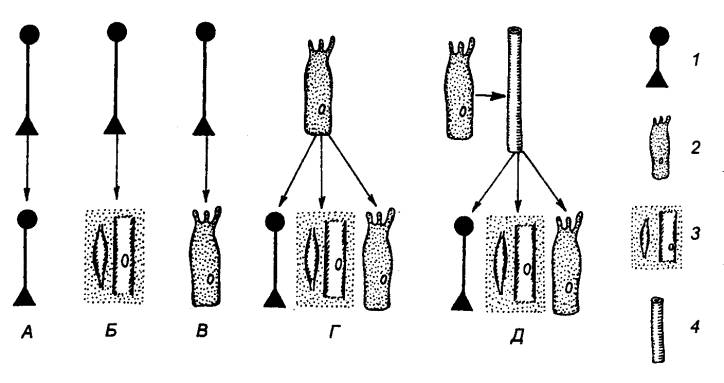
животном мире существует три различных типа пищеварения (рис. 12.4):
внутриклеточное внеклеточное дистантное и мембранное (пристеночное,
контактное).
Внутриклеточное пищеварение. Ферментный гидролиз пищевых веществ
при этом типе пищеварения осуществляется внутри клетки. Внутриклеточное
пищеварение распространено у простейших и наиболее примитивных многоклеточных
организмов (губки, плоские .черви). У немертин, иглокожих, кольчатых
|
|
|
Рис.
12.4 Основные типы. пищеварения А — внеклеточное дистантное
пищеварение; В —
внутриклеточное цитоплазматическое пищеварение; В — внутриклеточное вакуолярное, или внеплазматическое, пищеварение,
связанное с эндоцитозом (фаго— или пинопитозом); Г — мембранное пищеварение. 1 — внеклеточная среда, 2
— субстраты и продукты их
гидролиза, 3 — ферменты, 4—
внутриклеточная среда, 5 — мембрана, в
— ядро, 7 — внутриклеточная пищеварительная вакуоль, 8 — мезосома. |
червей и моллюсков оно является
дополнительным механизмом гидролиза. У высших позвоночных животных и человека
внутриклеточное пищеварение имеет ограниченное значение и выполняет защитные
функции (фагоцитоз).
Внеклеточное дистантное пищеварение. При данном типе пищеварения
ферменты, синтезированные секреторными клетками, выделяются во внеклеточную
среду, где и реализуется их гидролитический эффект в отношении пищевых веществ.
Этот тип пищеварения является основным у организмов, стоящих на более высоком,
чем плоские черви, этапе эволюционного развития. Он преобладает у кольчатых
червей, ракообразных, насекомых, головоногих, оболочников, хордовых и особенно
развит у высокоорганизованных животных и человека. Внеклеточное пищеварение
называют дистантным, так как у перечисленных организмов секреторные клетки
удалены от полостей, в которых реализуется действие ферментов.
Дистантное пищеварение может осуществляться не только в
специальных полостях (полостное пищеварение), но и за пределами
организма, которому принадлежат клетки, продуцирующие ферменты. Так, некоторые
насекомые вводят пищеварительные ферменты в обездвиженную добычу, а бактерии
выделяют различные ферменты в культуральную среду.
Мембранное (пристеночное, контактное) пищеварение. Мембранное пищеварение, открытое А.
М. Уголевым в 1957 г., пространственно занимает промежуточное положение между
внеклеточным и внутриклеточным пищеварением и осуществляется ферментами,
локализованными на структурах мембраны кишечных клеток (подробнее см. разд.
12.4.1). Предполагали, что одним из возможных путей эволюции пищеварения могло
быть совершенствование и дифференциация внутриклеточного пищеварения, в
результате чего возникло полостное и мембранное пищеварение. По современным
представлениям, ни один из трех известных до сих пор типов пищеварения —
полостное (внеклеточное), внутриклеточное и мембранное — не может считаться
филогенетически более новым или более древним. На всех уровнях организации
животных (от простейших до млекопитающих) встречаются все три основных типа
пищеварения, хотя у высокоорганизованных животных внутриклеточное пищеварение
как механизм усвоения пищевых веществ в основном утрачивает свое значение. Типы
пищеварения характеризуют не только по месту действия, но и по источникам
ферментов. По этому критерию
|
|
|
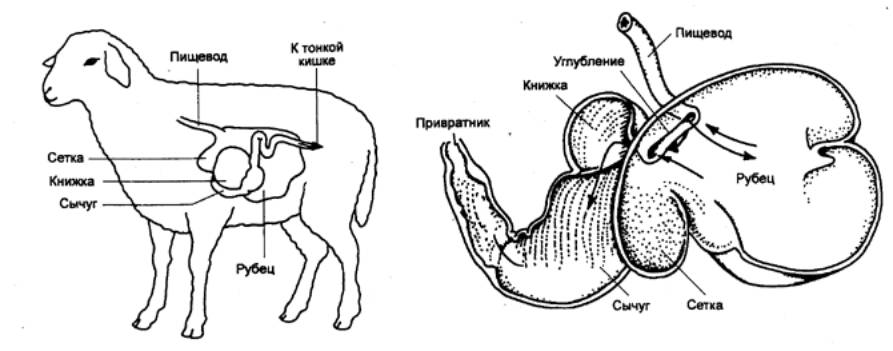
Рис. 12.5 Желудок
жвачных,состоящий из четырех камер, которые образуют два отдела. Рубец
и сетка относятся к ферментативному отделу желудка, книжка и сычуг (истинный желудок) к пищеварительному. |
выделяют: 1) собственное
пищеварение, когда источником ферментов является сам организм; 2) симбионтное
пищеварение, которое реализуется за счет микроорганизмов желудочно—кишечного
тракта; 3) аутолитическое пищеварение.
Человек и многие виды
животных в основном обладают собственным пищеварением. Симбионтное
пищеварение у них имеет второстепенное значение. Однако продукция витаминов
и некоторых незаменимых аминокислот осуществляется микроорганизмами желудочно—кишечного
тракта.
У жвачных животных
симбионтное пищеварение преобладает. Начальные отделы их сложного желудка
(рубец и сетка) заполнены микрофлорой, которая участвует в переваривании
целлюлозы и других компонентов растительной пищи. Из рубца и сетки
микроорганизмы попадают в сычуг, в котором происходит .переваривание микробных
тел, заканчивающееся в кишке (рис. 12.5). Симбионтное пищеварение характерно
также для сумчатых и широко распространено у низших организмов, в частности у
членистоногих. Симбионтами некоторых животных (гигантский двустворчатый
моллюск, турбеллярия, кораллы и др.) кроме микроорганизмов могут быть
водоросли, поставляющие
хозяину
пищевые вещества.
Термином аутолитическое
пищеварение обозначают переваривание пищи за счет содержащихся в ней
ферментов. Например, при поедании травоядными животными свежих кормов
расщепление компонентов последних частично осуществляется ферментами,
находящимися в клетках этих растений. Определенную роль в пищеварении у
новорожденных детей могут иметь гидролитические ферменты, содержащиеся в
материнском молоке.
Согласно экскреторной теории,
существующие в организме два типа секреции — внешняя и внутренняя —
явились результатом функциональной специализации клеток и произошли от свойственной
всем клеткам неспецифической экскреции — выделения из них продуктов обмена
веществ.
Секреторная функция
желудочно—кишечного тракта осуществляется пищеварительными железами.
Различают железы трубчатого типа (железы желудка и кишки) и ацинарные
железы. Последние состоят из групп клеток, объединенных вокруг протока, в
который выделяется секрет (слюнные железы, печень, поджелудочная железа).
Клетки пищеварительных
желез по характеру продуцируемого ими секрета подразделяются на белок—,
мукоид— и минералсекретирующие. В составе секрета желез в полость
желудочно—кишечного тракта поступают ферменты, осуществляющие гидролиз пищевых
веществ, хлористоводородная кислота (НCl) и гидрокарбонат, создающие
оптимальный для гидролиза уровень рН в полости желудочно—кишечного тракта,
желчные соли, играющие важную роль в переваривании и всасывании жиров, а также
мукоидные вещества, составляющие основу желудочной слизи.
Секреторный цикл. Периодически повторяющиеся в
определенной последовательности процессы, которые обеспечивают поступление из
кровеносного русла в клетку воды, неорганических и низкомолекулярных
органических соединений, синтез из них секреторного продукта и выведение его из
клетки, составляют секреторный цикл.
Наиболее изучен
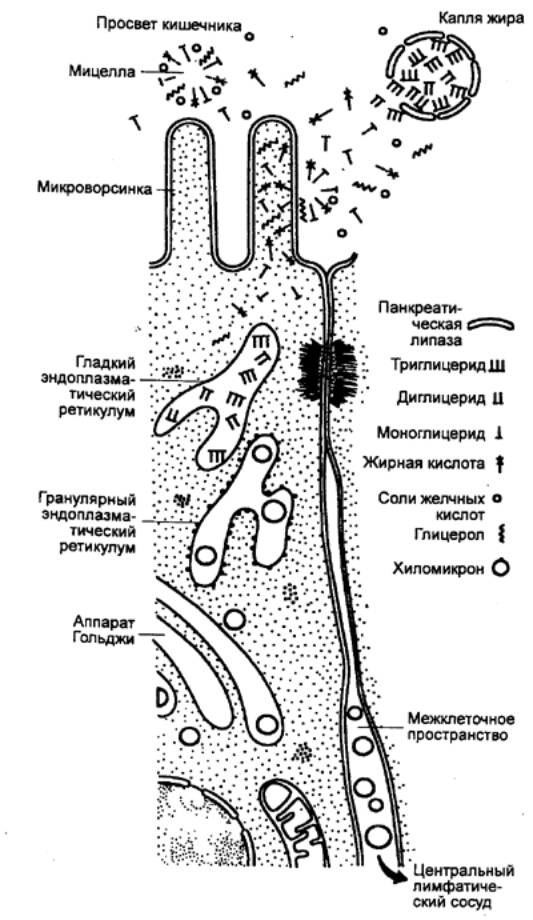
секреторный цикл белоксинтезирующих клеток. В нем выделяют несколько фаз. После
поступления в клетку (рис. 12.6) через базальную мембрану исходных веществ на
рибосомах гранулярного эндоплазматического ретикулума секретируется первичный
секреторный продукт, созревание которого происходит в аппарате Гольджи. Секрет
накапливается в конденсирующих вакуолях, которые затем превращаются в гранулы
зимогена. Последние представляют собой неактивные ферменты (проферменты),
окруженные липопротеиновой оболочкой. После накопления гранул наступает фаза
выхода их из клетки (дегрануляция). Выведение зимогена из клетки происходит
посредством экзоцитоза: гранула подходит к апикальной части клетки, оболочка
гранулы сливается с мембраной и через образовавшееся в ней отверстие содержимое
гранулы выходит наружу. Клеточные механизмы секреции у позвоночных и
беспозвоночных животных сходны.
В зависимости от
временного соотношения фаз секреторного цикла секреция может быть непрерывной
или прерывистой. Первый тип секреции присущ поверхностному эпителию
пищевода и желудка, секреторным клеткам печени. Поджелудочная и крупные слюнные
железы образованы клетками с прерывистым типом секреции.
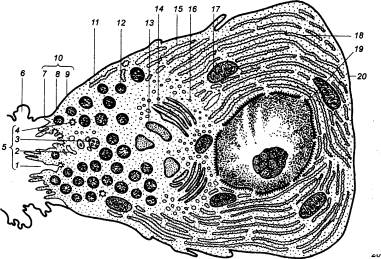
|
|
|
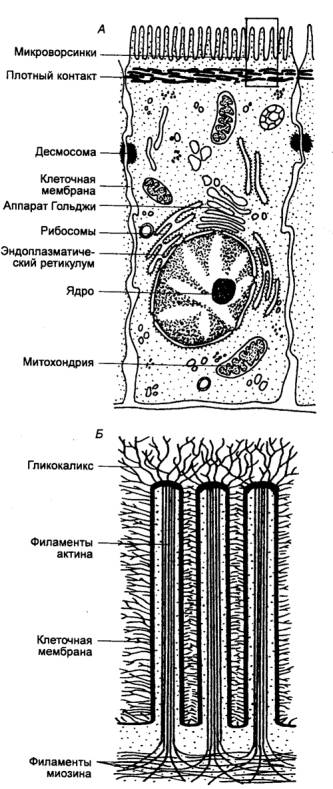
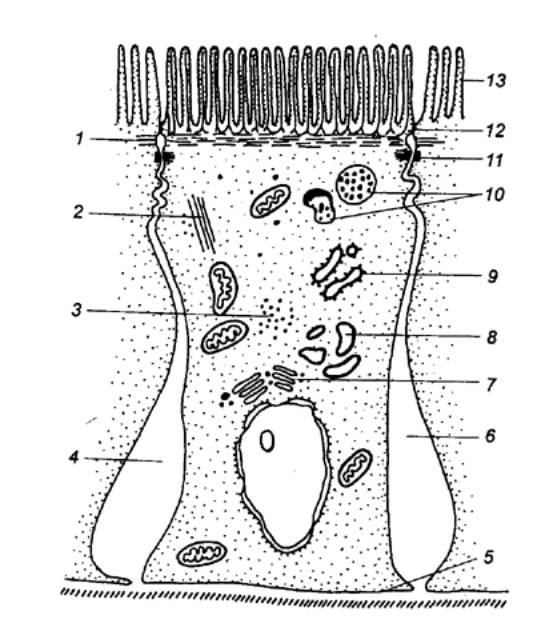
Рис. 12.6 Панкреатическая ацинарная клетка 1 — кавеола, 2 — эндоцитозные везикулы, 3 — окаймленные везикулы, 4 — мультивезикулярные тельца, 5 —
апикальная зона клетки, 6 —
полость пищеварительного канала, 7 — плотный контакт, 8 — промежуточный контакт, 9 — десмосомы, 10 —
комплекс контактов, 11 —
плазматическая мембрана, 12 — гранулы зимогена, 13
— конденсирующая вакуоль, 14
— цистерны аппарата Гольджи, 15
— промежуточные элементы, 16
— пузырьки Гольджи, 17 —
митохондрии, 18 — гранулярный
эндоплазматический ретикулум, 19 —
ядро, 20— базальная мембрана. |
Мембранный потенциал секреторных
клеток. Этот потенциал
характеризуется низкой скоростью изменения, градуальностью. Возбуждение
большинства секреторных клеток сопровождается деполяризацией их мембраны.
Исключение составляют клетки слюнных желез, в которых преобладает
гиперполяризация, а возникающая в начале фаза деполяризации весьма
кратковременна. Базальная и апикальная мембраны секреторных клеток поляризованы
не одинаково. Разность потенциалов, равная 2—3 мВ, создает электрическое поле в
20—30 В/см. Возбуждение секреторной клетки, сопровождающееся возникновением
секреторного потенциала, усиливает различие в поляризованности мембран, что
способствует перемещению секреторного продукта к апикальной части клетки.
Секреция пищеварительных желез
характеризуется адаптацией к пищевому рациону. Она проявляется в
изменении интенсивности продукции секрета каждой клеткой, в количестве клеток,
одновременно функционирующих в составе данной железы, а также в изменении
соотношения между различными гидролитическими ферментами.
Слюна — смешанный секрет трех пар больших
слюнных желез: околоушных (серозных), поднижнечелюстных (серозно—слизистых),
подъязычных (слизистых), а также многочисленных малых желез, рассеянных
по слизистой оболочке полости рта. Малые и подъязычные железы постоянно
вырабатывают секрет, увлажняющий полость рта; околоушные и поднижнечелюстные
железы секретируют слюну лишь при их стимуляции. За 1 сут у человека
вырабатывается 0,5—2,0 л слюны. Она содержит гидролитический фермент α—амилазу,
мукополисахариды, гликопротеины, белки, ионы (Na+, К+, Са2+, Сl—, НСО3— и
др.). Кроме того, в меньших количествах в слюне содержатся такие ферменты, как
лизоцим, катепсины, калликреин.
Реакция слюны
колеблется от слабокислой при небольших до слабощелочной при значительных
объемах секреции (рН 5,8—7,8). Концентрация ионов увеличивается с повышением
скорости секреции, однако слюна всегда имеет меньшее осмотическое давление, чем
плазма крови. Это обусловлено процессами активной секреции и реабсорбции,
происходящими в протоках слюнных желез.
Секрецию слюнных желез
возбуждает прием пищи и связанный с ним комплекс условно— и
безусловнорефлекторных раздражителей. Афферентные пути рефлексов проходят по
чувствительным волокнам тройничного, лицевого, языкоглоточного и блуждающего
нервов, эфферентные — по холинергическим и адренергическим волокнам автономных
нервов, идущих к слюнным железам.
Холинергические
воздействия (стимуляция парасимпатических нервов, вызывающая выделение
ацетилхолина, холиномиметик пилокарпин и др.) приводят к секреции большого количества
жидкой слюны. Раздражение симпатических нервов, сопровождающееся выбросом
норадреналина, приводит к образованию небольшого количества слюны, богатой
органическими веществами. У человека на стимуляцию симпатических нервов
отвечают лишь поднижнечелюстные железы.
Желудочный сок продуцируется неоднородными в
морфологическом отношении клетками, входящими в состав желудочных желез, и
клетками поверхностного эпителия. Железы, располагающиеся в области дна (свода)
и тела желудка, содержат клетки трех типов: 1) главные, вырабатывающие
комплекс протеолитических ферментов; 2) обкладочные, продуцирующие НCl;
3) добавочные (мукоидные) клетки, секретирующие слизь (муцин),
мукополисахариды, гастро—мукопротеин («внутренний фактор») и гидрокарбонат. В
антральном отделе (привратниковой пещере) желудка железы состоят в основном из
мукоидных клеток.
Секреторные клетки дна и тела
желудка выделяют кислый и щелочной секрет, а клетки антрального отдела — только
щелочной. У человека объем суточной секреции желудочного сока составляет 2,0—3,0
л. Натощак реакция желудочного сока нейтральная или щелочная; после приема пищи
— сильнокислая (рН 0,8—1,5).
Протеолитические ферменты. В главных клетках желез желудка
синтезируется пепсиноген — неактивный предшественник пепсина,
являющегося основным гидролитическим ферментом желудочного сока.
Синтезированный на рибосомах профермент накапливается в виде гранул зимогена и
путем экзоцитоза выбрасывается в просвет желудочной железы. В полости желудка
от пепсиногена отщепляется ингибирующий белковый комплекс и профермент
превращается в пепсин. Активация пепсиногена запускается НСl, а в дальнейшем протекает
аутокаталитически: пепсин сам активирует свой профермент.
Термином пепсин в настоящее
время обозначают смесь нескольких протеолитических ферментов. Так, у человека
обнаружено 6—8 различных ферментов, различающихся иммуногистохимически. В
желудочном соке человека имеется также другой протеолитический фермент — гастриксин.
Так называемые кислые протеазы, к
которым относится пепсин, у беспозвоночных животных практически не встречаются,
в желудке жвачных животных в период, когда они питаются молоком матери,
обнаружен химозин (реннин) — фермент, створаживающий молоко.
Предполагают, что пепсин, гастриксин и реннин, имеющие общие черты в
последовательности аминокислотных остатков, произошли в ходе эволюции от одного
общего предшественника.
Желудочная слизь. Желудочная слизь продуцируется
добавочными клетками шеек желез дна и тела желудка, мукоидными клетками
кардиальных и пилорических желез и клетками поверхностного эпителия. Слизь
состоит из высокомолекулярных биополимеров — мукоидных веществ, имеющихся во
всех тканях организма и представленных двумя типами макромолекул —
гликопротеинами и протеогликанами.
Специфическим стимулятором
биосинтеза и секреции желудочной слизи является простагландин Е (ПГЕ).
Связывание его с рецепторами мукоцитов стимулирует ПГЕ—чувствительную
аденилатциклазу и повышает концентрацию цАМФ, что приводит к фосфорилированию
эндогенных ферментных белков и включению процессов синтеза и внутриклеточного
транспорта молекул слизи. Предполагают, что ПГЕ опосредует стимулирующее
влияние на муцинобразующие клетки желудка серотонина и соматостатина. Секрецию
указанными клетками синтезированных гликопротеинов и протеогликанов вызывают
холиномиметики, действующие на М—холинорецепторы, а также раздражение
эфферентных волокон блуждающего нерва. Этот эффект связывают с увеличением
внутриклеточной концентрации ионов кальция.
Клетки поверхностного эпителия
желудка наряду с муцином секретируют гидрокарбонаты, что обеспечивает
образование слизисто—гидрокарбонатного барьера, предотвращающего повреждающее
воздействие на слизистую оболочку желудка НCl и пепсина. Секреция
гидрокарбонатов происходит по типу активного транспорта. Предполагают, что ионы
НСО3— выходят через апикальную мембрану клеток в обмен на
ионы Cl—. В процессах генерации и секреции ионов НСО3—
важную роль, по—видимому, играет, карбоангидраза клеток поверхностного
эпителия, поскольку ингибирование данного фермента приводит к снижению
|
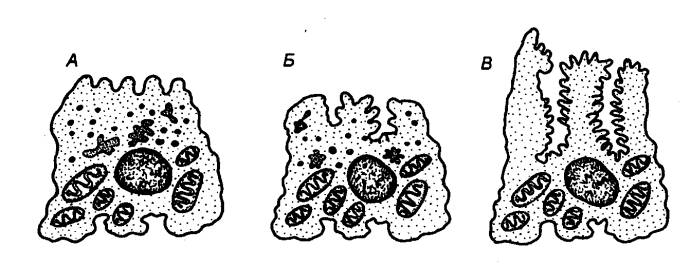
|
|
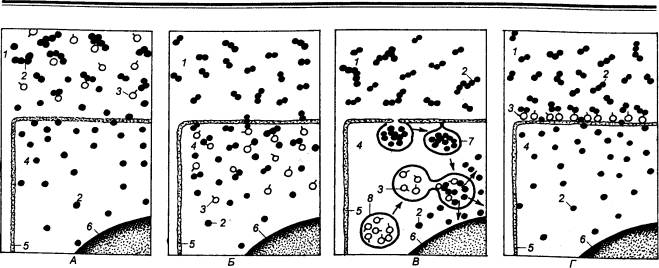
Рис. 12.7 Обкладочная клетка в различных
функциональных состояниях А — покой; Б —
субмаксимальное раздражение; В —
максимальное раздражение. |
количества щелочного секрета в желудке.
Секреция гидрокарбонатов зависит от уровня рН в желудке. Показано, что НCl усиливает секрецию гидрокарбонатов
за счет повышения тканевой концентрации простагландинов. Усиление секреции
ионов НСО3— наблюдается при электрической стимуляции
блуждающего нерва у кошек и при его активации, вызванной ложным приемом пищи, у
людей.
Хлористоводородная
кислота (НCl).
Она продуцируется обкладочными клетками. Это доказано наличием прямо
пропорциональной зависимости между числом обклад очных клеток и максимальной
секрецией НCl. Характерной особенностью обкладочных клеток (рис. 12.7) является
наличие в них секреторных канальцев. Они представляют собой глубокие впячивания
клеточной поверхности, имеющей микроворсинки. В покоящейся клетке секреторные
канальцы выражены плохо, вместо них в клетке обнаруживаются пузырчатые
образования — тубуловезикулы. В активной секретирующей клетке тубуловезикулы
исчезают, а секреторные канальцы увеличиваются в размерах.
Концентрация ионов Н+
в желудочном соке составляет примерно 150—170 ммоль/л, а в плазме крови —
0,00005 ммоль/л. Из сопоставления этих величин следует, что градиент
концентрации водородных ионов в желудочном соке и плазме может достигать 3 х 106.
Существуют две
гипотезы, объясняющие возникновение градиента ионов Н+: окислительно—восстановительная
и энергетическая. В соответствии с первой гипотезой атом водорода
превращается в протон в результате отщепления электрона и переноса его на
кислород с образованием ионов ОН—, которые при участии фермента карбоангидразы
в свою очередь превращаются в ионы НСО3—. По второй
гипотезе, ионы Н+ выводятся из клетки с помощью энергозависимого
ионного насоса. При этом ионы ОН— остаются внутри клетки, где они,
соединяясь с СО2 при участии карбоангидразы, образуют НСО3—.
Эти гипотезы основаны
на следующих экспериментальных данных: 1) выделение одного иона Н+ в
просвет желудка соответствует появлению в плазме крови одного иона НСО3—;
2) для образования ионов H+ и НСО3— необходима
карбоангидраза, так как подавление активности этого фермента приводит к
угнетению секреции НCl; 3) высокий градиент концентрации H+
создается в результате активного транспорта, требующего затрат энергии, и для
образования двух ионов Н+ требуется приблизительно 1 моль О2.
Регуляция
желудочной секреции. В регуляции желудочной секреции центральное место занимают ацетилхолин,
гастрин и гистамин. Каждый из них возбуждает секреторные клетки.
Вместе с тем показано, что при совместном (кооперативном) воздействии этих
веществ секреторный ответ превышает сумму ответов на каждый из них в
отдельности, т. е. наблюдается эффект потенцирования.
Ацетилхолин, выделяющийся из холинергических
волокон блуждающего нерва, оказывает непосредственное возбуждающее действие на
секреторные клетки желудка. Кроме того, он вызывает выделение гастрина из G—клеток
антрального отдела желудка. Гастрин поступает в кровоток и действует на
секреторные клетки эндокринным путем. Гистамин, образующийся в слизистой
оболочке желудка, накапливается в энтерохромаффинных (крысы, мыши) или тучных
(другие животные, человек) клетках. Гистамин оказывает свое действие на
секреторные клетки желудка паракринным путем, через посредство Н2—гистаминовых
рецепторов.
Таким образом, в регуляции активности секреторных клеток
желудка имеет место интеграция нейромедиатора ацетилхолина,
гастроинтестинального гормона гастрина и тканевого гормона гистамина. Феномен
потенцирования был продемонстрирован в опытах на собаках, в которых
исследовалось совместное действие на секрецию НCl следующих пар веществ:
холиномиметик и гастрин, холиномиметик и гистамин. Было также показано, что
блокада М—холинорецепторов атропином приводит к снижению секреторного ответа не
только на холиномиметики но также на гастрин и гистамин. Циметидин — блокатор Н2—гистаминовых
рецепторов тормозит реакцию не только на гистамин, но и на холиномиметики и
гастрин. Перерезка блуждающего нерва, т. е. устранение холинергического
стимулирующего влияния на париетальные клетки, приводит к снижению их
секреторного ответа на гастрин и гистамин. Эти данные позволили заключить что
париетальные клетки подвергаются постоянному воздействию фоновых концентраций
ацетилхолина и гистамина, которые создают повышенную чувствительность клеток к
гастрину и дополнительным дозам указанных веществ. Устранение в результате
блокады М—холинорецепторов или ваготомии фонового воздействия ацетилхолина
приводит к снижению секреторной реакции на гастрин и гистамин, а исключение
фонового воздействия гистамина блокадой Н2—гистаминовых рецепторов —
к торможению реакции на холиномиметики и гастрин.
В регуляции желудочной секреции
немаловажную роль играет интеграция гастрина с соматостатином. Соматостатин,
продуцируемый D—клетками слизистой оболочки антрального отдела желудка,
тормозит выделение гастрина, действуя на G—клетки паракринным путем, и тем
самым тормозит активность главных и обклад очных клеток. Об этом
свидетельствуют следующие экспериментальные факты. Инфузия в просвет
изолированного желудка крысы антисыворотки, инактивирующей соматостатин,
вызывает резкое повышение концентрации гастрина в оттекающей из просвета
желудка перфузионной жидкости. Кроме того, при ряде воздействий обнаружена
отрицательная корреляционная связь между концентрациями гастрина и
соматостатина в исследуемых средах. Так, в ответ на введение в желудок пищевых
веществ или щелочного раствора концентрация соматостатина снижается, гастрина —
повышается. Холинергический агонист метахолин, введенный в изолированный
желудок крысы, тормозит освобождение соматостатина, увеличивая одновременно
выделение гастрина. И, наконец, действие секретина, глюкагона и вазоактивного
интестинального пептида сопровождается усилением освобождения соматостатина при
одновременном угнетении секреции гастрина.
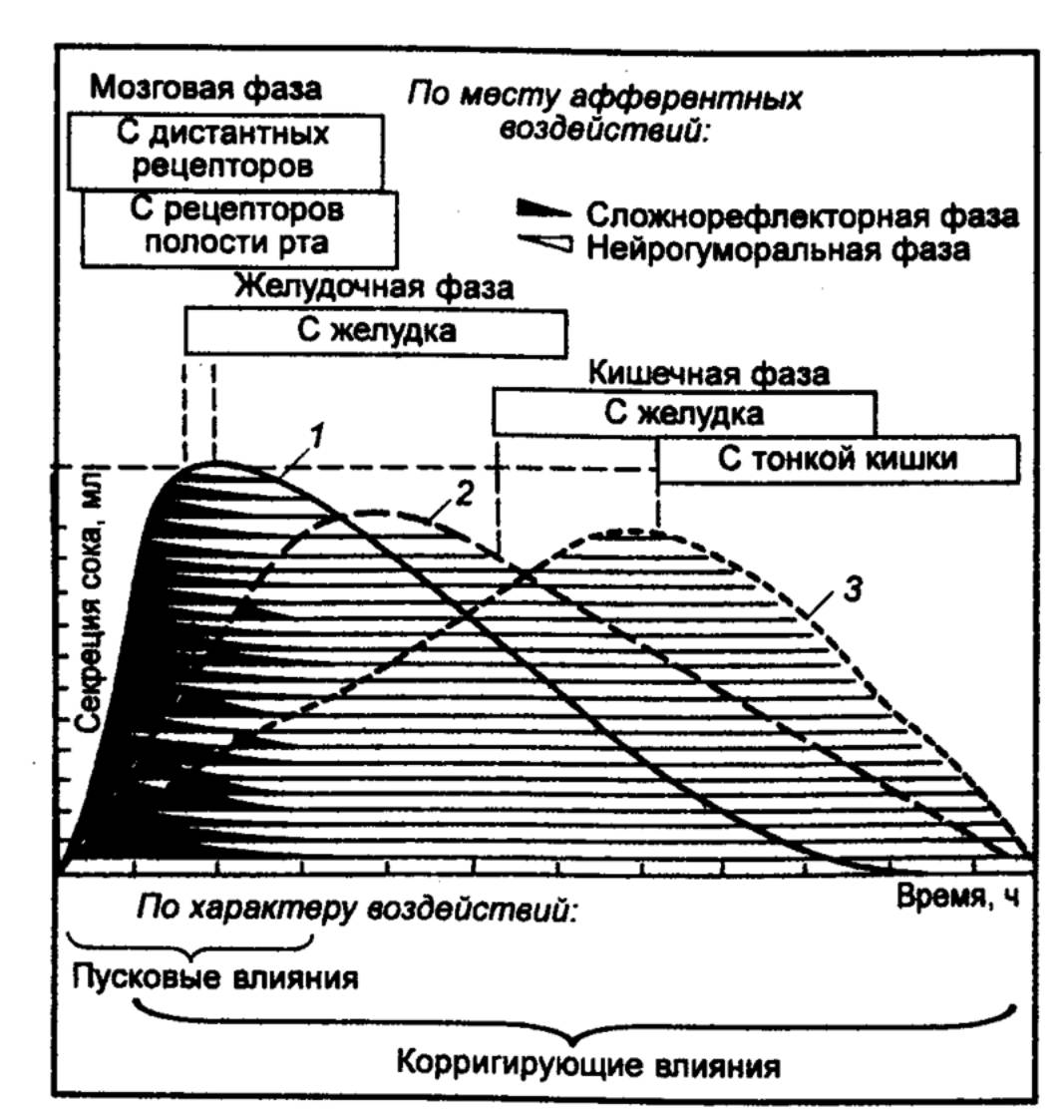
В регуляции желудочной секреции
выделяют три фазы — мозговую, желудочную и кишечную — в зависимости от
места действия раздражителя (рис. 12.8). Стимулами для возникновения секреции
желудочных желез в мозговой фазе являются все факторы, сопровождающие
прием пищи. При этом условные рефлексы, возникающие на вид, запах пищи,
обстановку, предшествующую ее приему, комбинируются с безусловными рефлексами,
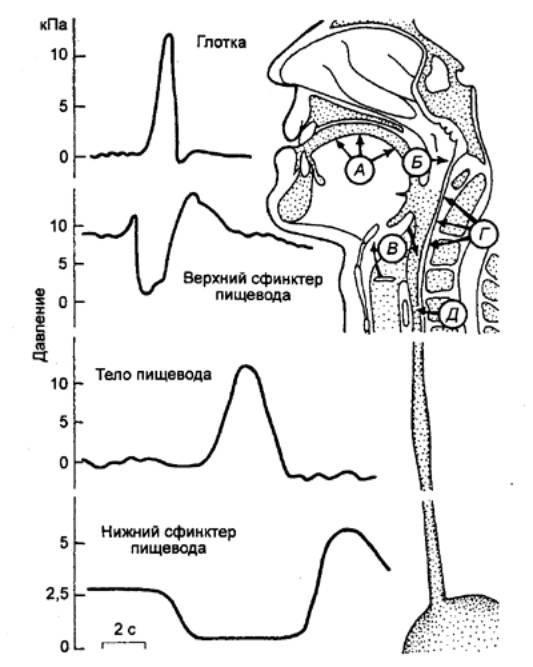
возникающими при жевании и глотании. Доказательство мозговой фазы желудочной
секреции было получено в работах И. П. Павлова, выполненных на
эзофаготомированных собаках с изолированным желудочком, выкроенным из тела и
дна желудка и сохраняющим иннервацию волокнами блуждающего нерва.
В опытах с мнимым кормлением
проглоченная собакой пища выпадает из перерезанного пищевода, не попадая в
желудок. Тем не менее при этом наблюдается обильная секреция желудочного сока
изолированным желудочком (мозговая фаза, безусловнорефлекторный компонент).
Если мнимое кормление собаки сочетается со звуковым раздражителем, через
несколько дней вырабатывается условный рефлекс: выделение слюны и желудочного
сока возникает в ответ на один звук (мозговая фаза, условнорефлекторный
компонент).
В желудочной фазе стимулы секреции возникают в самом
желудке. Секреция усиливается при растяжении желудка (механическая стимуляция)
и действии на его слизистую оболочку продуктов гидролиза белка, некоторых
аминокислот, а также экстрактивных веществ мяса и овощей. Активация желудочных
желез растяжением желудка осуществляется с участием как местного
(интрамурального), так и вагусного рефлекса. Афферентные и эфферентные пути
последнего проходят по блуждающим нервам. Конечным медиатором этих рефлексов
является ацетилхолин. В реакцию на раздражение механорецепторов желудка могут
вовлекаться гистамин и гастрин, высвобождающиеся под влиянием ацетилхолина
(рис. 12.9).
В механизмах фазовой регуляции желудочной секреции отмечены
видовые различия. Так, секреторный ответ на растяжение фундальной области (дна)
желудка человека в отличие от реакции у собаки не сопровождается повышением
концентрации гастрина в крови, т. е. имеет место фундо—фундальный рефлекс
без вовлечения гастриновых клеток, локализующихся в антральной части желудка.
Растяжение антральной области желудка у собаки усиливает желудочную секрецию,
приводя к высвобождению гастрина. У человека такой реакции не наблюдается.
Наоборот, растяжение антрального отдела вызывает рефлекс, подавляющий секрецию
желудочных желез.
|
|
|
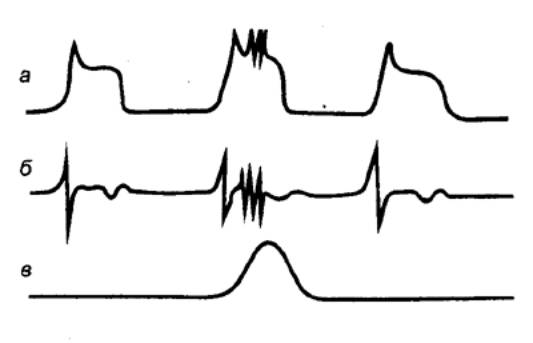
Рис. 12.8 Фазы
секреции главных пищеварительных желез 1 — желудочная секреция при выраженной мозговой фазе; 2 — желудочная секреция при
заторможенности мозговой фазы; 3 — секреция поджелудочной железы. |
|
|
|
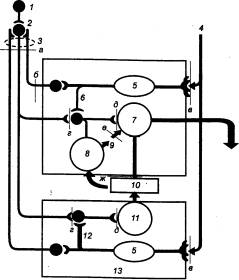
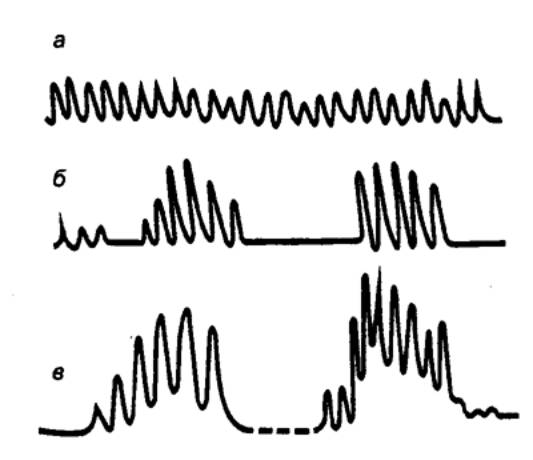
Рис. 12.9 Регуляция
выработки НCl в желудке 1 — высшие центры, 2
— ядра блуждающих нервов, 3 — блуждающие нервы, 4 — пищевые раздражители
(механические и химические), 5 — рецепторная клетка, 6 — дно желудка, 7 —
обкладочная клетка, 8 —
гистаминсодержащая клетка, 9 —
гистамин (паракринный), 10 —
гастрин (эндокринный), 11 —
гастринсодержащая клетка, 12 —
антральный отдел желудка, 13 —
слизистая оболочка. Факторы, угнетающие секрецию НCl: а, б — пересечение блуждающих нервов; в — блокада рецепторов
под действием местноанестезирующих средств или низкого рН; г — блокада Н—холинорецепторов,
ганглиоблокада; д —
антагонист ацетилхолина (блокатор М—холинорецепторов); е — блокада
гистаминовых Н2—рецепторов; ж —
антагонист гастрина (секретин). |
Химическими возбудителями секреции
желудочных желез являются продукты гидролиза белков: полипептиды и аминокислоты.
Эти раздражители также усиливают выделение гастрина. Гастринпродуцирующие клетки
снабжены микроворсинками, обращенными в полость желудка, с помощью которых как
полагают, эти клетки воспринимают химические раздражения. Гастрин вызывает
выделение НCl обкладочными клетками. При значении рН в антральном отделе желудка ниже
3 выделение гастрина подавляется. Это свидетельствует о наличии в системе
регуляции секреции НCl отрицательной обратной связи. Соматостатин тормозит
желудочную секрецию, оказывая угнетающее действие на Гастринпродуцирующие
клетки.
Влияния на железы желудка, поступающие
с кишечника, определяют их функционирование в третьей, кишечной, фазе
секреции. Секреция вначале возрастает, а затем снижается. Стимуляция желудочных
желез является прежде всего результатом поступления в кишечник содержимого
желудка, недостаточно обработанного механически и химически. Возможно, усиление
желудочной секреции на этой стадии связано с выделением гастрина G—клетками
двенадцатиперстной кишки. При значении рН дуоденального содержимого ниже 4
секреция желудочного сока угнетается.
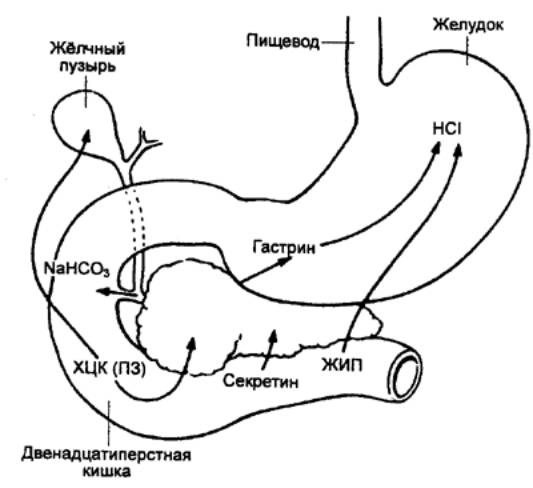
На желудочную секрецию в кишечной
фазе может влиять и выделение из слизистой оболочки двенадцатиперстной кишки секретина.
Он тормозит секрецию НCl, но усиливает секрецию пепсиногена. Резкое торможение
желудочной секреции возникает при поступлении в двенадцатиперстную кишку жира.
Этот эффект обусловлен, по—видимому, тормозным влиянием на железы желудка
холецистокинина и желудочного ингибирующего пептида. Возможно, в торможении
секреции НCl при поступлении содержимого желудка в двенадцатиперстную кишку
определенную роль играет энтерогастральный рефлекс.
Из гастроинтестинальных пептидов,
оказывающих влияние на секреторный процесс в желудке, следует отметить также
гастрин—рилизинг пептид, который усиливает секрецию НCl. Циркулирующие в крови
катехоламины также могут вызывать освобождение гастрина и тем самым
стимулировать секрецию НCl. Торможение активности обкладочных клеток вызывают
глюкагон, вазоактивный интестинальный пептид, нейротензин и серотонин.
Тормозным влиянием на главные и обкладочные клетки характеризуется также
действие простагландинов группы Е.
Среди факторов, влияющих на
желудочную секрецию, существенное значение имеют эмоциональное возбуждение и
стресс. Вероятно, именно в этих случаях проявляются адренергические влияния на
желудочную секрецию. Показано, что активация симпатоадреналовой системы может
приводить к угнетению секреции НCl. Вместе с тем известно, что если одни виды
эмоционального возбуждения (страх, тоска) вызывают торможение, то другие
(раздражение, ярость) — усиление секреторной функции желудка.
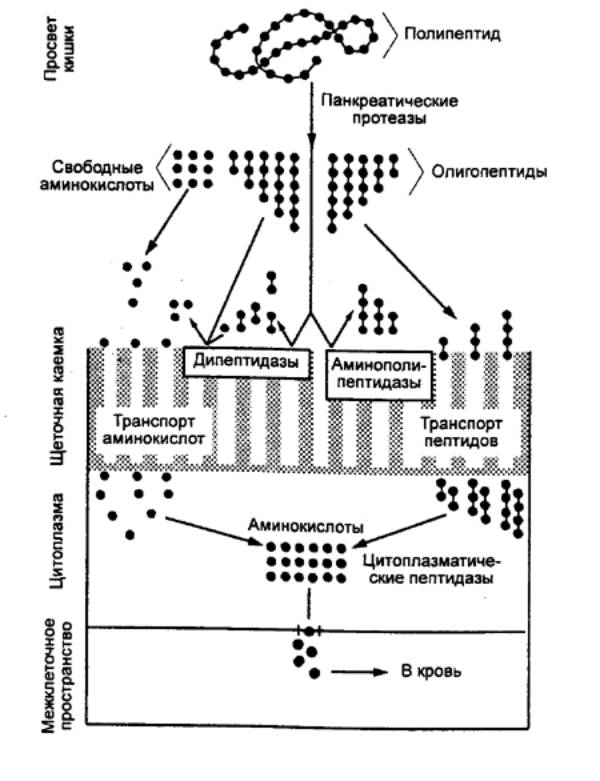
Ацинарные клетки поджелудочной железы продуцируют гидролитические
ферменты, расщепляющие все компоненты пищевых веществ (табл. 12.3). α—амилаза,
липаза и нуклеаза секретируются в активном состоянии, а трипсиноген,
химотрипсиноген, профосфолипаза А, проэластаза и прокарбоксипептидазы А и В — в
виде проферментов. Трипсиноген активируется ферментом двенадцатиперстной кишки
энтерокиназой и превращается в трипсин. После образования трипсина
дальнейшая активация его предшественника происходит аутокаталитически. Трипсин
активирует также профосфолипазу А,
Таблица 12.3
Ферменты, секретируемые поджелудочной железой
|
Характер действия |
Участок гидролитического расщепления |
|
Протеолитические |
|
|
Эндопептидазы |
Внутренние пептидные связи между соседними аминокислотными остатками |
|
Трипсин |
Между остатками основных аминокислот, остатками ароматических
аминокислот, остатками гидрофобных аминокислот в эластине |
|
Химотрипсин |
|
|
Эластаза |
|
|
Экзопептидазы |
Концевые пептидные связи |
|
Карбоксипептидазы |
СООН—конец (А — неосновные аминокислоты, В — основные аминокислоты) |
|
Аминопептидазы |
N—конец |
|
Амилолитические |
|
|
α—амилаза |
α—1,4—Гликозидные связи в полимерах глюкозы |
|
Липолитические |
Эфирные связи |
|
Липаза |
В положениях 1 и 3 триглицеридов |
|
Фосфолипаза А2 |
В положении 2 фосфоглицеридов |
|
Холестеролаза |
В эфирах холестерола |
|
Нуклеотические |
|
|
Рибонуклеаза |
Фосфодиэфирные связи между нуклеотидами в рибонуклеиновых кислотах |
проэластазу и прокарбоксипептидазы А
и В, которые превращаются соответственно в фосфолипазу a2, эластазу и карбоксипептидазы А и Б.
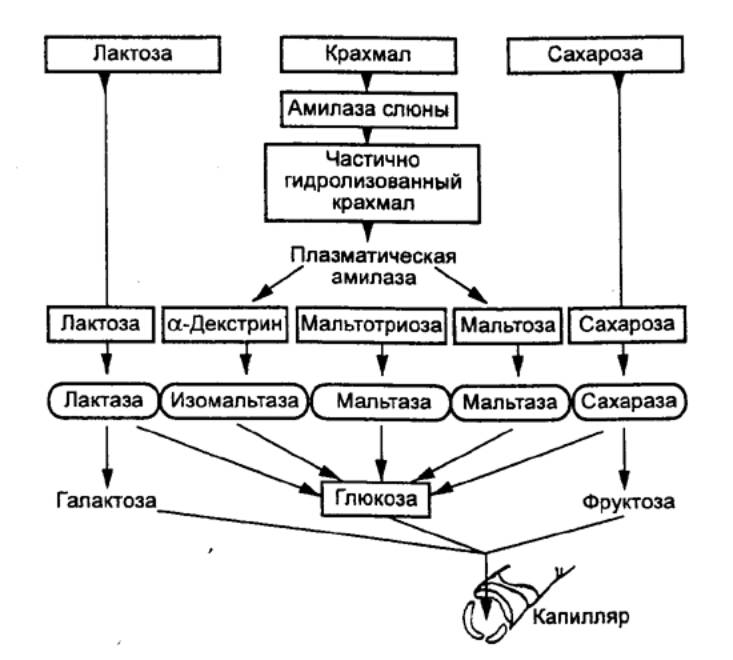
Ферментный состав сока поджелудочной
железы зависит от вида потребляемой пищи: при приеме углеводов возрастает
преимущественно секреция амилазы, при приеме белков — трипсина и химотрипсина,
при приеме жирной пищи отмечается секреция сока с повышенной липолитической
активностью. При длительном поддержании определенного пищевого рациона
секреторный процесс в поджелудочной железе претерпевает устойчивые адаптивные
сдвиги, проявляющиеся в изменениях количества сока и соотношения секретируемых
ацинарными клетками ферментов.
Клетки протоков поджелудочной железы
являются источником гидрокарбоната. Хлориды, также представляющие важный
компонент секреции электролитов, выделяются, по—видимому, ацинарными клетками
вместе с ферментами. В составе сока поджелудочной железы кроме бикарбоната и
хлоридов имеются ионы Na+, K+, Ca2+ Mg2+ Zn2+
В сутки поджелудочная железа
человека вырабатывает 1,5—2 л сока; его рН составляет в среднем 7,5—8,8.
Различают спонтанную (базальную) и стимулированную секрецию поджелудочной
железы. Базальная секреция обусловлена присущим клеткам поджелудочной
железы автоматизмом. Стимулированная секреция является результатом
воздействия на клетки регуляторных факторов нейрогуморальной природы, которые
включаются в действие приемом пищи.
У плотоядных животных (собака, кошка)
и свиньи базальная секреция электролитов невелика или вообще отсутствует;
поджелудочная железа этих животных весьма чувствительна к действию секретина —
стимулятора секреции электролитов. У травоядных (корова, овца, кролик) и у
крысы отмечается выраженная базальная секреция электролитов поджелудочной
железой и слабая ее реакция на секретин. Человек по характеристике базальной
секреции электролитов относится к первой группе.
Основными стимуляторами экзокринных
клеток поджелудочной железы являются ацетилхолин и гастроинтестинальные
гормоны — холецистокинин и секретин. Ацетилхолин выделяется
холинергическими волокнами блуждающих нервов, окончания которых образуют
неплотные контакты с мембраной ацинарных и протоковых клеток. Экзогенный
ацетилхолин усиливает секрецию поджелудочной железы, увеличивая выход
гидрокарбоната и ферментов. Усиление секреции отмечено также при электрическом
раздражении эфферентных волокон блуждающего нерва.
Холецистокинин высвобождается из
слизистой оболочки двенадцатиперстной кишки под влиянием продуктов
переваривания жира и белка, секретин — при действии на S—клетки
двенадцатиперстной кишки НCl (рН 4,5). Холецистокинин является сильным
стимулятором выделения ферментов поджелудочной железы и лишь незначительно
усиливает секрецию гидрокарбоната. Секретин, наоборот, стимулирует
преимущественно секрецию гидрокарбоната, слабо влияя на выделение ферментов.
Холецистокинин и секретин взаимно потенцируют действие друг друга:
холецистокинин усиливает вызванную секретином секрецию гидрокарбоната, а
секретин усиливает продукцию ферментов, стимулированную холецистокинином.
В процессе регуляции секреции
поджелудочной железы имеет место тесное взаимодействие между
гастроинтестинальными гормонами и холинергическим медиатором, опосредующим
центральные и местные рефлекторные влияния на секреторные клетки поджелудочной
железы. Холинергические влияния проявляют потенцирующее воздействие в отношении
вызываемых холецистокинином и секретином секреторных реакций.
Электронно—микроскопические
исследования показали, что нервные окончания в поджелудочной железе являются
почти исключительно холинергическими. Симпатические волокна образуют в
поджелудочной железе периваскулярные сплетения. Адренергические. окончания,
редко встречающиеся в паренхиме, подходят к интрамуральным ганглиям
поджелудочной железы. Прямые адренергические влияния на секреторные
клетки поджелудочной железы представляются маловероятными, однако симпатические
нервные волокна могут оказывать на них непрямые влияния, воздействуя на нейроны
интрамуральных ганглиев. Кроме того, адренергические влияния на кровеносные
сосуды поджелудочной железы, изменяя ее кровоснабжение, могут влиять и на
секреторную функцию.
Естественным стимулятором секреции
поджелудочной железы является прием пищи. Начальная, мозговая фаза
секреции поджелудочной железы была изучена в лаборатории И. П. Павлова в опытах
с мнимым кормлением. Она вызывается видом, запахом пищи (условнорефлекторное
раздражение), жеванием и глотанием (безусловнорефлекторное раздражение).
Эфферентные пути этих рефлексов проходят в составе блуждающих нервов.
В формировании мозговой фазы секреции поджелудочной железы
могут участвовать механизмы, которые связаны с рефлекторными влияниями,
опосредованными холинергическими волокнами блуждающего нерва: непосредственная
стимуляция клеток поджелудочной железы ацетилхолином; вагусная стимуляция секреции НCl обкладочными клетками и поступление
ее в двенадцатиперстную кишку, где НCl вызывает выделение секретина,
стимулирующего секрецию поджелудочной железы.
В желудочной фазе секреции
поджелудочной железы активирующее влияние на ее клетки оказывает ваго—вагальный
рефлекс, возникающий в результате растяжения стенок желудка.
Поступление содержимого желудка в
двенадцатиперстную кишку обусловливает последовательное воздействие на ее
слизистую оболочку НCl и продуктов переваривания жира и белка, что вызывает
высвобождение секретина и холецистокинина; эти гормоны и определяют механизмы
секреции поджелудочной железы в кишечной фазе. Высвобождение
холецистокинина и секретина из слизистой оболочки двенадцатиперстной кишки
усиливается рефлекторно активируемыми холинергическими механизмами. Возможно, в
формирования кишечной фазы секреции поджелудочной железы принимают участие и
другие гастроинтестинальные гормоны.
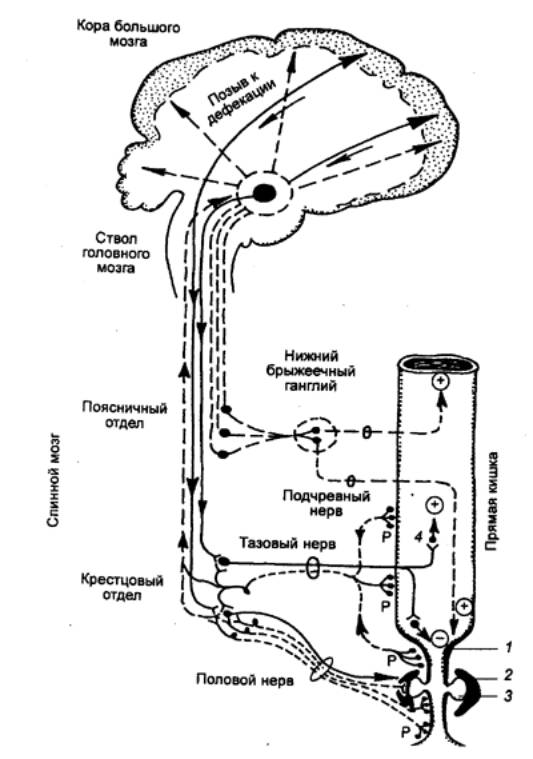
12.2.4. Желчеотделение и
желчевыделение
Желчеотделение (холерез). Это процесс образования желчи
печенью. Образование желчи происходит непрерывно путем фильтрации ряда веществ
(вода, глюкоза, электролиты и др.) из крови в желчные капилляры и посредством
активной секреции клетками печени (гепатоцитами) солей желчных кислот и ионов Na+. Окончательное формирование состава
желчи происходит в результате реабсорбции воды и минеральных солей в желчных
капиллярах, протоках и желчном пузыре.
Желчь содержит продукты не только
секреторной, но и экскреторной деятельности печени, направленной на выведение
из организма ряда веществ. У человека за сутки образуется 0,5—1,5 л желчи.
Основными компонентами желчи являются желчные кислоты, пигменты и холестерин.
Кроме того, она содержит жирные кислоты, муцин, различные ионы (Na+ K+, Са2+, Cl—,
НСО3—) и другие вещества; рН печеночной желчи составляет 7,3—8,0,
пузырной — 6,0—7,0.
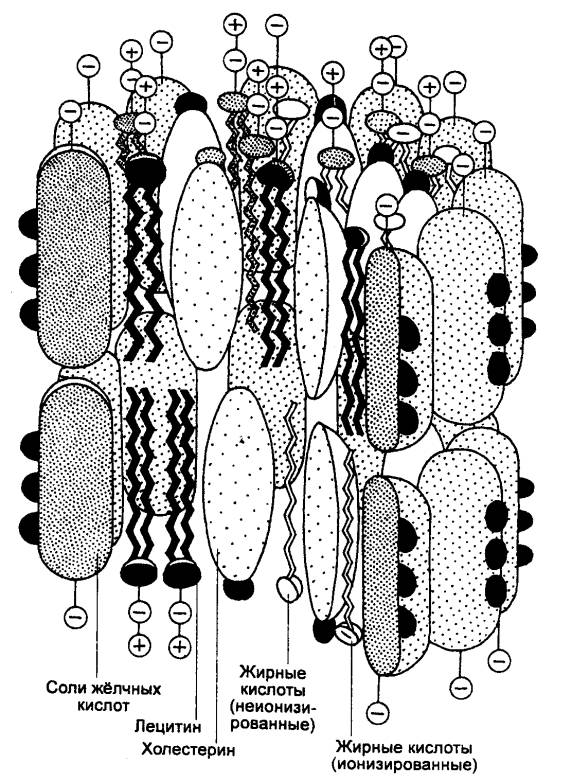
Первичные желчные кислоты (холевая и хенодезоксихолевая),
образующиеся в гепатоцитах из холестерина, соединяются с глицином или таурином
и выделяются в виде натриевой соли гликохолевой и калиевой соли таурохолевой
кислот. В кишке под влиянием бактериальной флоры они превращаются во вторичные
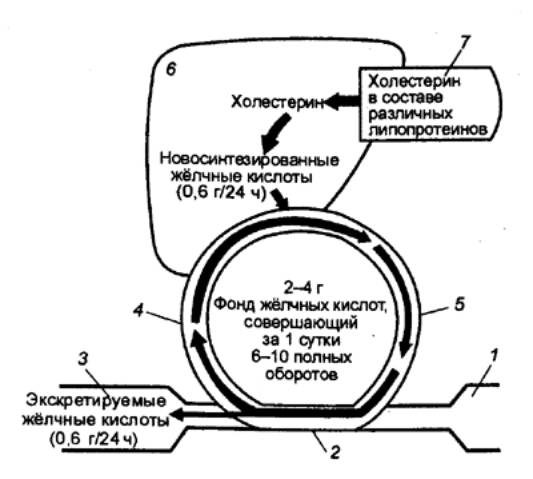
желчные кислоты — дезоксихолевую и литохолевую. До 90% желчных кислот
активно реабсорбируется из кишки в кровь и по портальным сосудам возвращается в
печень. Таким образом осуществляется печеночно—кишечная циркуляция желчных
кислот (рис. 12.10).
|
|
|
Рис. 12.10 Печеночно—кишечная циркуляция желчных кислот 1 — желудок, 2 —
тонкая кишка, 3 — ободочная кишка, 4
— область воротной вены, 5 — область желчных ходов, 6 — печень, 7 — кровь. |
Желчные пигменты (билирубин и биливердин) представляют собой
экскретируемые печенью продукты распада гемоглобина. Они придают желчи ее
характерную окраску. У человека и плотоядных
|
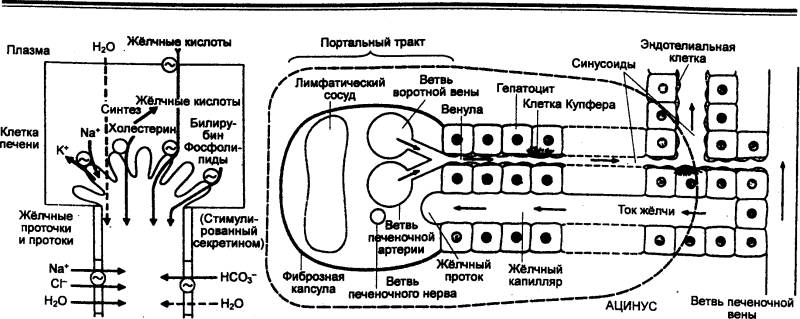
|
|
Рис. 12.11 Механизмы секреции
желчи (слева) и упрощенная схема печеночного ацинуса (портальный тракт показан
в поперечном разрезе, ветвь печеночной вены — в продольном) |
животных преобладает билирубин,
определяющий золотисто—желтый цвет желчи, у травоядных — биливердин,
окрашивающий ее в зеленый цвет.
Процесс образования желчи
усиливается в результате приема пищи. Наиболее сильным стимулятором холереза
является секретин, под влиянием которого усиливается объем секреции и выделение
в составе желчи гидрокарбоната. На процесс желчеобразования существенное
влияние оказывают всасывающиеся в кровь из тонкой кишки желчные кислоты: они
увеличивают объем желчи и содержание в ней органических компонентов.
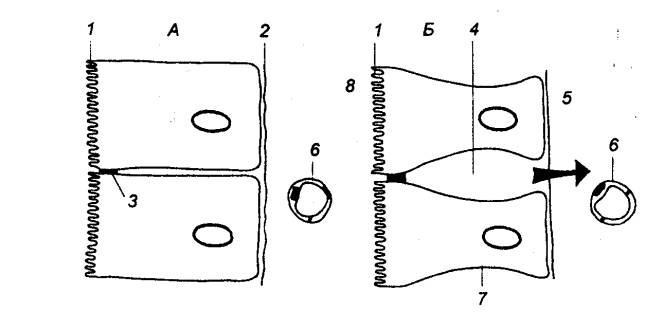
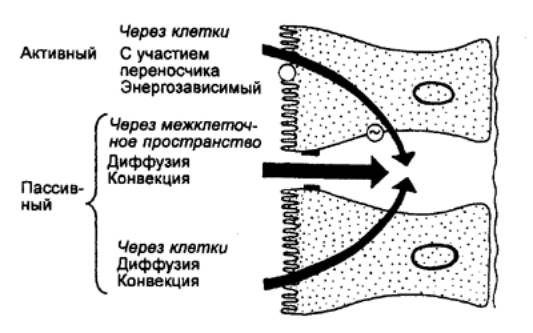
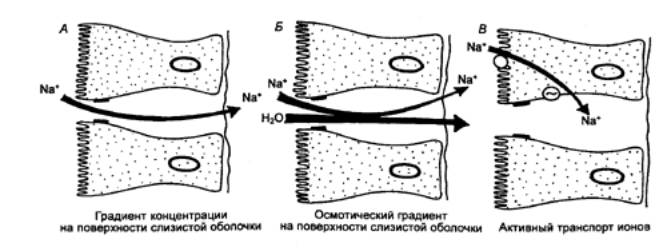
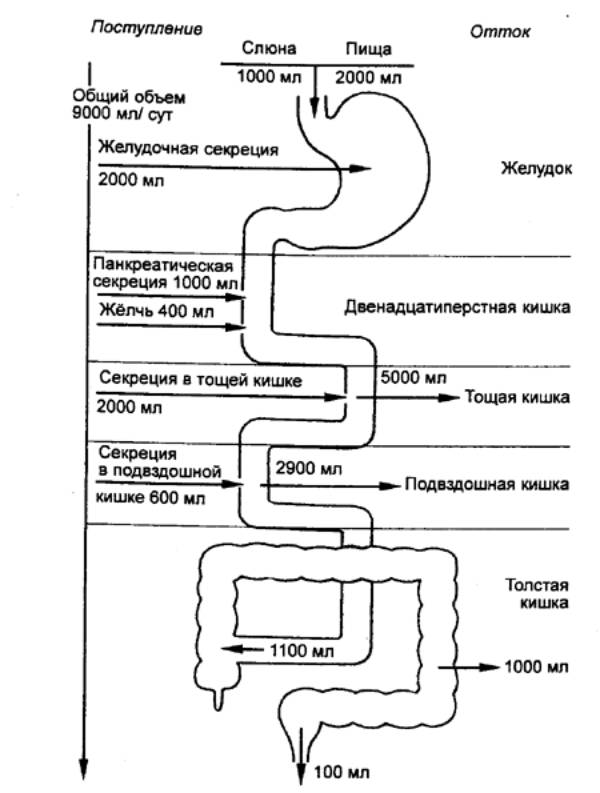
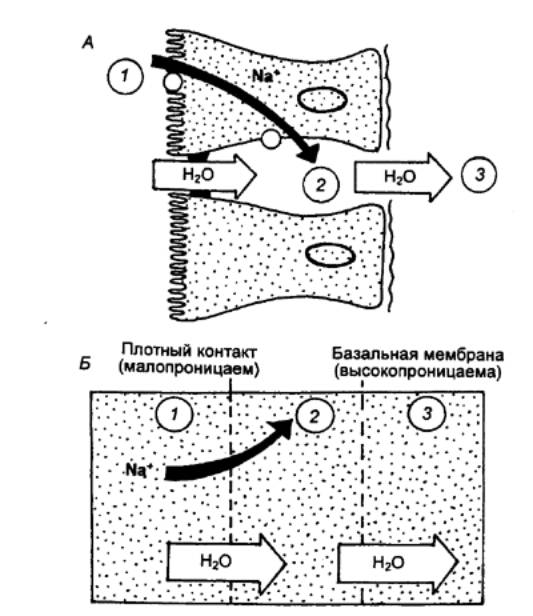
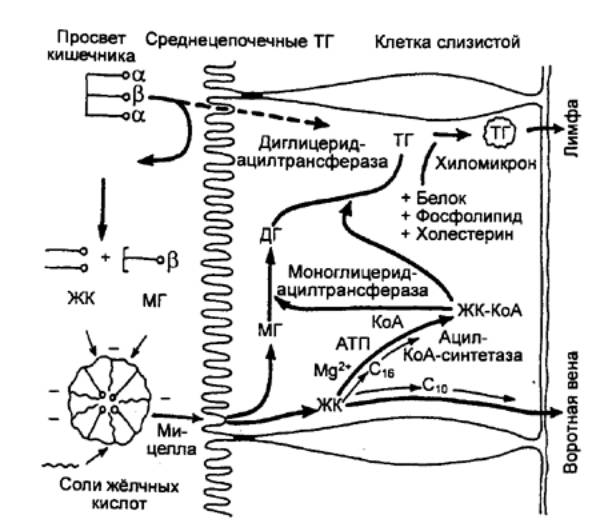
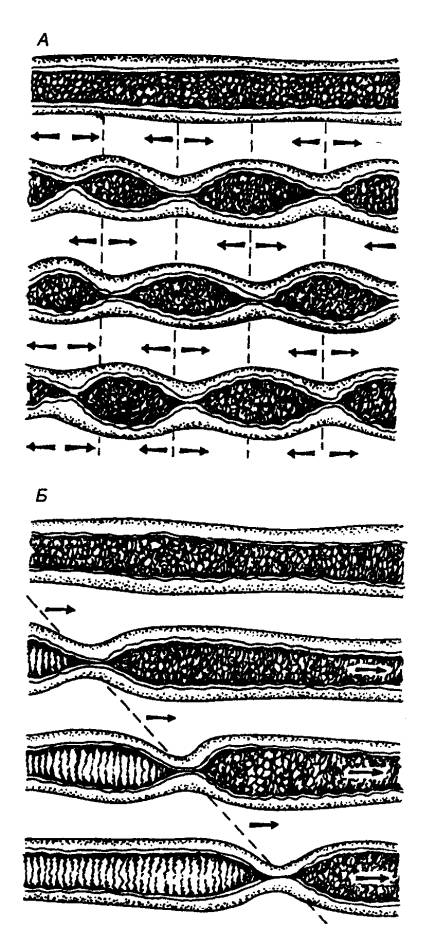
Процесс секреции желчи включает два
компонента: зависимый от желчных кислот и независимый от них (рис. 12.11). В
первом случае желчные кислоты поглощаемые клетками печени из портальной
(воротной вены) крови или синтезированные в них заново, транспортируются в
канальцы. Во втором случае в результате активного образования ионов Na+
секретируются электролиты. Под действием первичной желчи ионы Na+, Cl—, НСО3—
секретируются в желчные протоки, а вслед за ними под действием осмотического
давления выходит вода.
Желчевыделение (холекинез). Поступление желчи в
двенадцатиперстную кишку в отличие от желчеотделения является периодическим процессом
связанным в основном с приемом пищи. Движение желчи обусловлено градиентом
давления в желчевыделительной системе и в полости двенадцатиперстной кишки.
Давление в путях оттока желчи создается за счет самого процесса
желчеобразования, сокращений гладких мышц протоков и желчного пузыря. Эти
сокращения согласованы с активностью трех сфинктеров, располагающихся в месте
слияния общего желчного и пузырного протоков, в шейке желчного пузыря и в
концевом отделе общего желчного протока (сфинктер ампулы, или Одди).
Основным стимулятором сократительной
активности желчного пузыря является холецистокинин. Сильными
возбудителями желчевыделения считаются яичные желтки, молоко, мясо и жиры.
Прием пищи и связанные с ним условно— и безусловнорефлекторные раздражители
вызывают активацию желчевыделения. Вначале происходит первичная реакция:
желчный пузырь расслабляется, а затем сокращается. Через 7—10 мин после приема
пищи наступает основной период эвакуаторной деятельности пузыря, который
характеризуется чередованием эпизодов сокращения и расслабления и длится 3—6 ч.
После его окончания сократительная активность желчного пузыря тормозится и в
нем снова начинает депонироваться печеночная желчь.
12.2.5. Секреция кишечных желез
Дуоденальные
(бруннеровы) железы,
располагающиеся в слизистой оболочке двенадцатиперстной кишки, и кишечные
крипты (либеркюновы железы) тонкой кишки продуцируют кишечный сок,
общее количество которого за сутки достигает у человека 2,5 л. Его рН
составляет 7,2—7,5, но при усилении секреции повышается до 8,6. Значительная
часть сока (его плотная часть) состоит из слизи и отторгнутых
эпителиальных клеток. Клетки кишечного эпителия обновляются за сравнительно
короткий срок. В течение примерно 24—36 ч они перемещаются из крипт слизистой
оболочки к вершине ворсинок (рис. 12.12, 12.13), откуда и отторгаются через 3
сут после начала процесса.
|
|
|
Рис.
12.12 Продольный разрез двух
ворсинок и крипты между ними в тонкой кишке, на котором видны клетки слизистой
оболочки и структуры, находящиеся внутри ворсинки |
|
|
|
Рис.
12.13 Строение энтероцита (А) и
микроструктура щеточной каймы (Б) |
Кишечный сок содержит
более 20 различных пищеварительных ферментов. Выделение жидкой части
сока, содержащей различные минеральные вещества и значительное количество
мукопротеина, резко усиливается при механическом раздражении слизистой оболочки
кишки. Продукты переваривания пищевых веществ стимулируют выделение сока,
богатого ферментами. Кишечную секрецию стимулирует также вазоактивный
интестинальный пептид. Соматостатин оказывает на нее тормозное воздействие.
12.3. ПЕРЕВАРИВАНИЕ ПИЩЕВЫХ ВЕЩЕСТВ
В желудочно—кишечном тракте пища
подвергается физической (размельчение, набухание, растворение) и химической
обработке. Последняя заключается в гидролизе питательных веществ до стадии
мономеров. При этом компоненты пищи, сохраняя пластическую и энергетическую
ценность, утрачивают видовую специфичность, поступают в кровь и включаются в
обменные процессы. Гидролиз пищевых веществ осуществляется в определенной
последовательности и в различных отделах желудочно—кишечного тракта имеет свои
особенности.
Полость рта. Здесь осуществляется начальный
гидролиз полисахаридов (крахмала, гликогена), α—амилаза слюны
расщепляет гликозидные связи гликогена и молекул амилозы и амилопектина,
входящих в структуру крахмала, с образованием декстринов. Действие амилазы в
полости рта кратковременно, однако гидролиз углеводов под ее воздействием
продолжается в желудке за счет поступившей сюда слюны. Когда содержимое желудка
под воздействием НCl приобретает кислую реакцию, амилаза инактивируется и
прекращает свое действие.
Желудок. В желудке происходит начальный
гидролиз белков под воздействием протеолитических ферментов
желудочного сока (пепсина, гастриксина, химозина) с образованием полипептидов.
Здесь гидролизуется около 10% пептидных связей. Указанные ферменты активны лишь
в кислой среде, создаваемой НCl. Оптимальная величина рН для пепсина составляет 1,2—2,0,
для гастриксина — 3,2—3,5. Хлористоводородная кислота вызывает набухание и
денатурацию белков, что облегчает их последующее расщепление протеолитическими
ферментами. Действие протеолитических ферментов реализуется главным образом в
поверхностных слоях пищевой массы, прилежащих к стенке желудка. По мере
переваривания этих слоев пищевая масса сдвигается в пилорический отдел, откуда
после частичной нейтрализации эвакуируется в двенадцатиперстную кишку.
Тонкая кишка. Химус (пища, подвергнутая
действию желудочного сока) в двенадцатиперстной и далее в тонкой кишке
подвергается действию ферментов поджелудочной железы и собственно
кишечных ферментов. Оптимальная для их активности среда создается в
результате воздействия на кислый химус желудка щелочных секретов: сока
поджелудочной железы, желчи, кишечного сока. У человека рН в двенадцатиперстной
кишке колеблется в пределах 4,0—8,5; в тонкой кишке он сохраняется в диапазоне
6,5—7,5. Этот диапазон характерен для кишки всех позвоночных.
α—Амилаза поджелудочной железы гидролизует
декстрины до мальтозы и изомальтозы. При этом образуется лишь небольшое
количество глюкозы. Высвобождаемые α—амилазой сахариды подвергаются
дальнейшему гидролизу собственно кишечными карбогидразами (мальтазой, γ—амилазой,
изомальтазой, сахаразой, лактазой, трегалазой) до моносахаридов (глюкозы,
галактозы, фруктозы). Эти ферменты, осуществляющие заключительный этап
гидролиза углеводов, синтезируются непосредственно в кишечных клетках,
локализованы в области мембраны щеточной каймы энтероцитов (см. ниже) и прочно
связаны с ней. Из перечисленных кишечных ферментов лактаза имеется только у
млекопитающих. У тех из них, детеныши которых питаются молоком, не содержащим
лактозу (тюлени, морские львы, моржи), лактаза отсутствует.
Протеолитические
ферменты сока поджелудочной железы (трипсин, химотрипсин, эластаза, карбоксипептидазы А и В)
осуществляют в кишечнике дальнейшее переваривание белков. Трипсин, химотрипсин
и эластаза, как и пепсин, являются эндоферментами. Они расщепляют
главным образом внутренние белковые связи, в результате чего образуются более
или менее крупные фрагменты (поли— и олигопептиды). Эти фрагменты белковых
молекул поступают в пристеночную (примукозальную) зону, которая образована
слоем слизи (слизистыми наложениями). В слизи содержатся в значительном
количестве ферменты, которые по мере перемещения пептидов к апикальной мембране
энтероцитов гидролизуют их до дипептидов. Гидролиз последних до мономеров
(аминокислот) происходит на апикальной поверхности мембран энтероцитов
собственно кишечными ферментами. Экзоферменты (карбоксипептидазы А и В,
аминопептидаза, дипептидазы) отщепляют от пептидной цепи концевые аминокислоты,
в результате чего образуются свободные аминокислоты и малые пептиды, способные
к всасыванию. Аминопептидаза и дипептидазы являются кишечными ферментами и
локализуются в зоне щеточной каймы энтероцитов, где они участвуют в мембранном
гидролизе.
Гидролиз жиров. Начальные этапы гидролиза жиров (из
которых основное значение имеют триглицериды) протекают в полости
двенадцатиперстной кишки под действием липазы сока поджелудочной железы.
Имеются данные о наличии желудочной липазы, которая, однако, действует лишь на
эмульгированные жиры, например на жиры молока. В процессе гидролитического
расщепления жира большое значение имеет процесс эмульгирования. Он
увеличивает поверхность жира, на которой реализуется ферментативная активность
липазы. В процессе эмульгирования жира в кишечнике важную роль отводят желчи.
Показано, что смешанные мицеллы, образованные желчными солями и триглицеридами,
более доступны для действия липазы поджелудочной железы.
Липаза гидролизует
триглицериды с образованием преимущественно 2—моноглицеридов и жирных кислот. В
результате действия фермента эмульгированные жиры в форме моноглицеридов и
жирных кислот постепенно переходят в мицеллярное состояние. Одновременно с
расщеплением триглицеридов происходит гидролиз холестеридов до холестерина и
свободных жирных кислот под действием холестеразы при рН 6,6—8,0. Фосфолипиды.
(преимущественно лецитин) расщепляются фосфолипазой А. Она гидролизует
эфирную связь глицерина и жирной кислоты у второго атома углерода, превращая
лецитин в изолецитин и жирную кислоту. Кишечная моноглицеридлипаза
гидролизует эфирные связи 2—моногдицеридов. В гидролизе жиров у беспозвоночных
участвуют, по—видимому, преимущественно эстеразы. Эти ферменты (кроме липазы)
локализуются в средней кишке ракообразных, насекомых, двустворчатых и
брюхоногих моллюсков.
Кроме указанных групп
ферментов, участвующих в процессе переваривания пищевых веществ, имеется ряд
других. Это щелочная фосфатаза, гидролизующая моноэфиры ортофосфорной
кислоты, нуклеазы (РНКаза и ДНКаза), нуклеотидазы, нуклеозидазы и другие
ферменты, расщепляющие полинуклеотиды и нуклеиновые кислоты. Общей закономерностью,
справедливой, видимо, для огромного большинства живых существ, является
первоначальное переваривание пищи в кислой среде и последующий гидролиз и
всасывание в нейтральной или слабощелочной среде. У примитивных организмов это
достигается благодаря изменению реакции, например, в пищеварительных вакуолях.
У высших животных и человека отдельные звенья пищеварительной цепи реализуются
в различных отделах желудочно—кишечного тракта.
Толстая кишка. Пищеварение в толстой кишке у человека практически отсутствует.
Низкий уровень ферментативной активности в ней выработался в процессе эволюции
и связан с тем, что поступающий в этот отдел желудочно—кишечного тракта химус
беден непереваренными пищевыми веществами. Толстая кишка в отличие от других
отделов кишечника богата микроорганизмами. Значение микробной флоры заключается
в том, что она осуществляет разложение непереваренной пищи и компонентов
пищеварительных секретов, в результате чего образуются органические кислоты,
газы (СО2, СН4, Н2S) и токсические вещества (фенол,
скатол, индол, крезол). Часть этих веществ, поступивших в организм,
обезвреживается печенью (барьерная функция печени). Существенное значение имеет
то, что ферменты бактерий расщепляют целлюлозу, гемицеллюлозу и пектины, на
которые не действуют пищеварительные ферменты. Продукты гидролиза всасываются в
толстой кишке и используются организмом. В толстой кишке всасываются также
некоторые витамины и аминокислоты, продуцируемые микробами кишечной полости.
12.4. МЕМБРАННОЕ ПИЩЕВАРЕНИЕ И
ВСАСЫВАНИЕ
Описанные в предыдущем разделе
гидролитические процессы протекают в полости тонкой кишки, в слое слизистых
наложений и в зоне щеточной каймы энтероцитов (мембранное пищеварение).
Характерной особенностью кишечных клеток (рис. 12.14)
является наличие щеточной каймы, которая образована микроворсинками —
выростами цитоплазмы, ограниченными мембраной. Щеточная кайма энтероцитов —
универсальная структура, свойственная различным животным и человеку. На
апикальной поверхности каждого энтероцита находится около 3—4 тыс.
микроворсинок; на 1 мм2 поверхности кишечного эпителия приходится до
50—100 млн. микроворсинок. У человека и других млекопитающих высота
микроворсинок составляет в среднем 1 мкм, диаметр — около 0,1 мкм. У низших
позвоночных, включая амфибий, микроворсинки могут быть длиннее.
|
|
|
Рис. 12.14 Кишечная клетка 1 — терминальная сеть, 2
— микротрубочки, 3 — свободные рибосомы, 4 — латеральная мембрана, 4—
базальная мембрана, 6 —
межклеточное пространство, 7 —
аппарат Гольджи, 8 – гладкий
ретикулум, гранулярный
эндоплазматический ретикулум, 10 —
лизосомы, 11 — десмосома, 12 —плотный контакт, 13 — микроворсинки. |
Внешняя
поверхность плазматической мембраны энтероцитов покрыта гликокаликсом, который
образует на апикальной поверхности кишечных клеток слой толщиной до 0,1 мкм.
Гликокаликс состоит из множества мукополисахаридных нитей, связанных
кальциевыми мостиками. В гликокаликсе адсорбирован целый ряд пищеварительных
ферментов. Именно на внешней (апикальной) поверхности кишечных клеток,
образующей щеточную кайму с гликокаликсом, осуществляется мембранное
пищеварение.
12.4.1. Мембранное пищеварение
Этот тип пищеварения наблюдается на
всех уровнях эволюционного развития. Оно обнаружено у всех млекопитающих, у
птиц, рыб, амфибий, круглоротых, а также у беспозвоночных животных, в том числе
у насекомых, ракообразных, моллюсков. Мембранное пищеварение осуществляется ферментами,
адсорбированными из полости тонкой кишки (секретируемыми преимущественно
поджелудочной железой), а также собственно кишечными ферментами,
синтезируемыми в кишечных клетках (энтероцитах) и встроенными в мембрану.
Ферменты, адсорбированные на
структурах кишечной слизистой оболочки, реализуют главным образом промежуточные
стадии гидролиза всех основных пищевых веществ. Собственно кишечные ферменты
мембраны энтероцитов осуществляют преимущественно заключительные стадии
расщепления белков, углеводов и, возможно, жиров. Адсорбированные ферменты
связаны в основном со структурами гликокаликса, а собственно кишечные ферменты
встроены в структуры мембраны энтероцитов. Вместе с тем на поверхности мембраны
могут адсорбироваться ферменты, поступающие в полость тонкой кишки с
панкреатическим соком, а собственно кишечные ферменты могут частично включаться
в гликокаликс.
Активные центры ферментов мембраны
энтероцитов ориентированы определенным образом по отношению к мембране и
полости тонкой кишки. Вследствие этого свободная ориентация каталитических
центров ферментов по отношению к гидролизуемым молекулам невозможна, что
является характерной чертой мембранного пищеварения. В зону мембранного
пищеварения проникают преимущественно небольшие молекулы; бактерии в эту
область попасть не могут.
Начальные стадии пищеварения
осуществляются исключительно в полостях желудочно—кишечного тракта (рис.
12.15). Мелкие молекулы (олигомеры), образующиеся в результате полостного
гидролиза,
|
|
|
Рис. 12.15
Взаимодействия между полостным и мембранным пищеварением А — последовательная
деполимеризация пищевых субстратов в полости и на поверхности тонкой кишки; Б —
фрагмент липопротеиновой мембраны с адсорбированными и собственно кишечными
ферментами. 1—3 — субстраты, 4 — апикальный гликокаликс, 5 —
литеральный гликокаликс, 6 — мембрана, 7 — микроворсинки, 8 — панкреатические ферменты, 9 — неэнзиматические факторы, 10 — каталитические центры
ферментов, 11 — мембранные
ферменты, 12— регуляторные
центры ферментов, 13 —
транспортная система мембраны. |
|
|
|
Рис. 12.16 Всасывание ионов в
тонкой кишке млекопитающих 1 —
электрогенный транспорт Na+, 2 — электрогенный транспорт Na+,
сопряженный с транспортом D—гексоз, l—аминокислот, дипептидов,
водорастворимых витаминов, солей желчных кислот (в подвздошной кишке), 3 —
электронейтральный транспорт NaCI, 4 — электронейтральный обмен (Na+
↔ Н+, Cl— ↔ НСО3—). |